携人乳头瘤病毒6型全基因细胞的组织工程皮片培养的初步研究
2015-11-07王飞郭宗科张红叶潘永正董正邦陈梅单莹严翘余卫平
王飞 郭宗科 张红叶 潘永正 董正邦 陈梅 单莹 严翘 余卫平
携人乳头瘤病毒6型全基因细胞的组织工程皮片培养的初步研究
王飞 郭宗科 张红叶 潘永正 董正邦 陈梅 单莹 严翘 余卫平
目的 建立人乳头瘤病毒6型(HPV6)全基因体外组织工程皮片培养模型,为进一步研究HPV病毒周期奠定基础。方法 用电转的方法,将HPV6全长线性基因和质粒pEGFP-▲EGFP共转染hTERT细胞,G418抗性筛选,Southern印迹法检测细胞内HPV病毒含量;3T3 J2滋养层细胞、I型鼠尾胶原与含HPV6基因的hTERT细胞(HPV6.hTERT细胞)混合后,在金属网格上共同培养,逐渐形成皮片样结构。HE染色和免疫组化检测皮片的组织结构和HPV6 L1蛋白表达,电镜检查皮片病毒颗粒。结果 HPV6全长线性基因成功转入hTERT细胞,Southern印迹法检测细胞内含HPV6 DNA;与3T3 J2细胞、I型鼠尾胶原共同培养的HPV6.hTERT细胞随时间而增殖分化,逐渐形成具有疣状增生外观的皮片。皮片HE染色显示,培养7 d即出现典型的皮肤分层结构;培养21 d皮片可见明显乳头瘤样增生、空泡细胞、角化过度、角化不全等HPV感染组织病理表现。免疫组化显示皮片上部有HPV6 L1蛋白表达。电镜检测发现皮片中存在HPV6病毒颗粒。结论 HPV6全基因组织工程皮片培养模型为HPV的生物学研究提供了一个平台,但在应用上有一定的局限性。
人乳头状瘤病毒6;培养技术;病理学;病毒包膜蛋白质类;皮片培养
人乳头瘤病毒(HPV)是小DNA病毒,有严格的 嗜人类上皮组织特性;在体内HPV感染上皮细胞后,随上皮细胞的分化而复制。HPV生活周期与人上皮细胞分化密切相关,故难以用常规、单层细胞培养来繁殖,只能用上皮组织进行培养[1-2]。目前,低危型HPV在体外培养相对困难,给HPV致病机制的研究及治疗药物的研发带来了困难。本研究建立携带HPV6型全基因的hTERT细胞,该细胞与3T3 J2滋养层细胞、鼠胶原共同培养,形成具有疣状增生外观的皮片。检测皮片细胞层L1蛋白的表达和是否存在病毒颗粒,明确HPV6型全基因体外组织工程皮片培养模型是否成功建立。
作者单位:210009南京,东南大学附属中大医院皮肤科(王飞、张红叶、潘永正、董正邦、陈梅、单莹、严翘),整形科(郭宗科);东南大学医学院病理生理学系(余卫平)
材料与方法
一、材料
1.质粒和细胞:hTERT细胞来自美国ATCC细胞库(ATCC Number:CRL-4000);3T3 J2 滋养层细胞,由本实验室传代维持生长;携带HPV6全长基因的质粒pSP65-HPV6,由美国Craig Meyers教授馈赠;质粒pEGFP-1,为美国Clontech公司产品;大肠杆菌DH5a由本室保存。
2.抗体及细胞培养试剂:表皮生长因子、胎牛血清(FBS)(美国 Sigma公司);鼠尾胶原 I型、表皮生长因子(EGF)(美国BD Bioscience公司);内切酶KpnI、BsrG I、BamH1、EcoRI、T4DNA 连接酶 (英国NEB公司);Lipofectamine 2000转染试剂盒(美国Invitrog公司);质粒提取试剂盒(美国Qiagen公司);硝酸纤维素膜(美国Bio-Rad公司);抗HPV 6 L1单克隆抗体(美国Meridian life science公司);辣根过氧化物酶标记的羊抗兔二抗(武汉百翌博科技有限公司);探针Read to Go DNA标记试剂盒纯化柱(Probe Quant G50 microcolumn)(美国 Amersham Pharmacia公司)。
3.主要设备:CO2细胞培养箱(德国Hera Cell公司),GelDoc1000凝胶成像系统和电转仪(美国Bio-Rad公司)。
二、方法
(一)携HPV6全基因细胞株的建立:
1.质粒pEGFP-▲EGFP的构建:用KpnI和BsrG I双酶切质粒pEGFP-1,切除EGFP片段,补平并用T4 DNA连接酶连接成环后,转入感受态细胞DH5a,卡那霉素抗性筛选阳性克隆;用质粒试剂盒提取去掉EGFP段的质粒pEGFP-▲EGFP,TE缓冲液保存。
2.携HPV6全基因hTERT细胞的培养:①30 μg含HPV6型全基因的质粒pSP65-HPV6,用EcoR I酶切得到线状HPV6型全基因,酚/氯仿法回收与纯化,25 μl TE缓冲液保存;②线状HPV6基因和pEGFP-▲EGFP质粒共转入hTERT细胞:10 μl TE缓冲液(7.5 μg线状HPV6)、10 μl(1 μg)pEGFP-▲EGFP质粒、4.25 μl(42.5 μg)鲑鱼精子DNA、275 μl hTERT细胞(5×106)轻轻混匀,电转,细胞转移至10 cm培养皿中,375 mg/L G418筛选,细胞超过80%融合时(13~15),传代,鉴定。
3.hTERT细胞内HPV6基因的检测:①0.25%胰酶-EDTA消化上述转染后80%融合的贴壁生长hTERT细胞,离心、沉淀,液氮中反复冻融;按组织DNA提取试剂盒操作步骤提取细胞内HPV6 DNA;②Southern印迹法检测细胞内HPV6基因,DNA探针的制备按Meyers等[3]制备HPV探针的方法。pSP65-HPV6,EcoR I酶切,0.8%凝胶电泳,纯化得线状HPV6型全基因。参照Read to Go DNA标记试剂盒32P标记探针,纯化柱纯化;按《分子克隆操作指南进行》杂交[4]。
(二)携HPV6型全基因组织工程皮片的培养:
1.携HPV6型全基因皮片的培养:①胰酶消化低代3T3 J2细胞,与Ⅰ型鼠尾凝胶混匀,种于6孔培养板上,每孔6.25×105细胞和2 mlⅠ型鼠尾凝胶,37℃5%CO2培养2 h;②每孔加入1.0×106HPV6.hTERT细胞,培养过夜;③将培养物转移到带网眼的金属培养网格表面,培养基不超过金属培养网孔,每48小时换培养基。
2.携HPV6型全基因的hTERT细胞组织工程皮片病理、免疫组化和电镜观察:①普通病理:收集不同培养时间皮片,HE染色,观察是否生长成皮肤基本结构、空泡细胞是否存在;②免疫组化:不同培养时间皮片,冰冻组织切片,PBS洗3 min,10%FBS封闭15 min后与一抗反应,抗体为HPV6 L1单抗,然后与生物素标记的二抗室温下反应;③电镜:培养21 d的皮片修切成3×3 mm2的组织块,JEM-1200透射电镜观察。
结 果
1.转染后的hTERT细胞内HPV6 DNA的检测:HPV6转染hTERT细胞后提取其DNA,分别取2.5μg、5 μg、7.5 μg,BamH1 酶切,电泳、杂交、曝光。酶切前见3条DNA带,分别为超螺旋、开环和线状结构,酶切后8 000 bp左右单一条带,表明HPV6全基因成功转染hTERT细胞,携HPV6全基因的细胞HPV6.hTERT成功建立,见图1。酶切部位在HPV6基因序列2602-2607。
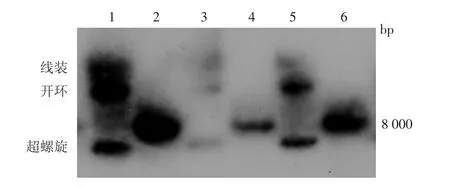
图1 Southern印迹法检测转染后hTERT细胞内HPV6 DNA 1、3、5 酶切前分别为 7.5 μg、2.5 μg、5.0 μg DNA;2、4、6 酶切后,8 000 bp位置出现线状条带
2.HPV 6型全基因体外组织工程皮片培养不同时段大体形态观察:观察培养不同时间皮片形态、颜色的变化。发现随培养时间延长,皮片由表面光滑的粉红色(主要是培养基的颜色),颜色逐渐变淡,变成表面粗糙(培养第7天后)、疣状增生的角化性物质(培养21 d)。见图2。

图2 HPV6型全基因体外组织工程皮片培养不同时段大体形态 2A:第0天,表面光滑;2B:第7天,有细胞长出;2C:第14天,角质样物质形成;2D:第21天,明显疣状增生
3.HPV 6全基因体外组织工程皮片培养不同时段组织结构观察:角化过度和空泡细胞是HPV感染特征性病理改变。在皮片培养7、14、21 d,HE染色和免疫组化检查,观察皮肤结构、空泡细胞和HPV蛋白的表达。发现随皮片培养时间延长,细胞增生,出现角化过度、分层结构和空泡细胞,免疫组化发现HPV L1蛋白,提示皮片有HPV病毒感染。见图 3,4。
4.培养组织工程皮片的病毒颗粒检测:HPV病毒随皮片细胞分化而复制,在培养21 d的皮片,细胞核内见明显病毒颗粒。见图5。
讨 论
在体内HPV感染上皮细胞后,随上皮细胞的分化而复制,感染了HPV的上皮细胞分化增殖形成具有疣状增生外观的组织,该组织具有棘细胞层、颗粒层、角质层等上皮结构,组织病理显示假上皮瘤样增生、角化过度和角化不全,颗粒层和棘细胞层见空泡细胞。含有大量具有感染性的HPV病毒颗粒,其中颗粒层和角质层病毒含量最高[5]。
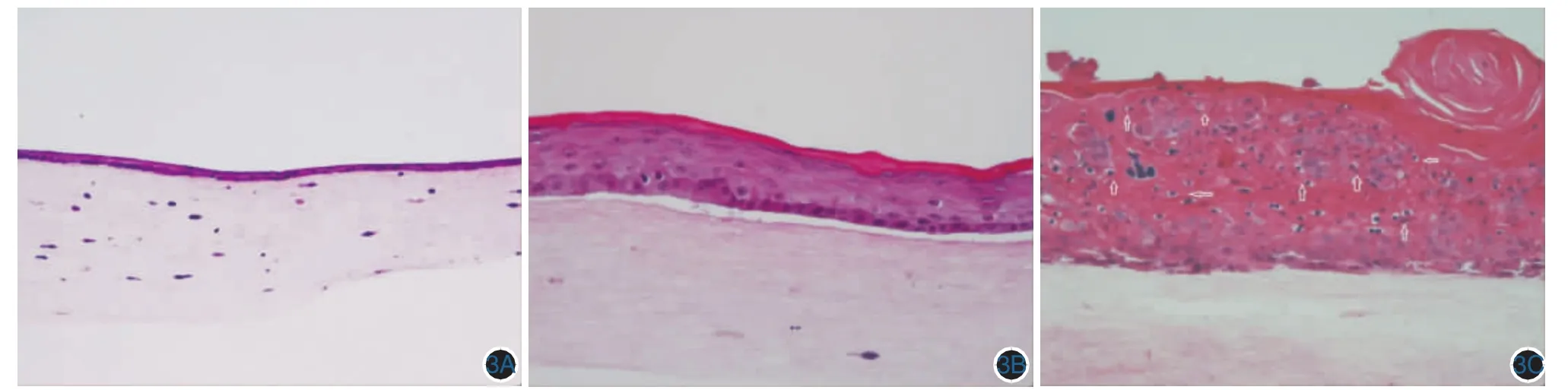
图3 HPV6型全基因体外组织工程皮片培养不同时段组织病理(HE×100) 3A:第7天,3~4层上皮细胞;3B:第14天,6~8层上皮细胞;3C:第21天,10~11层上皮细胞,见明显角化过度,部分空泡细胞

图4 HPV6型全基因体外组织工程皮片培养不同时段免疫病理(HE×100) 4A:第7天,未见L1蛋白表达;4B:第14天,未见L1蛋白表达;4C:第21天,L1染色阳性,近角质层较多棕色颗粒

图5 病毒透视电镜(5A:TEM×50 000) 箭头所指为细胞内HPV6病毒颗粒,5B、5C分别是局部放大
Asselineau与Prunieras在1984年首次提出三维上皮细胞培养模型[5-6]。2004年 Meyers等利用此模型,将HPV16全基因组分别通过电穿孔法转入PHK,抗生素筛选后形成携带HPV全基因组的PHK,然后将其种植在真皮类似物表面。经过12~21 d,HPV阳性PHKs分层分化,形成的复层上皮组织出现空泡细胞及角化不全,上皮的表层L1衣壳蛋白呈阳性表达,含有感染性的病毒颗粒[7]。近年来很多人在Meyer研究基础上改进实验方法,尝试体外培养不同型别的HPV天然病毒颗粒,多种HPV亚型,包括低危的HPV11,利用三维上皮培养模型,在体外复制成功[8-10]。低危型HPV在体外较高危型HPV难以培养,其原因是低危型HPV通常不能整合入宿主细胞的染色体,在宿主细胞里复制一代较高危型时间长,且复制较少[11]。
我们用改良的Meyers进行HPV6的体外培养。为了培养HPV,必须将HPV病毒全基因转入角质形成细胞;病毒DNA随细胞分化而复制,提高HPV转染率和增加角质形成细胞传代是重要一步。我们曾用来自包皮的原代角质形成细胞作为宿主细胞,将HPV6全长线性基因转入其中,因原代细胞生命周期较短,转染效率很低,培养细胞内难以检测到病毒DNA。后比较多种细胞,发现永生化的角质形成细胞株hTERT细胞(含人端粒酶逆转录酶hTERT)是较好的 HPV6 宿主细胞[12]。采用电转(而不是脂质体转染)的方法将线性HPV全长线性基因转入hTERT细胞,通过调整电转参数来获得最佳转染率。研究发现低电流、长时间电转可有效提高HPV基因转入细胞的转入率,电转时间最长可到180 s;低代hTERT细胞电转后有更低的死亡率且能较长时间传代。
为了将成功转染的细胞筛选出来,采用了G418抗性基因筛选的方法。在电转HPV6全长线性基因的同时,将G418抗性基因pEGFP-▲EGFP,共同转入hTERT细胞,使含HPV基因的hTERT细胞有抗G418的能力。质粒pEGFP-1为4 200 bp的真核表达载体,内含约800 bp表达绿色荧光蛋白(EGFP)的报告基因,因该报告基因在本研究中无意义,且小质粒有利于转染效率的提高,故用内切酶切掉EGFP片段。G418梯度筛选,G418杀死未成功转染HPV的hTERT细胞,含HPV的hTERT细胞分化繁殖、逐渐相互融合。检测发现子代hTERT细胞内稳定富含HPV DNA,是永生化细胞,该细胞可用于HPV6体外培养模型的建立。本研究用Southern印迹分析,证实转染细胞HPV质粒DNA的存在,用BamH1酶切,酶切前DNA3条带,酶切后发现在8 000 bp处有明确条带。
用改良的Meyers的方法,试图建立HPV6体外组织工程皮片培养模型,但皮片病毒的生成很不稳定,分析认为转染后皮片培养时间和培养基成分可能对病毒生成有影响。缩短转染后的培养时间,电转染后培养7 d左右,细胞融合为50%左右(不等到80%~90%融合),不进行传代,就将含HPV6全基因的高活力hTERT细胞与3T3 J2滋养层细胞、Ⅰ型鼠胶原在特制金属网格上混合培养;培养基换成角质形成细胞专门培养基,且多次加入表皮生长因子和某些金属离子,常规液体培养基不超过金属网格。培养18 d时,偶能发现HPV病毒颗粒和病毒蛋白。皮片培养随时间推移,细胞增生分化,从单层细胞逐渐分化为8~10层细胞,见典型的表皮结构,大体形态出现不同的外观,由表面光滑变成表面粗糙,培养21 d时,出现明显角化外观;培养5 d时,HE染色即见细胞分化为3层细胞,随时间推移,细胞层数增多,角化明显,出现基底层、棘细胞层、颗粒层、角质层,疣状增生和特征性空泡细胞。21 d后,细胞角化更明显,但细胞层数减少。
HPV6组织工程皮片培养模型为HPV的生物学研究提供了一个平台,但制备周期长、操作复杂,条件要求高,病毒产生不稳定等,使其在应用上有一定的局限性。
[1]Conway MJ,Meyers C.Replication and assembly of human papillomaviruses[J].J Dent Res,2009,88(4):307-317.
[2]Schiller JT,Day PM,Kines RC.Current understanding of the mechanism of HPV infection [J].Gynecol Oncol,2010,118(1 Suppl):S12-S17.
[3]Meyers C,Frattini MG,Hudson JB,et al.Biosynthesis of human papillomavirusfrom acontinuouscelllineupon epithelial differentiation[J].Science,1992,257(5072):971-973.
[4]Ausubel FM,Brent R,Kingston RT.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,2001:55-68.
[5]Andrei G,Duraffour S,Van den Oord J,et al.Epithelial raft cultures for investigations of virus growth,pathogenesis and efficacy of antiviral agents[J].Antiviral Res,2010,85(3):431-449.
[6]张红叶,王飞.人乳头瘤病毒体内外培养模型研究进展[J].临床皮肤科杂志,2012,41(4):255-256.
[7]McLaughlin-Drubin ME,Christensen ND,Meyers C.Propagation,infection,and neutralization of authentic HPV16 virus[J].Virology,2004,322(2):213-219.
[8]Fang L,Meyers C,Budgeon LR,et al.Induction of productive human papillomavirus type 11 life cycle in epithelial cells grown in organotypic raft cultures[J].Virology,2006,347(1):28-35.
[9]McLaughlin-Drubin ME,Wilson S,Mullikin B,et al.Human papillomavirus type 45 propagation,infection,and neutralization[J].Virology,2003,312(1):1-7.
[10]Meyers C,Bromberg-White JL,Zhang J,et al.Infectious virions produced from a human papillomavirus type 18/16 genomic DNA chimera[J].J Virol,2002,76(10):4723-4733.
[11]Broutian TR,Brendle SA,Christensen ND.Differential binding patterns to host cells associated with particles of several human alphapapillomavirus types[J].J Gen Virol,2010,91(Pt 2):531-540.
[12]Dickson MA,Hahn WC,Ino Y,et al.Human keratinocytes that expresshTERT and also bypassa p16 (INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics[J].Mol Cell Biol,2000,20(4):1436-1447.
Preparation of tissue-engineered skin grafts with hTERT cells carrying human papillomavirus type 6 genomein vitro:a preliminary study
Wang Fei*,Guo Zongke,Zhang Hongye,Pan Yongzheng,Dong Zhengbang,Chen Mei,Shan Ying,Yan Qiao,Yu Weiping.*Department of Dermatology,Zhongda Hospital,Southeast University,Nanjing 210009,China
ObjectiveTo establish a model for preparation of tissue-engineered skin grafts with hTERT cells carrying human papillomavirus type 6 (HPV 6)genomein vitro,so as to lay a foundation for studying HPV life cycle.MethodsThe full-length linear HPV6 genome and plasmid pEGFP-▲EGFP were electrophoretically cotransferred into hTERT cells.After selection using G418 resistance,Southern blotting was performed to determine the viral load of HPV6 in transfected cells.3T3 J2 trophoblastic cells,type I rat-tail collagen and hTERT cells containing the full-length HPV6 genes (HPV6.hTERT cells)were mixed and cocultured on metal meshes to form skin graft-like structures.Hematoxylin and eosin(HE)staining was performed to observe the structure of formed skin grafts,an immunohistochemical assay to measure the expression of HPV6 L1 protein,and electron microscopy to observe virus particles in the skin grafts.ResultsThe linear HPV6 gene was successfully transferred into hTERT cells,and Southern blotting showed the presence of HPV6 DNA in the transferred hTERT cells.The HPV6.hTERT cells,which were cocultured with 3T3 J2 trophoblastic cells and type I rat-tail collagen,proliferated and differentiated over time,and gradually formed skin grafts giving the appearance of verrucous hyperplasia.HE staining showed that the cocultured HPV6.hTERT cells could form typical stratified structure of skin after 7 days of cultivation,and histopathologic features of HPV infection,including obvious papillomatous hyperplasia,presence of vesicular cells,hyperkeratosis and parakeratosis,could be observed after 21 days.The immunohistochemical assay showed the expression of HPV6 L1 protein in the upper portion of skin grafts,and electron microscopy revealed the presence of HPV6 virus particles in skin grafts.Conclusions The established model for preparation of tissue-engineered skin grafts using HPV 6 genome-carrying cells provides a basis for biological studies of HPV,but its application is limited to some degree.
Human papillomavirus 6;Culture techniques;Pathology;Viral envelope proteins;Raft culture
Wang Fei,Email:ffwangfei@163.com
10.3760/cma.j.issn.0412-4030.2015.05.006
江苏省自然科学基金(BK2012748);教育部留学回国人员科研启动基金(20121707);南京市科技发展项目(201104028)
王飞,Email:ffwangfei@163.com
2014-05-15)
(本文编辑:吴晓初)
