中国部分地区淋球菌耐药监测点产青霉素酶淋球菌及其blaTEM-135突变体的流行调查
2015-11-07陈绍椿尹跃平戴秀芹郑和平顾伟鸣郑钟洁吴兴中曹文苓胡丽华朱邦勇孙厚华陈祥生
陈绍椿 尹跃平 戴秀芹 郑和平 顾伟鸣 郑钟洁吴兴中 曹文苓 胡丽华 朱邦勇 孙厚华 陈祥生
中国部分地区淋球菌耐药监测点产青霉素酶淋球菌及其blaTEM-135突变体的流行调查
陈绍椿 尹跃平 戴秀芹 郑和平 顾伟鸣 郑钟洁吴兴中 曹文苓 胡丽华 朱邦勇 孙厚华 陈祥生
目的 了解中国不同地区淋球菌耐药监测点产青霉素酶淋球菌(PPNG)的比例及blaTEM-135突变体在PPNG中的分布,比较PPNG及blaTEM-135突变体淋球菌多抗原测序分型(NG-MAST)的型别分布,了解不同地区PPNG blaTEM-135突变体的差异与联系。方法 2012年在江苏、上海、浙江、天津、广东、广西6个淋球菌耐药监测点共收集572株淋球菌,经过分离纯化及鉴定后,采用头孢噻吩纸片法测定PPNG;菌株培养后利用试剂盒提取DNA,通过错配扩增突变分析PCR(MAMA PCR)鉴定blaTEM-135突变体,采用NG-MAST进行分型研究。结果 572株淋球菌中PPNG总阳性率为38.1%(218/572),PPNG中相应blaTEM-135突变体的总比例为52.3%(114/218)。监测点中PPNG 阳性率从高至低分别为:浙江(45/87,51.7%)、上海(36/79,45.6%)、广东(78/205,38.0%)、广西(12/32,37.5%)、江苏(24/77,31.2%)、天津(23/92,25%);PPNG 中相应 blaTEM-135突变体的阳性率从高至低分别为:浙江(31/45,68.9%)、江苏(14/24,58.3%)、广东(39/78,50.0%)、上海(17/36,47.2%)、天津(9/23,39.1%)、广西(4/12,33.3%)。NG-MAST分型研究显示,blaTEM-135突变体中流行菌株型别有ST2318、ST1768、ST1866、ST1053、ST8726等,其中ST1768、ST1053和ST8726与blaTEM-135突变体有较强的对应关系。天津PPNG菌株及blaTEM-135突变体ST分布与其他各监测点有显著差异,江浙沪地区菌株ST有一定联系。结论中国淋球菌耐药监测点PPNG及相应blaTEM-135突变体阳性率处于较高水平,不同地区间PPNG及相应blaTEM-135突变体阳性菌株ST型别分布差异有统计学意义。
奈瑟球菌,淋病;β内酰胺酶类;流行病学;blaTEM-135突变体;NG-MAST
淋球菌是淋病的病原体,临床使用抗生素治疗淋球菌感染。最早曾使用青霉素进行治疗,但淋球菌易于获得外源耐药基因而产生耐药性,1976年就发现首例由质粒介导的产青霉素酶的淋球菌(penicillinase-producingNeisseria gonorrhoeae,简称PPNG)[1-2]。而后这种产青霉素酶的淋球菌菌株很快在全球传播开,使青霉素不再作为一线药物用于淋病治疗。现在仅剩一线治疗药物为头孢类抗生素,但是近年来世界各地已经分别出现头孢耐药的超级淋球菌菌株[3-5],并且出现多例头孢菌素临床治疗失败病例[3-4,6-10],我们正面临挑战。
PPNG 是由 blaTEM-1质粒介导产生的[1-2],该种 β内酰胺酶可以降解青霉素,不能降解头孢菌素。但在一些肠杆菌属的研究中发现,blaTEM质粒可通过多位点突变进化为产超广谱β内酰胺酶(extendedspectrum β-lactamases,简称 ESBL)的质粒[11]。因此,淋球菌中介导PPNG的blaTEM-1质粒很可能通过类似突变积累机制,进化为产生ESBL的“超级淋球菌”,从而具有降解各类头孢菌素的能力。令人担忧的是,现阶段淋球菌中已经出现具有进化为产ESBL 潜在能力的 blaTEM-135突变体[12-13]。blaTEM-135突变体是在其编码的氨基酸序列的第182位发生Met182Thr(甲硫氨酸换为苏氨酸)的氨基酸替换。该位点位于两个重要功能区的链接部位,Met182Thr氨基酸替换将提高β内酰胺酶的热稳定性并极大增强其他位点突变带来的效应,导致淋球菌产生ESBL。现在在亚洲局部区域(日本、泰国)已经出现了一定比例的blaTEM-135突变体[12-13],因为青霉素在较长时间内不再作为淋病治疗药物,很多地区对PPNG的监测和研究力度也有所下降,对新产生的blaTEM-135突变菌株缺少相关数据以及分子流行病学研究。我们的前期研究已经发现,南京blaTEM-135突变体的比例很高[14]。鉴于ESBL的重要性,我们将淋球菌耐药监测点收集的临床菌株进行PPNG的测定,并通过简易快速的错配扩增突变分析(mismatch amplification mutation assay,MAMA)检测 blaTEM-135突变体,采用淋球菌多抗原测序分型技术(NG-MAST)对所有blaTEM-135突变体菌株进行分子分型研究,从而初步了解中国潜在超广谱β内酰胺酶淋球菌的分布及分子流行病学信息。
材料和方法
一、菌株收集及PPNG测定
2012年中国疾病预防控制中心性病控制中心收集来自江苏、上海、浙江、天津、广东、广西壮族自治区(广西)淋球菌耐药监测点的572株淋球菌,经过分离纯化及革兰染色、氧化酶实验初步鉴定后,利用头孢噻吩法判断菌株是否产β内酰胺酶。菌株鉴定后-70℃保存于脱脂牛奶管中。
二、DNA提取
菌株统一用淋球菌血琼脂培养基[每500 ml含18 g GC琼脂粉(淋球菌基础琼脂粉,英国Oxoid公司产品),50 ml无菌脱纤维羊血(南京便诊生物科技有限公司)]复苏后,刮取平板上菌落于200 μl磷酸盐缓冲液(PBS)中混悬均匀,使用比浊仪(620 nm)调整菌悬液浓度至0.1麦氏单位。使用德国Qiagen公司生产的QIAxtractor全自动核酸纯化仪提取DNA,所用试剂为仪器配套的QIAxtractor DX试剂盒。实验操作按照仪器说明书及提取液体样本的试验方案进行,方案如下:向200 μl菌悬液中加入120 μl DXL缓冲液(细胞裂解液),45℃振荡加热处理1 h。待样本冷却至室温,2 500×g离心10 min。转移300 μl上清至2 000 μl样本板中,进行全自动核酸纯化。
三、PCR扩增鉴定blaTEM-135突变体
blaTEM-135突变体鉴定采用 Nakayama 等[13]报道的错配扩增突变分析PCR,简要流程如下:根据文献合成以下两对引物:一对引物为TEM-F,5′-GTC GCCCTTATTCCCTTTTTTG-3′,TEM-R,5′-TAGTGT ATGCGGCGACCGAG-3′,用于扩增TEM基因序列22-268位碱基片段(blaTEM-1和blaTEM-135都含有这一片段而且完全匹配,PPNG菌株不管含有blaTEM-1还是blaTEM-135突变体都能够扩增出该片段)。另一对引物用于区分blaTEM-1和blaTEM-135,上游引物MAMA-F,5′-GCATCTTACGGATGGCATGAC-3′,下游引物MAMA-R,5′-TGTTGCCATTGCTGCAGGGG-3′,下划线标示的GG为blaTEM-1错配碱基,只有含有blaTEM-135突变体的PPNG才能扩增出来。综合两对引物的扩增结果,仅有TEM引物扩增出blaTEM-1,TEM引物和MAMA引物都能扩增出blaTEM-135突变体。所有引物均由上海生工生物工程技术服务有限公司合成。扩增采用ABI 9700型PCR基因扩增仪。PCR扩增采用10 μl反应体系,包括:2×Emerald Amp PCR Master Mix[反应预混液,宝生物工程(大连)有限公司]5 μl,上游引物 0.25 μl,下游引物 0.25 μl,模板 DNA 0.5 μl,水 4 μl。PCR 程序设定如下:96 ℃变性 2 min,96 ℃ 10 s,56℃ 10 s,72 ℃ 30 s扩增25个循环,72℃延伸2 min,4℃保温。日本国立传染病研究所Nakayama教授赠予的NGON 00-002菌株DNA(含blaTEM-1)和NGON08-003菌株DNA(含blaTEM-135)作为PCR实验对照品。PCR产物通过15 g/L琼脂糖凝胶电泳进行鉴定,电泳DNA标准参照物采用50 bp DNA Ladder[宝生物工程(大连)有限公司]。
四、NG-MAST分型
NG-MAST分型采用Martin 等[15]的方法,简述如下:PCR扩增porB基因和tbpB基因,扩增产物进行15g/L琼脂糖凝胶电泳,在正确位置有条带的产物送至北京华大基因公司进行纯化测序。porB基因测序结果与基因库中已知序列(GenBank号:M21289)进行比对,以M21289序列为参考,截取从第455位碱基开始的490 bp大小的基因片段进入NG-MAST网站(www.ng-mast.net)比对以获取porB基因的等位基因型别;tbpB基因测序结果与基因库中已知序列(GenBank号:U65222)进行比对,以U65222序列为参考,截取从第1118位碱基开始的390 bp大小的基因片段进入NG-MAST网站比对以获取tbpB基因的等位基因型别;最后再综合porB和tbpB基因的等位基因型别从NG-MAST网站获取该菌株的基因型别。
结 果
一、各耐药监测点PPNG和blaTEM-135突变体的流行率
错配扩增突变分析PCR电泳结果见图1,2。如果图1,2对应位置都有PCR扩增产物,则该样本含有blaTEM-135突变体;如果仅图1有PCR扩增产物,而图2对应位置没有扩增产物条带,则该样本不含blaTEM-135突变体。本次试验共检测572株淋球菌,PPNG及其相应的blaTEM-135突变体的比例分别为38.1%(218/572)和 52.3%(114/218),具体见表 1。各监测点PPNG阳性比例从高至低排列顺序为:浙江、上海、广东、广西、江苏、天津。各监测点PPNG阳性菌株中blaTEM-135突变体比例从高至低排列顺序为:浙江、江苏、广东、上海、天津、广西。浙江PPNG及blaTEM-135突变体比例居于各监测点首位。
二、PPNG菌株NG-MAST型别分布
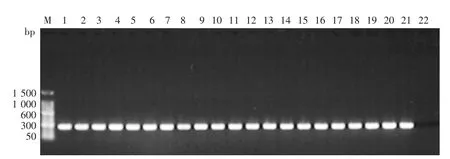
图1 TEM-F和TEM-R引物扩增产物电泳结果 扩增产物为TEM基因序列22-268位247 bp大小碱基片段,所有产青霉素酶淋球菌阳性样本都可扩增出相应条带。M:标准参照物;1:blaTEM-135突变体阳性对照;2:blaTEM-135突变体阴性对照;3~21:临床样本;22:空白对照
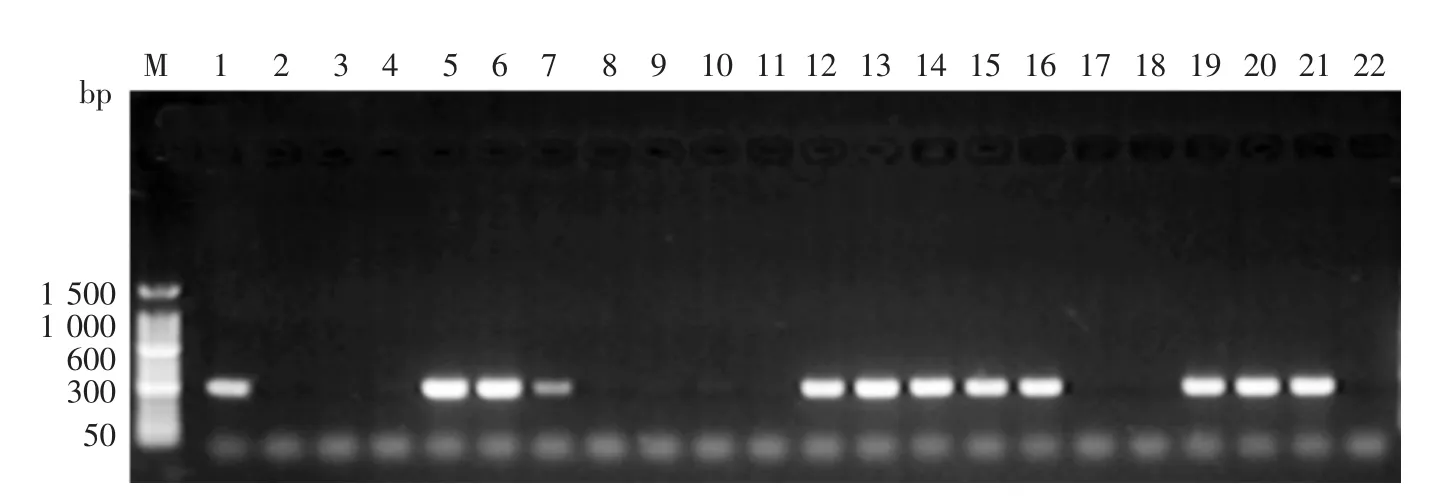
图2 MAMA-F和MAMA-R引物扩增产物电泳结果 扩增产物为含有blaTEM-135突变体的TEM基因片段,片段大小仍然为247 bp,不含blaTEM-135突变体的样本PCR不能扩增出产物。M:标准参照物;1:blaTEM-135突变体阳性对照;2:blaTEM-135突变体阴性对照;3~21:临床样本;22:空白对照
对218株PPNG阳性菌株进行NG-MAST分型,结果显示共有158个ST型别,菌株数量≥3的ST型别见表2。所有型别中,ST4846丰度最高(n=9)。在PPNG菌株中,某些ST型别与blaTEM-135突变体有较强的对应关系,如 ST1053、ST1768、ST8726,属于这些型别的所有菌株均为blaTEM-135突变体(表3)。天津监测点(华北地区)PPNG菌株及blaTEM-135突变体的ST型别分布与东南沿海地区监测点有显著不同,浙江、江苏、上海监测点(华东地区)PPNG菌株及blaTEM-135突变体ST型别相似性较高,主要流行ST 型别(ST4846,ST2318,ST1866)在华东和华南地区都有分布。
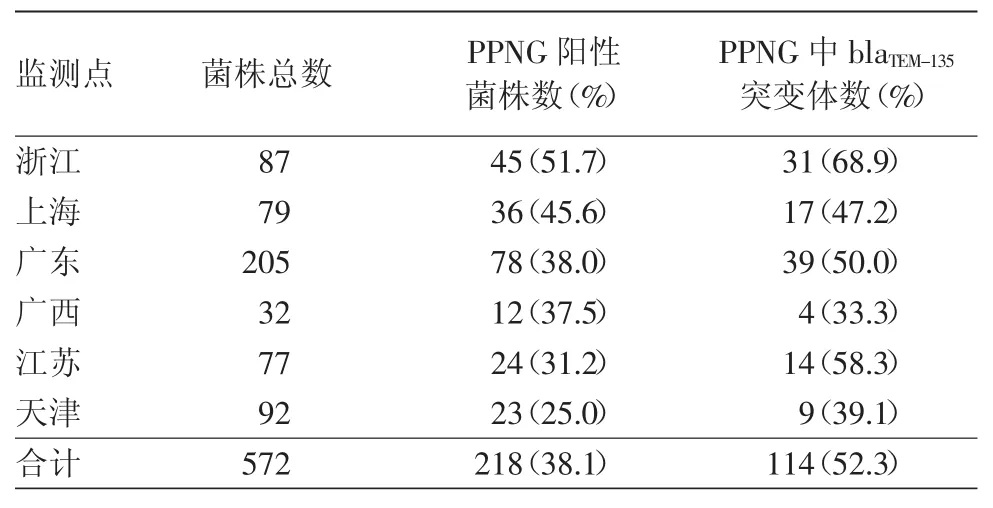
表1 2012年6个耐药监测点产青霉素酶的淋球菌(PPNG)及其相应的blaTEM-135突变体分布
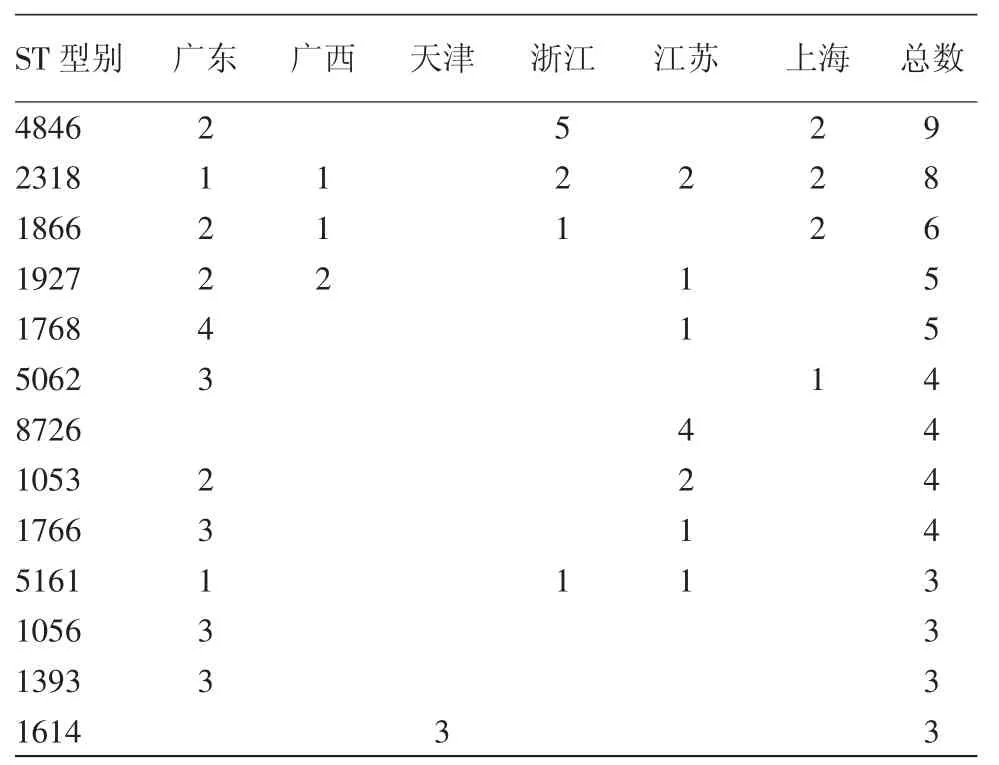
表2 2012年6个监测点PPNG菌株NG-MAST型别分布(株)
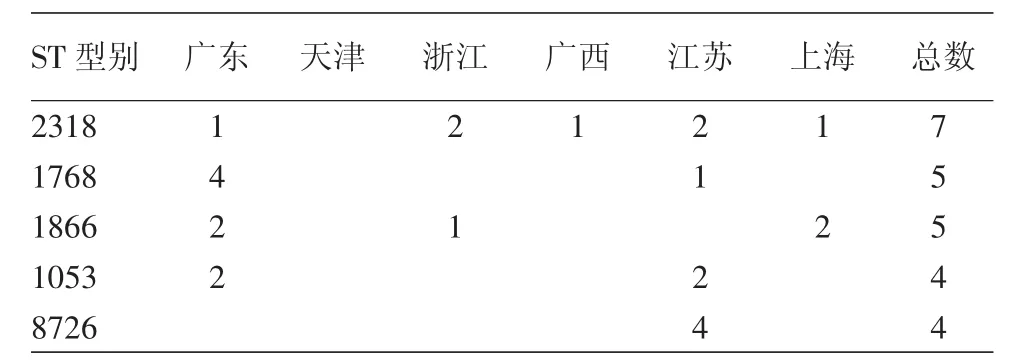
表3 2012年度各监测点blaTEM-135突变体NG-MAST型别分布(株)
讨 论
淋球菌blaTEM-135突变体是新近报道的产β内酰胺酶的突变体,该突变体可能是产ESBL淋球菌的一个重要过渡。Ohnishi等最早在日本发现两株blaTEM-135突变体[12],然后他们对泰国进行了流行病学调查[13],数据显示泰国 2005—2007年收集的菌株中PPNG的比例是79.3%(96/121),其中blaTEM-135突变体的比例是9.4%(9/96)。而我们前期在江苏点的预实验发现PPNG阳性率远低于泰国,但相应blaTEM-135突变体的总比例又远高于泰国[14],我们推测中国blaTEM-135突变体比例应当处于较高水平。我国浙江省PPNG及blaTEM-135突变体高达51.7%和68.9%。产ESBL的blaTEM基因主要有两种来源,一种是通过基因重组从外源(致病或非致病微生物)获取相关基因,另一种是通过突变的积累,通常以其细胞内一种常规酶类为基础,在环境抗生素选择性压力的筛选下,逐渐积累能够提高其生存能力的耐药突变。
本次研究所选耐药监测点的淋病疫情大部分位于全国前列,我们的研究发现,东南沿海及华南一些省份是淋病高发地区,同时也是PPNG和blaTEM-135突变体高阳性率地区,两者之间有一定相关性。NG-MAST分型实验表明,地处华北的天津监测点PPNG和blaTEM-135突变体的菌株型别与东南沿海省份明显不同,可能与南北地域隔离、人口流动以及性网络构成有关。华东地区的流行菌株有较多重叠,可能与江浙沪同处长三角地区、地域接近、人口交往频繁有关。
日本最早发现的两株blaTEM-135突变体的NGMAST 型别分别是 ST1549、ST4013[15],泰国发现的9株blaTEM-135突变体的NG-MAST型别分别是ST5134、ST5138、ST5132、ST1292、ST147、ST5135、ST211[13],这些型别在中国的突变体中都没有出现,说明我国的突变体菌株构成与日本、泰国有较大差异,这一差异可能源于空间上较大的地域跨度以及不同地域之间性网络无交叉,同时也证明我国blaTEM-135突变体的产生主要是由于本地的选择压力独立进化产生,少数型别序列与日本、泰国突变体序列有较高同源性,证明有共同的起源,或在进化过程中有一定的交叉重叠。
本次研究发现,在PPNG菌株中,某些ST型别与blaTEM-135突变体有较强的对应关系,属于这些型别的所有菌株均为blaTEM-135突变体。NG-MAST型别与淋球菌的特定性状之间的对应关系在很多研究中也有发现,如在头孢低敏和耐药菌株的研究中发现头孢耐药特性与ST1407和ST4220两种型别有极强的相关性[3-4]。所以在某一特定区域内,充分利用分子分型技术建立具有某一特性的菌株型别数据库,从而建立起当地淋球菌流行簇的分子生物学档案是有意义的[16]。我们也希望将PPNG和blaTEM-135突变体的监测持续下去,并建立起blaTEM-135突变体的分子流行病学档案,为将来可能出现的产ESBL淋球菌的溯源提供依据。
志谢 日本国立传染病研究所大西真教授(Ohnishi Makoto)、中山周一教授(Nakayama Shu-ichi)给予技术支持并赠DNA对照品
[1]Ashford WA,Golash RG,Hemming VG.Penicillinase-producingNeisseria gonorrhoeae[J].Lancet,1976,2(7987):657-658.
[2]Phillips I.Beta-lactamase-producing,penicillin-resistant gonococcus[J].Lancet,1976,2(7987):656-657.
[3]Ohnishi M,Golparian D,Shimuta K,et al.IsNeisseria gonorrhoeaeinitiating a future era ofuntreatable gonorrhea?:detailed characterization of the first strain with high-level resistance to ceftriaxone[J].Antimicrob Agents Chemother,2011,55(7):3538-3545.
[4]Unemo M,Golparian D,Nicholas R,et al.High-level cefiximeand ceftriaxone-resistantNeisseria gonorrhoeaein France:novel penA mosaic allele in a successful international clone causes treatment failure[J].Antimicrob Agents Chemother,2012,56(3):1273-1280.
[5]Cámara J,Serra J,Ayats J,et al.Molecular characterization of two high-levelceftriaxone-resistantNeisseriagonorrhoeaeisolates detected in Catalonia,Spain[J].J Antimicrob Chemother,2012,67(8):1858-1860.
[6]Ison CA,Hussey J,Sankar KN,et al.Gonorrhoea treatment failures to cefixime and azithromycin in England,2010 [J/OL].Euro Surveill,2011,16 (14).pii:19833 [2014-10-10].http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19833
[7]Unemo M,Golparian D,Hestner A.Ceftriaxone treatment failure of pharyngeal gonorrhoea verified by international recommendations,Sweden,July 2010[J/OL].Euro Surveill,2011,16(6).pii:19792[2014-10-10].http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19792
[8]Unemo M,Golparian D,Syversen G,et al.Two cases of verified clinical failures usinginternationallyrecommended first-line cefixime for gonorrhoea treatment,Norway,2010 [J/OL].Euro Surveill,2010,15 (47).pii:19721 [2014-10-10].http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19721
[9]Unemo M,Golparian D,Potocnik M,et al.Treatment failure of pharyngeal gonorrhoea with internationally recommended first-line ceftriaxone verified in Slovenia,September 2011 [J/OL].Euro Surveill,2012,17 (25).pii:20200 [2014-10-10].http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20200
[10]Tapsall J,Read P,Carmody C,et al.Two cases of failed ceftriaxone treatmentin pharyngealgonorrhoea verified by molecular microbiological methods[J].J Med Microbiol,2009,58(5):683-687.
[11]Michael GB,Butaye P,Cloeckaert A,et al.Genes and mutations conferring antimicrobial resistance in Salmonella:an update[J].Microbes Infect,2006,8(7):1898-1914.
[12]Ohnishi M,Ono E,Shimuta K,et al.Identification of TEM-135 beta-lactamase in penicillinase-producingNeisseria gonorrhoeaestrains in Japan [J].Antimicrob Agents Chemother,2010,54(7):3021-3023.
[13]Nakayama S,Tribuddharat C,Prombhul S,et al.Molecular analyses of TEM genes and their corresponding penicillinase-producingNeisseriagonorrhoeaeisolates in Bangkok,Thailand [J].Antimicrob Agents Chemother,2012,56(2):916-920.
[14]Chen SC,Yin YP,Dai XQ,et al.Prevalence and molecular epidemiological typing of penicillinase-producingNeisseria gonorrhoeaeand their bla(TEM-135)gene variants in Nanjing,China[J].Sex Transm Dis,2013,40(11):872-876.
[15]Martin IM,Ison CA,Aanensen DM,et al.Rapid sequence-based identification of gonococcal transmission clusters in a large metropolitan area[J].J Infect Dis,2004,189(8):1497-1505.
[16]陈绍椿,尹跃平,戴秀芹,等.淋球菌对头孢曲松的敏感性及淋球菌多抗原测序分型研究[J].中华皮肤科杂志,2014,47(5):316-319.
Penicillinase-producingNeisseria gonorrhoeaeand its blaTEM-135gene variants at several gonococcal antimicrobial surveillance sites in China:an epidemiological study
Chen Shaochun*,Yin Yueping,Dai Xiuqin,Zheng Heping,Gu Weiming,Zheng Zhongjie,Wu Xingzhong,Cao Wenling,Hu Lihua,Zhu Bangyong,Sun Houhua,Chen Xiangsheng.*Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College;National Center for Sexually Transmitted Disease Control,China Center for Disease Control and Prevention,Nanjing 210042,China
ObjectiveTo determine the prevalence of penicillinase-producingNeisseria gonorrhoeae(PPNG)and the distribution of blaTEM-135gene variants in PPNG at several gonococcal antimicrobial surveillance sites in China,to compareN.gonorrhoeaemulti-antigen sequence typing(NG-MAST)types of PPNG and its blaTEM-135gene variants,and to assess the difference and association in NG-MAST types of blaTEM-135gene variants among different regions.MethodsA total of 572N.gonorrhoeaeisolates were collected at 6 gonococcal antimicrobial surveillance sites from Jiangsu,Shanghai,Zhejiang,Tianjin,Guangdong and Guangxi in 2012.After isolation,purification,and identification,cefalotin paper discs were used for detection of PPNG.DNA was extracted by QIAxtractor DX kits after cultivation of the PPNG strains.Then,mismatch amplification mutation assay(MAMA)PCR was performed to identify blaTEM-135variants,and NG-MAST analysis to determineN.gonorrhoeaegenotypes.ResultsAmong the 572N.gonorrhoeaestrains,38.1%(218/572)were identified as PPNG,and of the PPNG strains,52.3% (114/218)were blaTEM-135variants.The detection rate of PPNG at these surveillance sites from high to low was as follows:51.7% (45/87,Zhejiang),45.6%(36/79,Shanghai),38.0% (78/205,Guangdong),37.5% (12/32,Guangxi),31.2% (24/77,Jiangsu)and 25.0%(23/92,Tianjin),and that of blaTEM-135variants was as follows:68.9%(31/45,Zhejiang),58.3%(14/24,Jiangsu),50.0%(39/78,Guangdong),47.2%(17/36,Shanghai),39.1%(9/23,Tianjin)and 33.3%(4/12,Guangxi).NG-MAST analysis showedthat the ST2318,ST1768,ST1866,ST1053 and ST8726 types predominated among these blaTEM-135variants,and a strong correlation was found between blaTEM-135variants and some NG-MAST types,such as ST1768,ST1053 and ST8726 types.The distribution of NG-MAST types was significantly different between the surveillance site in Tianjin(in the Northern part of China)and the other sites (in the Southern part of China),but highly similar among the surveillance sites in Jiangsu,Zhejiang and Shanghai regions.Conclusions There is a high prevalence of PPNG and its blaTEM-135variants at several gonococcal antimicrobial surveillance sites in China,with significant differences in NG-MAST genotype distribution of PPNG and its blaTEM-135variants among different regions.
Neisseria gonorrhoeae;beta-Lactamases;Epidemiology;blaTEM-135Gene variant;Neisseria gonorrhoeaemulti-antigen sequence typing
Yin Yueping,Email:yinyp@ncstdlc.org
作者单位:210042南京,中国医学科学院北京协和医学院皮肤病研究所,中国疾病预防控制中心性病控制中心(陈绍椿、尹跃平、戴秀芹、孙厚华、陈祥生);广东省皮肤病医院(郑和平、吴兴中);上海市皮肤病医院(顾伟鸣);天津市疾病预防控制中心(郑钟洁);广州市皮肤病防治所(曹文苓);浙江省皮肤病防治研究所(胡丽华);广西壮族自治区皮肤病防治研究所(朱邦勇)
10.3760/cma.j.issn.0412-4030.2015.05.004
国家自然科学基金青年科学基金(81101294);协和青年基金暨中央高校基本科研业务费专项资金(3332013143)
尹跃平,Email:yinyp@ncstdlc.org
2014-03-04)
(本文编辑:尚淑贤)
