你好!陌生方程式
2015-11-04杨国明
杨国明


我们所谓的“陌生反应”主要包括有陌生物质参加的化学反应和熟悉物质发生的陌生反应两种。综观近几年全国各地高考试题发现,要求直接书写教材中的反应方程式或离子方程式的考题越来越少,而要求书写教材中未曾出现过的陌生反应方程式或离子方程式的试题越来越多。因此,熟练掌握陌生反应方程式或离子方程式的书写方法与技巧是取得优异化学成绩的重要保证。
一、老朋友,新变化
——熟悉物质发生的陌生反应
由于反应物是我们熟悉的物质,对反应物的组成、结构和性质比较清楚,因此,可以根据反应物的相关性质和信息,分析出主要的反应物和生成物,再由质量守恒、电荷守恒等来分析、配平反应方程式。
例1(全国高考题,有删减):实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后得KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是: 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)KMnO4能与热的、经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 。
解析:上述反应中涉及的反应物和生成物都是教材中出现过的熟悉的物质,但发生的反应却是陌生的。根据题目提供的部分反应物和生成物,运用氧化还原反应规律和各种守恒关系不难书写出正确的反应方程式。
(1)题目明确告诉了该反应的反应物为MnO2、KOH和KClO3;生成物有K2MnO4和KCl。这是一个氧化还原反应,KClO3是氧化剂,还原产物为KCl,MnO2是还原剂,氧化产物为K2MnO4。由此可以得到如下关系:KClO3 + MnO2 +KOH→K2MnO4 + KCl。
由电子守恒和部分元素质量守恒得到如下关系:KClO3 + 3MnO2 +6KOH→3K2MnO4 + KCl。
再根据元素质量守恒,产物中一定还有H2O,故反应方程式如下:KClO3 + 3MnO2 + 6KOH 3K2MnO4 + KCl + 3H2O。
(2)K2MnO4转化生成KMnO4,锰元素的化合价升高了,必然还有一种元素的化合价降低。钾元素的化合价不可能降低,氧元素的已经处于最低价也不可能降低,因此必然有一部分锰元素的化合价降低。由于氧化产物KMnO4溶于水,故还原产物一定为不溶于水的MnO2。由电子守恒可得如下关系:3MnO42-→2MnO4-+ MnO2↓。
由于反应是在酸性条件下进行的,由质量守恒和电荷守恒,可以用H+和H2O来配平整个离子方程式:3MnO42-+ 4H+ = 2MnO4-+ MnO2↓+ 2H2O。
(3)氧化剂为KMnO4,还原产物为MnSO4;还原剂为Na2C2O4,氧化产物为CO2;同时反应物中还有H2SO4。由电子守恒可得如下关系:2KMnO4 + 5Na2C2O4+ H2SO4→2MnSO4 + 10CO2↑。
根据元素质量守恒,产物中一定还有K2SO4、Na2SO4和H2O,反应方程式为:2KMnO4 + 5Na2C2O4 + 8H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 10CO2↑+ 8H2O 。
例2(天津高考题):A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
请回答下列问题:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
A→D: ;D→E: 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
解析:此题中物质的推断并不难,难在(2)(3)两问中三个熟悉物质发生的陌生反应的离子方程式的书写。
(1)由题目易知A为NaI,C为AgI。黄绿色气体F为Cl2,F与NaOH溶液反应生成钠盐B,根据B溶液呈碱性并具有氧化性,可知B为NaClO。NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,进一步反应生成NaIO3,其中I为+5价;Cl2氧化FeCl2生成FeCl3,FeCl3又能氧化SO2生成SO42-。
(2)A→D:氧化剂为ClO-,还原产物为Cl-;还原剂为I-,氧化产物为I2,并由电子守恒配平化合价发生变化的元素Cl、I,可得到如下式子:ClO-+2I-→Cl-+I2。此时反应物中含Cl、I、O三种元素,带三个单位负电荷;生成物中只含Cl、I两种元素,只带一个单位的负电荷。要配平该离子方程式,要么在生成物中加含有氧元素、带负电荷的微粒,要么在反应物中加能与氧元素结合的阳离子。综合考虑质量守恒和电荷守恒,可以得到如下两个配平的离子方程式:①ClO-+2I-+H2O=Cl-+I2+2OH-;②ClO-+2I-+2H+=Cl-+I2+H2O。该反应是A、B溶液之间的反应,并没有外加酸,所以反应物中不能出现H+,但这并不是说反应不能生成酸或碱,故正确答案为①。
D→E:氧化剂为ClO-,还原产物为Cl-;还原剂为I2,氧化产物为IO3-,并由电子守恒配平化合价发生变化的元素Cl、I,可得到如下式子:5ClO-+I2→5Cl-+2IO3-。因前一步反应后的溶液呈碱性,由质量守恒和电荷守恒,用H2O和OH-来完成并配平整个离子方程式:5ClO-+
I2+2OH-=5Cl-+2IO3-+H2O。
(3)氧化剂为Fe3+,还原产物为Fe2+;还原剂为SO2,氧化产物为SO42-,由电子守恒配平化合价发生变化的元素Fe、S,可得到如下式子:2Fe3++SO2→2Fe2++SO42-。此时反应物中氧原子数少于生成物中氧原子数;反应物所带正电荷数多于生成物所带正电荷数。综合考虑质量守恒和电荷守恒,用H2O和H+来完成并配平整个离子方程式:2Fe3++SO2+2H2O===2Fe2++SO42-+4H+。
书写技巧
(1)在书写反应物中没有酸或碱的陌生方程式或离子方程式时,不要在反应物中出现酸(H+)或碱(OH-)。但根据质量守恒、电荷守恒的需要,可以在生成物中出现酸(H+)或碱(OH-)等。如例2中的(2)(3)。
(2)在酸性条件下的离子方程式,最后可以用H2O和H+来完成、配平整个离子反应方程;在碱性条件下的离子方程式,最后可以用H2O和OH-来完成、配平整个离子反应方程。如例1中的(2),例2中的(2)。
(3)对于陌生的氧化还原反应方程式或离子方程式的书写,先找出氧化剂、还原产物和还原剂、氧化产物,并将化合价发生变化的元素先配相等将有利于方程式的快速书写。
二、新面孔,老套路
——陌生物质参加的化学反应
有陌生物质参加的陌生方程式的书写,可有两种书写方法:一是根据题目的相关信息,确定陌生物质的组成与结构,从而确定主要的反应物和生成物,再由质量守恒和电荷守恒等完成、配平整个方程式;二是如果陌生反应物的组成与结构一时难以确定,可以先将其他反应物和生成物写出来,再由元素守恒和质量守恒等分析出未知物质,进而完成、配平整个方程式。
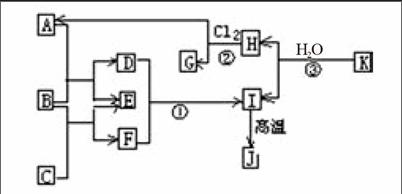
例3(江苏高考题,有删减):图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请写出反应③的化学方程式为: 。
解析:根据题给信息可推知:H为CH4,I为Al(OH)3。
K是由两种常见元素组成的化合物且K与H2O反应生成CH4和Al(OH)3,则K由Al、C两种元素组成,由化合价规则可得K的化学式为Al4C3。联想Mg3N2、CaC2与H2O的反应:Mg3N2+3H2O=3Mg(OH)2+2NH3↑、CaC2+2H2O=
Ca(OH)2+C2H2↑,可以写出反应③的化学方程式为:
Al4C3 + 12H2O=4Al(OH)3+3CH4↑。
例4(由高考题整合):(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,该电池总反应的离子方程式为 。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是 ,该化合物水解的化学方程式为 。
解析:(1)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,在该反应中,Fe3+为还原剂,FeO42-为氧化产物;ClO-为氧化剂,Cl-为还原产物。并由电子守恒配平化合价发生变化的元素Fe、Cl,可得到如下式子:2Fe3++3ClO-→2FeO42-+3Cl-。
反应在碱性条件下进行,用H2O和OH-调配,由质量守恒、电荷守恒得到该反应的离子方程式:2Fe3++
3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
(2)该电池反应中,氧化剂为FeO42-,还原产物为Fe(OH)3;还原剂为Zn,氧化产物为Zn(OH)2。由电子守恒配平化合价发生变化的元素Fe、Zn,可得到如下式子:2FeO42-+3Zn→2Fe(OH)3+ 3Zn(OH)2。
反应在碱性条件下进行,用H2O和OH-调配,得到该电池总反应的离子方程式为:2FeO42-+3Zn +8H2O=
2Fe(OH)3+ 3Zn(OH)2+4OH-。
(3)镁没有可变化合价,就是+2价。Mg(CH3)Cl 可以改写为Mg(CH3)2·MgCl2,MgCl2的水解程度很小,但Mg(CH3)2类似于Mg3N2,联想到Mg3N2
的水解反应:Mg3N2+3H2O=3Mg(OH)2+2NH3↑,可以推断Mg(CH3)2也能完全水解生成Mg(OH)2与CH4。即有:Mg(CH3)2·MgCl2+2H2O= Mg(OH)2+
MgCl2 +2CH4↑。于是可得Mg(CH3)Cl水解的方程式为:Mg(CH3)Cl+H2O=Mg(OH)Cl+CH4↑或
Mg(CH3)2·MgCl2+2H2O=Mg(OH)2+MgCl2 +
2CH4↑。
书写技巧
(1)当一个反应中有一种陌生物质时,其他反应物或生成物一般都应是熟悉的物质。因此,可以先将熟悉的反应物和生成物写出来,再由元素守恒与质量守恒等推导出陌生物质的组成,从而写出完整的化学方程式或离子方程式。
(2)当陌生物质的组成已经确定时,可以根据类似已知物质的反应,采用类比、迁移的方法,分析出陌生物质与某种物质发生反应的产物,从而写出完整的化学方程式或离子方程式。
无论是熟悉方程式还是陌生方程式的书写,都是建立在元素化合物知识之上的。因此,只有熟练掌握元素化合物知识,运用化学反应的规律,采用类比、迁移等分析方法,才能快速、准确地书写各种化学反应方程式或离子方程式。
