基于代谢工程策略合成L-苹果酸研究进展
2015-10-28崔文璟刘中美周哲敏
周 丽,崔文璟,刘中美,周哲敏
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡214122)
基于代谢工程策略合成L-苹果酸研究进展
周丽,崔文璟,刘中美,周哲敏*
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡214122)
L-苹果酸在食品、医药、化工等领域被广泛应用。工业上以石油基原料为底物,通过化学法或酶法合成L-苹果酸。随着石油资源的日渐短缺,利用可再生资源以生物法合成L-苹果酸受到人们的重视。近年来应用代谢工程策略改造大肠杆菌、酵母菌等菌株,进行L-苹果酸的合成,具有一定应用前景。同时,应用合成代谢工程在体外构建代谢途径进行L-苹果酸合成,具有较高的理论价值。本文首先总结了L-苹果酸合成的代谢途径;其次对L-苹果酸合成的代谢工程策略进行了综述,包括强化L-苹果酸合成代谢途径、删除副产物合成途径、促进还原力再生,以期较为系统地阐述L-苹果酸代谢机制的研究现状;最后对L-苹果酸代谢工程的研究方向进行了展望。
L-苹果酸,代谢工程,微生物发酵,还原力再生
L-苹果酸是一种重要的四碳平台化合物,已被美国能源部列为基础化合物之一。其应用领域涉及食品、医药、化工等行业[1-2]。在食品领域,L-苹果酸已成为继柠檬酸、乳酸之后,用量排第三位的食品酸味剂,同时L-苹果酸还可用于食品保鲜和除臭[3]。在医药行业中,L-苹果酸直接参与人体新陈代谢,具有抗疲劳、保护肝、肾、心脏的作用以及降低抗癌药物的毒副作用等[3-4]。在化工领域,L-苹果酸被用于日用化妆品的生产[3],金属的清洗和修整,织物整理,化学镀层等[5]。此外,L-苹果酸也可用于生产聚酯树脂和醇酸树脂等特殊的可降解塑料[6],这将极大促进其需求量。
化学合成法将马来酸或富马酸水合,可合成消旋型DL-苹果酸[7],而一些国家规定饮料和药品中不能使用DL-苹果酸,必须使用L-苹果酸,限制了消旋型苹果酸的应用范围。利用含有富马酸酶的固定化细胞或者固定化富马酸酶,可合成光学纯度的L-苹果酸[1,7-8],然而其底物富马酸来源于马来酸,是石油基化学品[9]。随着石油资源的日渐枯竭,利用可再生资源,通过微生物发酵法合成L-苹果酸受到人们的关注[5]。
传统发酵利用黄曲霉菌株发酵合成L-苹果酸[10]。然而,该菌株发酵周期长,产生黄曲霉毒素,并产生高浓度杂酸导致产品分离纯化困难,限制了其工业应用[10-11]。而L-苹果酸作为TCA循环的中间代谢产物,在其他微生物中很少积累。因此,对多条代谢途径进行改造以致L-苹果酸代谢溢出是利用安全菌株进行L-苹果酸发酵合成的必然选择。代谢工程是利用重组DNA技术,有目的地操纵细胞的酶、转运和调控功能,从而改善细胞的活性[12-13],从上世纪90年代初期发展至今,涌现出了大量新的理论和技术,对微生物发酵工业的发展起到了极大的推动作用[14]。近年来应用代谢工程策略,对大肠杆菌[15-18]、酵母菌[19-20]以及枯草芽孢杆菌[21]等微生物代谢途径进行改造,高水平合成L-苹果酸也成为研究热点。同时,应用合成代谢工程在体外构建代谢途径进行L-苹果酸合成,具有一定的理论价值。本文对代谢工程方式进行L-苹果酸合成的相关研究进行综述(表1),以期较为系统地阐述L-苹果酸代谢机制的研究现状。
1 L-苹果酸合成代谢途径
微生物可利用葡萄糖底物,经糖酵解途径和三羧酸循环(TCA)合成L-苹果酸(图1)。这一过程中,L-苹果酸积累的方式可总结为五种[20](图2):(A)丙酮酸或磷酸烯醇式丙酮酸羧化为草酰乙酸(OAA),草酰乙酸再经苹果酸脱氢酶(MDH,EC 1.1.1.37,可逆催化草酰乙酸和苹果酸之间的氧化还原反应)还原为L-苹果酸,葡萄糖经这一途径每合成1分子L-苹果酸需固定1分子CO2,其最大理论得率为2mol苹果酸/mol葡萄糖;(B)第二种是由草酰乙酸和乙酰辅酶A生成柠檬酸,再经TCA循环氧化为L-苹果酸,如果乙酰辅酶A经丙酮酸脱氢酶产生,且草酰乙酸经丙酮酸羧化酶形成,则经该途径1分子葡萄糖合成L-苹果酸需释放2分子CO2,其最大理论转化率仅为1mol苹果酸/mol葡萄糖;(C)另一L-苹果酸合成的氧化途径是利用加入乙醛酸循环的2分子乙酰辅酶A合成L-苹果酸,其最大理论转化率为1mol苹果酸/mol葡萄糖;(D)第四种途径是非循环型的,丙酮酸羧化为草酰乙酸,再经乙醛酸循环形成L-苹果酸,其最大理论转化率为1.33mol苹果酸/mol葡萄糖;(E)经苹果酸酶催化丙酮酸合成L-苹果酸(EC 1.1.1.38-40,本文暂将该酶称为苹果酸酶,以区别于催化草酰乙酸底物的苹果酸脱氢酶),其最大理论转化率为2mol苹果酸/mol葡萄糖。
经图2中B、C、D方式积累L-苹果酸的代谢途径长,涉及的中间产物较多,导致L-苹果酸积累效率低。苹果酸脱氢酶具有较高的催化效率,可将进入TCA循环的草酰乙酸一步转化为L-苹果酸(图2A),目前多数研究利用这一途径来发酵合成L-苹果酸,并获得了较高的产量。此外,苹果酸酶可将糖酵解途径产物丙酮酸一步转化为L-苹果酸(图2E),代谢途径更为简洁,然而自然界中存在的苹果酸酶催化合成L-苹果酸方向反应的效率低,目前仅有结合还原力再生过程利用该酶在体外合成L-苹果酸的报道[22-24]。

图1 微生物经葡萄糖合成L-苹果酸的主要代谢途径Fig.1 Key enzymatic reactions for L-malate production in microorganisms using glucose as carbon source
注:基因及相应酶:ptsG,葡萄糖磷酸转移酶;ppc,磷酸烯醇式丙酮酸羧化酶;pck,磷酸烯醇式丙酮酸羧基酶;pyc,丙酮酸羧化酶(L.lactis);maeA,NAD-依赖型苹果酸酶;maeB,NADP-依赖型苹果酸酶;mdh,苹果酸脱氢酶;aceA,异柠檬酸裂解酶;aceB,苹果酸合酶A;fumABCD,延胡索酸水合酶;frdABCD,延胡索酸还原酶;pps,磷酸烯醇式丙酮酸合酶;pfl,丙酮酸甲酸裂解酶;pdh,丙酮酸脱氢酶;ldhA,发酵型D-乳酸脱氢酶;poxB,丙酮酸氧化酶;acs,乙酰辅酶A合成酶;pta,磷酸转乙酰酶;ackA,乙酸激酶;adhE,乙醇脱氢酶。
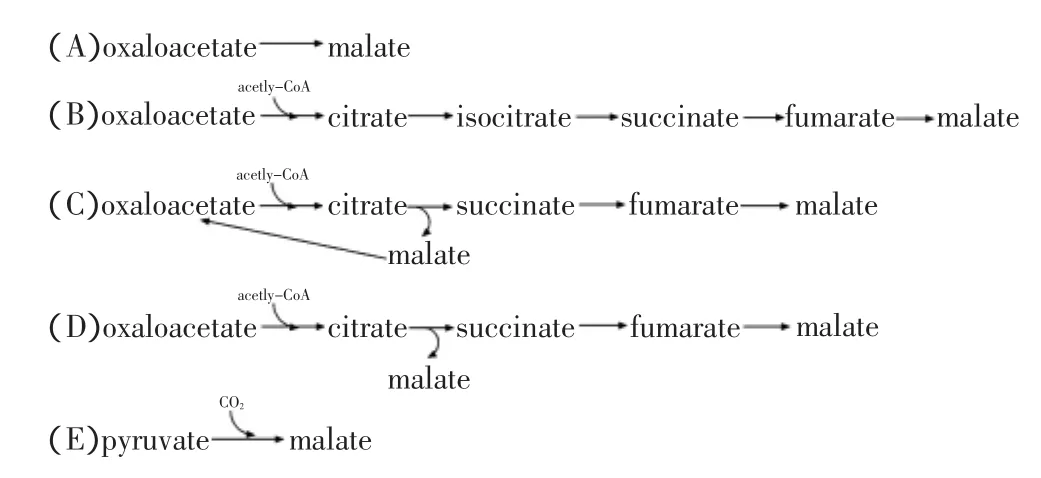
图2 几种潜在的L-苹果酸合成代谢途径的总结[20]Fig.2 Summary of several possible pathways for L-malate synthesis
2 强化L-苹果酸合成代谢途径
2.1强化前体草酰乙酸的合成途径
糖酵解途径产生的三碳化合物固定CO2羧化为草酰乙酸,是L-苹果酸合成过程的瓶颈步骤。这一过程可由磷酸烯醇式丙酮酸羧化酶(PPC)、磷酸烯醇式丙酮酸羧激酶(PCK)或丙酮酸羧化酶(PYC)催化(图1)。
代谢流分析表明增加PPC途径流量可促进L-苹果酸的合成[15]。由于PPC途径不积累ATP,导致磷酸烯醇式丙酮酸高能磷酸键的浪费,而PCK在羧化合成草酰乙酸的同时积累ATP,PCK途径的强化对于L-苹果酸合成代谢过程更有利。然而,PCK同时可催化逆向反应,Escherichia coli自身PCK主要催化草酰乙酸为底物形成磷酸烯醇式丙酮酸方向的反应。Moon等[15]在删除pta基因的E.coli中表达了来源于Mannheimia succiniciproducens的PCK酶,该酶主要催化形成草酰乙酸方向的反应,使得L-苹果酸合成量提高到9.25g/L(出发菌株发酵液中不能检测到L-苹果酸)。应用PYC酶同样可提高苹果酸下游产物琥珀酸的合成水平[25],但未见应用该酶提高苹果酸产量的报道。
2.2强化苹果酸脱氢酶途径
成酸苹果酸脱氢酶催化草酰乙酸合成L-苹果酸,是苹果酸合成途径的关键酶,近年来研究者们尝试对其进行高效表达,促进了L-苹果酸的合成。
Pines等[19,26]发现了存在于酿酒酵母(Saccharomyces cerevisiae)胞质中的苹果酸脱氢酶。通过高效表达该酶,可将细胞质中糖酵解途径和丙酮酸羧化酶产生的草酰乙酸直接转化为L-苹果酸,不需进入线粒体来合成L-苹果酸。与出发菌株相比,L-苹果酸积累量提高了3.7倍,达到11.8g/L。
吴亚斌等[18]在敲除了副产物合成代谢途径的E.coli菌株中,克隆表达了黄曲霉来源的苹果酸脱氢酶基因,并优化了基因拷贝数。表明与用高拷贝质粒相比,较低的苹果酸脱氢酶基因拷贝量可更有效促进L-苹果酸的积累,将该基因整合于重组大肠杆菌的染色体上,L-苹果酸的转化率提高了15.7%,达到60.3%,产量达到14g/L,生产强度达到0.47g/(L·h)。
近年来,研究者还发现了其他来源的苹果酸脱氢酶,并对其进行了深入研究。例如,从Streptomyces coelicolor A3(2)和Streptomyces avermitilis来源的苹果酸脱氢酶,可高效、高专一性地催化NAD+为辅酶的草酰乙酸还原反应,其逆向反应速率低,且该酶热稳定性好[27-28]。这也为强化L-苹果酸合成代谢途径提供了可能。
2.3同时强化草酰乙酸前体的合成途径和苹果酸脱氢酶途径
由于Bacillus subtilis中分解苹果酸的富马酸酶(fumC编码),在厌氧条件下活性远低于好氧条件,且该菌株溶剂耐受性强,因此B.subtilis是较有潜力的L-苹果酸生产菌株。首先对其改造,进行L-苹果酸合成的是Mu等研究者[21]。他们在B.subtilis中同时表达了来源于E.coli的磷酸烯醇丙酮酸羧化酶(PPC)和来源于S.cerevisiae的苹果酸脱氢酶(MDH),使L-苹果酸积累量提高为6.04mmol/L(野生型菌株不能积累L-苹果酸)。进一步在乳酸合成途径敲除的重组B. subtilis中表达这两个酶,L-苹果酸的积累量提高为9.18mmol/L,经微好氧-厌氧两阶段发酵,产量可达15.65mmol/L。
Zelle等[20]以耐糖S.cerevisiae为出发菌株,过量表达自身丙酮酸羧化酶(PYC),并通过敲除C端的过氧化物酶体定位序列来高水平表达胞质苹果酸脱氢酶(MDH3),使得L-苹果酸合成水平显著提高。进一步过量表达Schizosaccharomyces pombe来源的苹果酸运转蛋白(SpMAE1),结果L-苹果酸的产量大幅度提高至59g/L,其转化率达到0.42mol苹果酸/mol葡萄糖。经发酵罐优化后,L-苹果酸转化率提高至0.48mol苹果酸/mol葡萄糖[29],是目前以重组S.cerevisiae菌株合成L-苹果酸的最高产量。Chen等[30]应用相同的策略,表达Rhizopus oryzae来源的RoMDH、RoPYC以及SpMAE1,可将酵母菌株Torulopsis glabrata L-苹果酸的合成量提高为8.5g/L。
3 删除副产物合成代谢途径
大肠杆菌遗传背景清晰,是进行代谢途径研究的重要菌株。在厌氧条件下(尤其是在基本培养基中),E.coli发酵碳源合成还原型产物,以达到氧化还原平衡,乳酸、乙酸、琥珀酸、甲酸、乙醇是其主要代谢产物[31]。野生型E.coli发酵液中通常不积累L-苹果酸,因此构建L-苹果酸合成重组菌株,需将这些副产物合成途径删除,将代谢流引向L-苹果酸的合成。
Ingram课题组对E.coli代谢途径进行了系统、深入的研究,构建了利用草酰乙酸还原反应途径来高效合成L-苹果酸的重组E.coli。首先在构建琥珀酸合成重组E.coli时,他们发现了可积累高水平的L-苹果酸的菌株[17]。在野生型E.coli C菌株中,敲除副产物乳酸(ldhA、mgsA)、乙酸(ackA)、甲酸(pflB、focA)、乙醇(adhE)的合成或运输有关途径的编码基因,并经代谢进化(连续传代培养,筛选生长速度快、产物合成量提高的菌株),所获得的菌株KJ073利用100g/L葡萄糖,积累280mmol/L琥珀酸以及少量的丙酮酸和乙酸副产物,同时可积累高达516mmol/L L-苹果酸,是极有潜力的L-苹果酸代谢工程出发菌株。进一步对琥珀酸等副产物代谢途径进行敲除,构建专一性合成L-苹果酸重组菌株[16]。在琥珀酸合成重组E.coli KJ073(KJ071 ΔpoxB)菌株中,考察单一代谢途径敲除对L-苹果酸和副产物琥珀酸积累量的影响。结果表明,删除富马酸合成途径(fumB和fumAC)或琥珀酸合成途径(frdBC),都导致L-苹果酸显著积累(相同条件下,出发菌株不能积累L-苹果酸),同时琥珀酸合成水平降低90%及以上。而天冬氨酸代谢相关途径(aspA、aspC)和乙醛酸循环关键途径(aceA)的删除对L-苹果酸的积累无显著影响。在XZ316菌株(KJ073 ΔfrdBC)基础上,叠加敲除副产物合成代谢途径。结果表明,删除苹果酸酶编码基因sfcA(即maeA),L-苹果酸合成量提高为70mmol/L,细胞得率也提高了20%。进一步敲除maeB基因,导致L-苹果酸积累量下降为40mmol/L,而L-苹果酸对葡萄糖的转化率有所增加,副产物丙酮酸的合成量几乎被去除。在此基础上,再敲除fumB和fumAC基因,最终获得XZ658菌株,使得L-苹果酸积累量提高了4倍。然而,XZ658菌株乳酸的积累量显著增加,进一步期望通过删除pykA和pykB基因来减少乳酸前体物质丙酮酸的供应量,然而相应重组菌株在乳酸积累量降低的同时,L-苹果酸积累量也显著降低。对XZ658菌株发酵条件进行优化,经好氧-厌氧两阶段发酵(添加碳酸氢盐来提供CO2),可合成253mmol/L L-苹果酸,其转化率为1.42mol苹果酸/mol葡萄糖,厌氧阶段L-苹果酸合成速率达到0.47g/L·h,仅合成极低浓度的乳酸,该结果是目前用重组大肠杆菌进行L-苹果酸合成报道中最高产量。他们的研究表明,在该菌株中固定CO2的关键途径是磷酸烯醇式丙酮酸羧激酶PCK[32],这也为后人研究提供了借鉴。
此外,fumA基因编码的富马酸酶,主要负责有氧条件下TCA循环的运行[33],该基因的删除导致E.coli重组菌株好氧生长受到严重影响,最终导致发酵周期显著延长。而仅对该途径中FUMB(厌氧条件下转化苹果酸为富马酸)和FUMC(有氧、厌氧下都可作用,在胁迫环境下可代替FUMA)途径进行敲除,可以避免对菌体生长的显著影响,有利于缩短发酵周期[18]。这一结论也是对E.coli代谢工程合成L-苹果酸的有益补充。

表1 L-苹果酸生产性能的比较Table 1 Comparison of L-malate production properties
在S.cerevisiae中,Oba等[34]发现,硫胺素——丙酮酸消耗途径PYC和丙酮酸脱氢酶(PDH)的辅酶,其合成途径(如THI4和SNZ2)基因表达下调使得L-苹果酸积累量增加。Nakayama等[35]也发现,呼吸缺陷型S.cerevisiae菌株,其L-苹果酸合成量是野生型菌株的2.5倍。进一步通过紫外诱变,筛选抗呼吸抑制剂2,4-二硝基酚(DNP)的S.cerevisiae,获得了L-苹果酸积累量提高的突变株,其线粒体活性低,增大了糖酵解途径(存在于细胞质中)产生的丙酮酸在胞质中转化为L-苹果酸的可能性,同时增加了胞内NADH/NAD+的比例,可能导致L-苹果酸积累量提高[36],也为后续L-苹果酸代谢工程酵母菌株的构建提供了借鉴。
4 还原力再生策略
副产物代谢途径的删除导致丙酮酸积累,且糖酵解途径产生的还原型辅酶积累。以NAD(P)+为辅酶的苹果酸酶可催化丙酮酸羧化合成L-苹果酸:丙酮酸+NAD(P)H+CO2→苹果酸+NAD(P)+,是最简洁的L-苹果酸合成途径。然而,从热动力学角度看该反应过程难以进行(ΔGo’=+7.3kJ/mol)[37],已发现的苹果酸酶都催化苹果酸与丙酮酸之间的可逆反应,其主要产物是丙酮酸。
Yoko等[22]在苹果酸酶(Pseudomonase diminuta IFO 13182来源)反应体系中添加了葡萄糖-6磷酸脱氢酶(Leuconostoc mesenteroides来源),该酶氧化葡萄糖-6磷酸产生葡萄糖-6磷酸内酯和NADH,可实现辅酶的再生,在体外构建的耦合反应途径可将丙酮酸底物转化生成38mmol/L L-苹果酸,其摩尔转化率可达38%。进一步通过电化学的方式进行NADH的再生,同样可实现L-苹果酸酶(来源于Brevundimonas diminuta)羧化丙酮酸合成L-苹果酸[23]。表明通过促进NAD(P)H的形成,可推动反应向L-苹果酸合成方向进行。
Ye等[24]克隆表达了由葡萄糖合成L-苹果酸代谢途径中的各种酶,在体外进行L-苹果酸的人工合成(synthetic metabolic engineering)。克隆了来源于Thermococcus kodakarensis菌株的苹果酸酶(TkME)基因,该酶以NADP+为辅酶,可逆催化丙酮酸和L-苹果酸之间反应的羧化酶。为了降低这一逆向反应,他们耦合了一个热稳定的糖酵解途径,使整个途径ATP及还原力NADP+的消耗和再生相平衡,将整个反应引向L-苹果酸的合成(glucose+2HCO3-+2H→2malate+ 2H2O)。由于TkME还具有催化丙酮酸还原合成副产物乳酸的活性,通过提高HCO3-的浓度,可加强羧化反应,专一性合成L-苹果酸,最终葡萄糖合成L-苹果酸的摩尔得率可达到60%,最高可合成2.6mmol/L L-苹果酸。这种体外合成的方法避免了转录和翻译调控过程,可方便地通过改变酶的添加量来优化反应过程,去除了菌体生长和副产物合成过程,节约了碳源,可获得更纯产物,同时也为改造微生物体内代谢途径进行L-苹果酸合成提供了依据。然而,该方法尚存在产物合成量低、酶易热失活、成本较高等问题,暂时不适用于L-苹果酸的大规模生产。
Stols等[38]发现,在重组E.coli(Δpfl,ΔldhA)中,高效表达以NAD+为辅酶的苹果酸酶(maeA),可提高苹果酸下游产物琥珀酸的积累量。Kwon等[39]在E.coli K12菌株中,过量表达以NADP+为辅酶的苹果酸酶(maeB),也可提高C4代谢产物尤其是琥珀酸的合成水平。因此,在还原型辅酶高度积累且苹果酸分解代谢途径受阻的重组菌株中,高效表达苹果酸酶也有可能提高体内L-苹果酸的积累量,而目前尚未见有关报道。
5 展望
目前,代谢工程重组菌株的L-苹果酸产量仍显著低于传统黄曲霉发酵(113g/L[40-41]),同时也明显低于乳酸、琥珀酸等其他代谢工程有机酸的产量。因此,利用代谢工程策略进行L-苹果酸合成还有很大的研究空间和提升空间。可从以下几个方面开展:
5.1L-苹果酸合成代谢途径的强化
糖酵解途径产生的C3中间产物需固定1分子CO2,形成C4代谢产物,而研究表明这一过程通常效率较低,是苹果酸积累的关键步骤。此外,苹果酸脱氢酶和苹果酸酶催化的反应都可逆向进行,催化效率低。更高效的羧化途径和L-苹果酸合成途径的发现,将促进L-苹果酸产量的提高。
5.2分解代谢途径的调控
代谢途径中间代谢产物往往涉及多条分解代谢途径,将这些代谢途径完全切断(堵),会导致细胞生理缺陷甚至死亡。L-苹果酸正是这样一种TCA循环中间产物,利用组学分析技术对L-苹果酸代谢途径和调控机理进行更深入的解析,从而精简这些分解代谢途径,或利用基因开关[42-44]对关键代谢途径进行调控,将有助于L-苹果酸产量的提高和发酵工艺的改善。
5.3还原力再生途径的强化
目前,通过增强还原型辅酶的供给量来促进L-苹果酸的合成仅有在体外研究的报道。在微生物体内应用这一策略,也有望促进L-苹果酸的积累。
[1]Bressler E,Pines O,Goldberg I,et al.Conversion of fumaric acid to L-malic by sol-gel immobilized Saccharomyces cerevisiae in a supported liquid membrane bioreactor[J].Biotechnol Prog,2002,18:445-450.
[2]Rosenberg M,Mikova H,Krištofikova L.Formation of L-malic acid by yeasts of the genus Dipodascus[J].Lett Appl Microbiol,1999,29:221-223.
[3]汪多仁,陈体庆.L-苹果酸的开发与应用[J].饮料工业,2004,7:21-26.
[4]吴军林,吴清平,张菊梅.L-苹果酸的生理功能研究进展[J].食品科学,2008,29:692-695.
[5]Goldberg I,Rokem J S,Pines O.Organic acids:old metabolites,new themes[J].J Chem Technol Biotechnol,2006,81:1601-1611.
[6]聂毅.生物法苹果酸的合成与应用[J].辽宁化工,2000,29:231-233.
[7]刘建军,姜鲁燕,赵祥颖,等.L-苹果酸的应用及研究进展[J].中国食品添加剂,2003,3:53-56.
[8]Presecˇki A V,Vasic'-Racˇki D.Production of L-malic acid by permeabilized cells of commercial Saccharomyces sp.strains[J]. Biotechnol Lett,2005,27:1835-1839.
[9]Engel C A R,Straathof A J,Zijlmans T W,et al.Fumaric acid production by fermentation[J].Appl Microbiol Biotechnol,2008,78:379-389.
[10]Battat E,Peleg Y,Bercovitz A,et al.Optimization of L-malic acid production by Aspergillus flavus in a stirred fermentor[J]. Biotechnol Bioeng,1991,37:1108-1116.
[11]Geiser D M,Pitt J I,Taylor J W.Cryptic speciation and recombination in the aflatoxin-producing fungus Aspergillus flavus[J].Proc Natl Acad Sci U S A,1998,95:388-393.
[12]Bailey JE.Toward a science of metabolic engineering[J]. Science,1991,252:1668-1675.
[13]Stephanopoulos G,Vallino JJ.Network rigidity and metabolic engineering in metabolite overproduction[J].Science,1991,252:1675-1681.
[14]张学礼.代谢工程发展20年[J].生物工程学报,2009,25:1285-1295.
[15]Moon S Y,Hong S H,Kim T Y,et al.Metabolic engineering of Escherichia coli for the production of malic acid[J].Biochem Eng J,2008,40:312-320.
[16]Zhang X,Wang X,Shanmugam K,et al.L-Malate production by metabolically engineered Escherichia coli[J].Appl Environ Microbiol,2011,77:427-434.
[17]Jantama K,Haupt M,Svoronos S A,et al.Combining metabolicengineeringandmetabolicevolutiontodevelop nonrecombinant strains of Escherichia coli C that produce succinate and malate[J].Biotechnol Bioeng,2008,99:1140-1153.
[18]吴亚斌,张梁,石贵阳.产L-苹果酸重组大肠杆菌的构建[J].生物加工过程,2014,12:12-18.
[19]Pines O,Shemesh S,Battat E,et al.Overexpression of cytosolic malate dehydrogenase(MDH2)causes overproduction of specific organic acids in Saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,1997,48:248-255.
[20]Zelle R M,de Hulster E,van Winden W A,et al.Malic acid production by Saccharomyces cerevisiae:engineering of pyruvate carboxylation,oxaloacetate reduction,and malate export[J].Appl Environ Microbiol,2008,74:2766-2777.
[21]Mu L,Wen J.Engineered Bacillus subtilis 168 produces L-malate by heterologous biosynthesis pathway construction and lactate dehydrogenase deletion[J].World J Microbiol Biotechnol,2013,29:33-41.
[22]Ohno Y,Nakamori T,Z heng H,et al.Reverse reaction of malic enzyme for HCO3-fixation into pyruvic acid to synthesize L-malic acid with enzymatic coenzyme regeneration[J].Biosci Biotechnol Biochem,2008,72:1278-1282.
[23]Zheng H,Ohno Y,Nakamori T,et al.Production of L-malic acid with fixation of HCO3-by malic enzyme-catalyzed reaction based on regeneration of coenzyme on electrode modified by layer-by-layer self-assembly method[J].J Biosci Bioeng,2009,107:16-20.
[24]Ye X,Honda K,Morimoto Y,et al.Direct conversion of glucose to malate by synthetic metabolic engineering[J].J Biotechnol,2013,164:34-40.
[25]Blankschien MD,Clomburg JM,Gonzalez R.Metabolic engineering of Escherichia coli for the production of succinate from glycerol[J].Metab Eng,2010,12:409-419.
[26]Pines O,Even-Ram S,Elnathan N,et al.The cytosolic pathway of L-malic acid synthesis in Saccharomyces cerevisiae:the role of fumarase[J].Appl Microbiol Biotechnol,1996,46:393-399.
[27]Wang Z D,Wang B J,Ge Y D,et al.Expression and identification of a thermostable malate dehydrogenase from multicellular prokaryote Streptomyces avermitilis MA-4680[J]. Mol Biol Rep,2011,38:1629-1636.
[28]Ge Y D,Cao Z Y,Wang Z D,et al.Identification and biochemicalcharacterizationofathermostablemalate dehydrogenase from the mesophile Streptomyces coelicolor A3(2)[J].Biosci Biotechnol Biochem,2010,74:2194-2201.
[29]Zelle R M,De Hulster E,Kloezen W,et al.Key process conditions for production of C4 dicarboxylic acids in bioreactor batch cultures of an engineered Saccharomyces cerevisiae strain[J].Appl Environ Microbiol,2010,76:744-750.
[30]Chen X,Xu G,Xu N,et al.Metabolic engineering of Torulopsis glabrata for malate production[J].Metab Eng,2013,19:10-16.
[31]Zhou L,Zuo Z R,Chen X Z,et al.Evaluation of genetic manipulation strategies on D-lactate production by Escherichia coli[J].Curr Microbiol,2011,62:981-989.
[32]Zhang X,Jantama K,Moore J C,et al.Metabolic evolution of energy-conserving pathways for succinate production in Escherichia coli[J].Proc Natl Acad Sci U S A,2009,106:20180-20185.
[33]Tseng C P,Yu C C,Lin H H,et al.Oxygen and growth rate dependent regulation of Escherichia coli fumarase(FumA,FumB,and FumC)activity[J].J Bacteriol,2001,183:461-467.
[34]Oba T,Suenaga H,Nakayama S,et al.Properties of a high malic acid-producing strains of Saccharomyces cerevisiae isolated from sake mash[J].Biosci Biotechnol Biochem,2011,75:2025-2029.
[35]Nakayama S,Tabata K,Oba T,et al.Characteristics of the highmalicacidproductionmechanisminSaccharomyces cerevisiae sake yeast strain No.28[J].J Biosci Bioeng,2012,114:281-285.
[36]Kosugi S,Kiyoshi K,Oba T,et al.Isolation of a high malic and low acetic acid-producing sake yeast Saccharomyces cerevisiae strain screened from respiratory inhibitor 2,4-dinitrophenol(DNP)-resistant strains[J].J Biosci Bioeng,2014,117:39-44.
[37]Goldberg R N,Tewari Y B,Bell D,et al.Thermodynamics of enzyme-catalyzed reactions:Part 1.Oxidoreductases[J].J Phys Chem Ref Data,1993,22:515-582.
[38]Stols L,Donnelly M I.Production of succinic acid through overexpression of NAD(+)-dependent malic enzyme in an Escherichia coli mutant[J].Appl Environ Microbiol,1997,63:2695-2701.
[39]Kwon Y D,Kwon O H,Lee H S,et al.The effect of NADP-dependentmalicenzymeexpressionandanaerobicC4 metabolism in Escherichia coli compared with other anaplerotic enzymes[J].J Appl Microbiol,2007,103:2340-2345.
[40]Zou X,Zhou Y,Yang S T.Production of polymalic acid and malic acid by Aureobasidium pullulans fermentation and acid hydrolysis[J].Biotechnol Bioeng,2013,110:2105-2113.
[41]Chang P K,Ehrlich K C.What does genetic diversity of Aspergillus flavus tell us about Aspergillus oryzae?[J].Int J Food Microbiol,2010,138:189-199.
[42]Zhou L,Niu D D,Tian K M,et al.Genetically switched D-lactate production in Escherichia coli[J].Metab Eng,2012,14:560-568.
[43]Gardner T S,Cantor C R,Collins J J.Construction of a genetic toggle switch in Escherichia coli[J].Nature,2000,403:339-342.
[44]Kobayashi H,Kærn M,Araki M,et al.Programmable cells:interfacing natural and engineered gene networks[J].Proc Natl Acad Sci U S A,2004,101:8414-8419.
进口食品的中文标签水很深 消费者购买前一定要看仔细
近年来,进口食品越来越受到消费者的热捧,看着美剧、喝着咖啡、抱着零食成为很多消费者休闲的常态。不过目前市面上涌现出许多无中文标签的所谓的“进口食品”,加之,消费者对“进口食品”的认识又知之甚少。对此,业内人士表示,没有中文标签的进口食品大多为不正规渠道来源,抑或是假冒伪劣产品,消费者在购买进口食品时,一定要看清外包装是否有中文标签,没有中文标签的要谨慎购买。
李女士近日在一家零食店内购买了一袋泰国零食,但食品包装袋上没有中文标签,“英文勉强能看懂,可包装上的泰文是什么意思呢?真的是花花绿绿的泰文,我也看不懂,生产日期、保质期,这些都没有中文说明。我当时买的时候只是看了货架上的中文标签,上面注明了产品名称和产地,当时并没有注意包装上有没有中文标签。”
无独有偶,还有一名消费者吴先生也购买了无中文标签的进口食品,“我是在网上买的这些饼干,当时只是简单看了看网页上对于这款饼干的介绍,但是没有认真仔细查看一下包装。所以在收到货物后,才发现原来饼干的外包装上一个中文字都没有,全都是韩文,想上网查都不知道怎么查。而且家里人也不敢吃了,一点儿中文都没有,吃着这种食物也挺不放心的。”吴先生说。
在杭州一些大型超市的进口食品专区,记者调查发现这些食品都贴有中文标签,标注有品名、产地、成分及在中国的总经销商的名称和地址等信息。记者询问了超市内的一名工作人员,工作人员称,“这些都是硬性规定,必须贴上中文标签才能卖。几乎没有人会来问我们有关进口食品的问题,因为中文标签上都写得很明白了,他们完全可以自行挑选。”
根据我国《预包装食品标签通则》的有关规定,进口食品必须贴上中文标签才能上架。如果食品没有任何中文标签,大多不是正规渠道来源,没有经过相关部门监管,其质量难以保障,也有可能是假冒伪劣产品,尽量不要购买。特别要提醒消费者的是:外包装上的中文标签上必须体现的信息包括食品名称、配料表、日期标示、贮存条件、原产国国名或地区区名以及在中国依法登记注册的代理商、地址和联系方式等。消费者在购买时也要尽量选择信誉好、经营规范的大型商场、超市,一旦发现食品的包装袋没有中文标签,最好谨慎购买。
摘自每日商报
Advance in L-malate production based on metabolic engineering strategies
ZHOU Li,CUI Wen-jing,LIU Zhong-mei,ZHOU Zhe-min*
(The Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
L-Malate was widely used in food,pharmaceutical and chemical industries.It was industrially produced using chemical or enzymatic method with petroleum derived resource as substrate.With reduction in oil resources,interest in the production of L-malate by microbial fermentation had been renewed.In recent years,metabolic engineering strategies have been applied to achieve L-malate production in Escherichia coli and yeasts etc.,which showed certain application prospect.Meanwhile,L-malate synthesis by constructing metabolic pathways in vitro with synthetic metabolic engineering had high theoretical value.This paper summarized metabolic routes for L-malate synthesis in microorganisms.Thereafter,metabolic engineering strategies for L-malate production including enhancement of L-malate synthesis pathway,deletion of byproduct accumulation routes and improvement of redox-power regeneration were reviewed to systemically explain the progress in metabolic mechanism of L-malate.Finally,further research areas in metabolically engineered L-malate production were proposed.
L-malate;metabolic engineering;microbial fermentation;reducing power regeneration
TS201.1
A
1002-0306(2015)10-0383-07
10.13386/j.issn1002-0306.2015.10.073
2014-09-12
周丽(1982-),女,博士,讲师,研究方向:工业微生物。
周哲敏(1968-),男,博士,教授,研究方向:酶学与酶工程。
国家自然科学基金(31300087);江苏省自然科学基金(BK20130131);江南大学自主科研课题(JUSRP1004)。
