西兰花CYP83A1基因的克隆及序列分析
2015-10-26曹阳理惠李勇孔稳稳李晶
曹阳理惠 李勇 孔稳稳 李晶
(东北农业大学生命科学学院 农业生物功能基因重点实验室,哈尔滨 150030)
西兰花CYP83A1基因的克隆及序列分析
曹阳理惠 李勇 孔稳稳 李晶
(东北农业大学生命科学学院 农业生物功能基因重点实验室,哈尔滨 150030)
为深入研究西兰花4-甲基亚磺酰丁基芥子油苷的合成代谢途径,对关键合成酶基因CYP83A1进行了克隆与生物信息学分析。根据前期西兰花转录组测序工作中获得的序列数据,同时参照GenBank数据库中拟南芥、小白菜和油菜等7种植物的CYP83A1基因CDS序列与西兰花进行比对,确定西兰花CYP83A1基因(BoCYP83A1)的CDS序列。采用RT-PCR技术对其进行了克隆,获得BoCYP83A1基因的CDS区序列,其全长为1 509 bp,编码502个氨基酸。预测该蛋白质的分子量为57.47 kD,理论等电点为7.1,包含2个跨膜结构域,且整个序列中不含信号肽,具有一个典型的P450结构域。氨基酸同源性分析表明,西兰花与油菜、大白菜的CYP83A1的相似性较高,均为98%。首次获得BoCYP83A1的CDS序列,其登录号为KM111290。
西兰花;CYP83A1基因;芥子油苷;序列分析;抗癌活性
芥子油苷(Glucosinolates,GS)又名硫代葡萄糖苷,是由氨基酸衍生而来的一类含氮、硫的重要次级代谢产物,主要存在于十字花科(Brassicaceae)植物中[1],如模式植物拟南芥(Arabidopsis thaliana)、西兰花、油菜、白菜及萝卜等植物。芥子油苷由3个基本结构组成,即β-D-硫葡萄糖基、硫化肟基团和可变的非糖侧链R[2],目前已发现的芥子油苷至少有120种[3]。根据氨基酸来源的不同,芥子油苷可分为脂肪族芥子油苷(来源于亮氨酸、异亮氨酸、甲硫氨酸、缬氨酸或丙氨酸)、芳香族芥子油苷(来源于酪氨酸或苯丙氨酸)和吲哚族芥子油苷(来源于色氨酸)[4]。脂肪族芥子油苷的合成过程共分为3步:氨基酸侧链的延长、核心结构的形成和葡萄糖配基侧链的次级修饰[4]。在植物体中,芥子油苷起到防御昆虫咬食以及病原菌侵害的重要作用[5]。同时,芥子油苷与十字花科蔬菜的特殊风味有着密切的关系,如萝卜的辛辣味[6,7]。
经前人研究,模式植物拟南芥基因组测序完成,在芥子油苷生物合成途径中的代谢调控基因陆续被鉴定出来。MAM基因负责调控侧链的延长,CYP79酶负责催化芥子油苷核心结构形成的第一个关键步骤,即氨基酸转化为乙醛肟。CYP83酶催化核心结构形成的关键步骤,即乙醛肟转化为芥子油苷[8,9]。CYP83酶属于细胞色素P450家族,是众多代谢途径中催化关键步骤的单氧化酶。众所周知,细胞色素P450家族是最大的酶蛋白家族之一[10]。P450s几乎存在于所有生物体中,且在植物体中大量存在,其氨基酸序列十分多样化[11]。尽管拟南芥中芥子油苷合成途径已经基本建立,但作为具有重要经济价值的蔬菜西兰花,其芥子油苷合成代谢相关基因的报道却很少。
西兰花(Brassica oleracea var. italica)又名花椰菜、绿花菜、青花菜,是十字花科(Brassicaceae)芸薹属(Brassica)甘蓝变种,为一、二年生草本植物,原产于意大利[12]。西兰花营养丰富,富含蛋白质、糖、脂肪、维生素和胡萝卜素,营养成份位居同类蔬菜之首,被誉为“蔬菜皇冠”。西兰花中含有丰富的芥子油苷[13],而西兰花花球中的脂肪族芥子油苷所占比例最高[14]。其中4-甲基亚磺酰丁基芥子油苷属于脂肪族芥子油苷,其降解产物中的萝卜硫素具有抗癌活性[15],因此备受关注。西兰花中含有的萝卜硫素(glucoraphanin)是异硫氰酸酯衍生物中具有最强抗癌活性的一种物质[16],对肺癌、食管癌、前胃癌作用明显。目前,美国已经将富含萝卜硫素的西兰花幼苗应用于肿瘤的临床治疗中[17]。
由此可见,芥子油苷对于十字花科植物响应外界虫害是极其重要的,并使其具有特殊风味。因此,充分研究十字花科植物中调控芥子油苷合成的基因就显得十分重要。由于西兰花在生活、科研和医疗等方面具有重要作用,因而本研究将西兰花作为试验材料。介于CYP83A1调控基因仅对脂肪族乙醛肟具有高亲和性,且将脂肪族乙醛肟转变为烯烃基芥子油苷、羟烷基芥子油苷和甲磺基芥子油苷进而生成脂肪族芥子油苷[18]。因此本研究以CYP83A1基因为研究对象,旨在克隆和分析西兰花芥子油苷合成途径中的CYP83A1基因。目前为止,CYP83A1已分别在拟南芥、油菜、萝卜、苜蓿、白菜和小白菜等植物中被成功克隆,而西兰花CYP83A1基因的研究仅限于已知599 bp的部分CDS序列,其理化性质、二级结构等信息尚未见报道。因此,本研究根据前期西兰花转录组测序工作中获得的序列数据,同时参照GenBank数据库中拟南芥、小白菜和油菜等7种植物的CYP83A1基因CDS序列与西兰花进行比对,确定西兰花CYP83A1基因的CDS序列。Mizutani和Müller 等[19,20]发现模式植物拟南芥CYP83A1基因优先在叶片中表达,因此本研究参照模式植物拟南芥以西兰花叶片为试验材料,克隆得到CYP83A1基因的CDS全长序列并对其序列进行生物信息学分析。为深入研究西兰花芥子油苷合成提供参考数据,为培育具有较高抗癌、抗病活性的优良西兰花品种提供基因资源和数据参考,本研究中将西兰花中的CYP83A1基因命名为BoCYP83A1。
1 材料与方法
1.1 材料
1.1.1 植物材料 西兰花(Brassica oleracea var. italica)为“青秀”一代自交品系,将种子置于铺有湿润滤纸的培养皿中3-4 d,24 h光照。经种子萌发后置于培养箱中培养,培养温度为20℃,相对湿度70%,光照强度100 μmol·m-2·s-1,光暗周期24 h/0 h。待4周后,取西兰花的幼叶作为试验材料。
1.1.2 菌株与试剂 西兰花转录组测序数据由东北农业大学植物次生代谢实验室提供;大肠杆菌DH5α、Not I和Pst I限制性内切酶、植物总RNA提取试剂盒、克隆载体pEASY-T5 Zero 试剂盒、LA Taq DNA聚合酶、Buffer、dNTP购自TIAGEN生物科技公司;凝胶回收试剂盒、反转录试剂盒购自Bioteke公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 西兰花叶片总RNA的提取和cDNA的合成用TIANGEN公司植物RNA提取试剂盒(Easy Pure Plant RNA Kit)提取西兰花总RNA,提取方法参照说明书。cDNA的合成参照Bioteke公司的supermoIII RT Kit 说明书。
1.2.2 西兰花CYP83A1基因的克隆及测序 将西兰花转录组测序结果在NCBI网站进行Blast比对,结果发现了与大白菜(FJ376049.1)、油菜(JX01730-1.1)、苜蓿(JX946192.1)、萝卜(KF682449.1)、黑芥菜(KF146937.1)、拟南芥(MM117451.3)和小白菜(HM347235.1)CYP83A1基因同源的序列。根据该序列,利用Primer5.0设计特异性引物(F:5'-ATGGTGCGGACACCATGTT-3',R:5'-TCATGC AAAATAGTTGTCAATATCTT-3'),以西兰花cDNA为模板进行PCR扩赠。PCR反应体系参见LA Taq DNA聚合酶(TIANGEN)说明书。PCR反应程序为:94℃预变性10 min;94℃变性30 s,53℃复性30 s,72℃延伸1 min 4 0 s,30个循环;72℃延伸10 min;4℃保存。PCR产物经浓度为1%的琼脂糖凝胶电泳分离后,使用琼脂糖凝胶回收试剂盒(Bioteke)回收目的条带。将回收的目的片段与克隆载体pEASY-T5(TIANGEN)连接,连接反应体系:PCR产物2 μL,pEASY-T5载体1 μL,25℃反应15 min。将连接产物转化到DH5α大肠杆菌感受态细胞中,涂布于含有卡那霉素的LB平板上进行筛选,挑取阳性克隆于含有卡那霉素的LB液体培养基中,37℃过夜培养。将过夜培养的菌液用M13通用引物进行PCR反应检测,提取阳性菌落质粒进行双酶切检测,将酶切结果正确的质粒交由博士生物公司进行测序。
1.2.3 西兰花CYP83A1基因的生物信息学分析 测序结果利用DNAMAN软件进行分析,确定西兰花CYP83A1基因的CDS序列。利用NCBI数据库中的Blastx和Blastp搜索引擎对测序结果进行同源性分析。利用DNAMAN软件对其他物种的同源氨基酸序列进行多重比对。利用MEGA 5.03软件构建不同植物CYP83A1氨基酸序列进化树。根据Protparam(http://web.expasy.org/protparam/)在线软件对其编码的蛋白质进行理化性质预测分析。根据NetPhos 2.0Server(http://www.cbs.dtu.dk/services/NetPhos/)在线软件对氨基酸翻译后修饰进行预测。根据ExPASy的 ProtScale(http://www.expasy.org/cgi-bin/ proscale.pl)程序对蛋白质疏水性进行预测。使用TMHMM软件(http://www.cbs.dtu.dk/services/TMHM M/)对蛋白质进行跨膜预测。利用SOPMA在线软件进行二级结构预测和分析。利用SignalP软件2.0版(http://www.cbs.dtu.dk /services/SignalP/) 进行信号肽预测。利用PSORT(http://psort.nibb. ac.jp/)II 软件进行细胞内定位预测。利用SMAR(http://smart.embl-heidelberg.de/)在线软件进行蛋白质序列的结构功能域的预测。利用SWISS-MODEL和Swiss-pdb软件进行蛋白质序列的三维结构预测。将正确的基因序列登陆到GenBank中并获取登录号。
2 结果
2.1 西兰花CYP83A1基因的克隆
根据西兰花转录组测序结果,与GenBank数据库中拟南芥、小白菜和油菜等CYP83A1基因的CDS序列进行比对,获得其同源保守区域并设计特异性引物。以西兰花4周大叶片为材料,提取总RNA,反转录成cDNA,作为PCR扩增的模板。通过PCR反应,得到一条1 500 bp左右的条带,与预测目的基因长度一致(图1)。
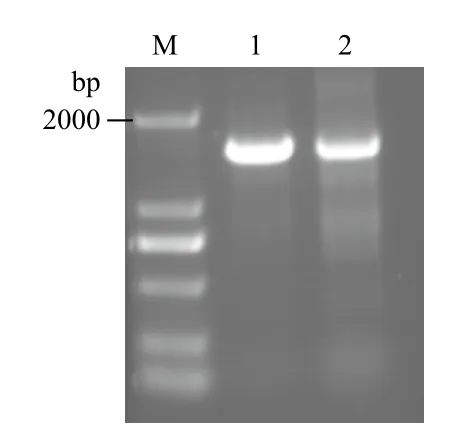
图1 西兰花CYP83A1基因的扩增
2.2 阳性单菌落的筛选与检测
将上述PCR产物用凝胶试剂盒回收后连接到pEASY-T5载体上,转入DH5α大肠杆菌感受态细胞中。挑取阳性克隆扩大培养,经M13载体通用引物进行PCR鉴定后,提取质粒并进行双酶切鉴定(图2),进一步确定扩增产物长度与目的片段长度一致。将PCR和双酶切鉴定结果正确的质粒测序,利用DNAMAN软件对测序结果进行分析,结果(图3)表明该基因全长为1 509 bp,编码502个氨基酸。GenBank登录号为:KM111290。
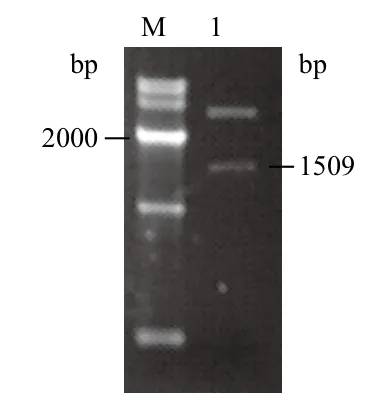
图2 EASY-T5-T-BoCYP83A1的质粒双酶切图
2.3 同源性及进化树分析
利用NCBI中的BLASTN和BLASTP程序,分析西兰花CYP83A1基因与其他植物CYP83A1的核苷酸同源性及氨基酸同源性。BLASTN分析表明,西兰花CYP83A1基因CDS与大白菜(FJ376049.1)、油菜(JX017301.1)、苜蓿(JX946192.1)、萝卜(KF-682449.1)、黑芥菜(KF146937.1)、拟南芥(MM11-7451.3)和小白菜(HM347235.1)的核酸同源性分别为97%、97%、95%、95%、93%、88%和87%;BLASTP分析表明,西兰花CYP83A1基因编码的氨基酸序列与油菜(AGD95055.1)、大白菜(ACR10-257.1)、苜蓿(AGS49167.1)、萝卜(AHB11194.1)、黑芥菜(AGO37753.1)、拟南芥(AAA79982.1)和小白菜(ADK32329.1)的氨基酸同源性分别为98%、98%、97%、97%、92%、88%和86%(图3)。系统发育树分析结果(图4)也表明,西兰花CYP-83A1基因在进化树上与大白菜、油菜等最接近,与拟南芥、小白菜等关系较远。同时图4显示,西兰花CYP83A1基因与油菜(AGD95055.1)、大白菜(ACR10257.1)一致性较高,与小白菜(ADK32329.1)的一致性较低,说明西兰花CYP83A1基因在进化过程中可能存在功能上的分支。
2.4 蛋白质理化性质分析
根据Protparam软件分析,西兰花CYP83A1蛋白由8 097个原子组成,分子质量为57.47 kD,分子式为C2600H4058N674O736S29,理论等电点pI=7.1;丙氨酸和亮氨酸含量分别为34和41个,占总数的6.8%和8.2%;带正电荷残基总数为64,带负电荷残基总数为64。分析结果显示,该蛋白在离体试验条件下的哺乳动物网织红细胞中半衰期为30 h,在离体试验的酵母中半衰期为> 20 h,在离体试验的大肠杆菌中半衰期为>10 h;脂肪族指数为80.80,不稳定指数为33.23,属于稳定类蛋白。
根据TMHMM软件分析,西兰花CYP83A1蛋白的氨基酸序列上共发现2个跨膜区域,分别位于氨基酸第4-21位(由外向内)和294-316位(由内向外),N端在膜外侧,说明该蛋白属于跨膜蛋白(图5-A)。用ProtScale对西兰花CYP83A1氨基酸序列的亲水性/疏水性进行预测,结果(图5-B)表明,多肽链中的第12位氨基酸具有最高的分值3.267,表明该位点的氨基酸疏水性最强;第101位的氨基酸分值最低为-3.100,表明其亲水性最强。根据数据结果可知,总平均亲水性(GRAVY)为-0.252,此为亲水性蛋白。
蛋白质基序预测结果显示,第350-353氨基酸处有1个N-糖基化位点,并包含2个酰胺化位点、5个酪蛋白激酶II磷酸化位点、4个N-豆蔻酰化位点、6个蛋白激酶C磷酸化位点、2个酪氨酸激酶磷酸化位点。根据SignalP软件分析,西兰花CYP83A1基因编码的蛋白质,由于该序列定位于线粒体(mTP)值为0.096、信号肽(SP)值为0.015,所以该蛋白不定位于线粒体,无信号肽,为非分泌型蛋白。用SMART在线软件分析了蛋白质结构的功能域,结果(图5-E)显示,在第4-21位之间是一个跨膜结构域;在第31-494位之间有一个典型的P450结构域,说明西兰花CYP83A1蛋白属于P450蛋白家族。
用SOPMA对西兰花CYP83A1氨基酸序列的二级结构进行预测(图5-C),西兰花的CYP83A1由44.42%的α-螺旋、14.94%的延伸链、10.76%的β-转角和29.88%的无规则卷曲组成。由分析数据可得结论,α-螺旋是西兰花CYP83A1中最多的元件,以不规则卷曲散布于整个蛋白质中。用Netph2.0 Server对西兰花CYP83A1的翻译后修饰预测的结果(图5-D)表明,整个肽链中分值在0.5(阈值)以上的氨基酸位点有16个,可知CYP83A1的磷酸化位点有16个,其中Ser:6、Thr:6、Tyr:1。
利用SWISS-MODEL和SWISS-PDB软件,输入该CYP83A1的氨基酸序列,根据已知蛋白质结进行该CYP83A1三维结构的同源建模(图5-F)。CYP83A1三维结构预测为研究CYP83A1结构与功能的关系提供了理论参考。

图3 西兰花CYP83A1蛋白的氨基酸序列与其他相关序列的多重比对
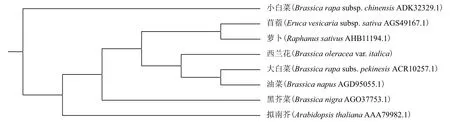
图4 不同植物CYP83A1氨基酸序列的系统进化树
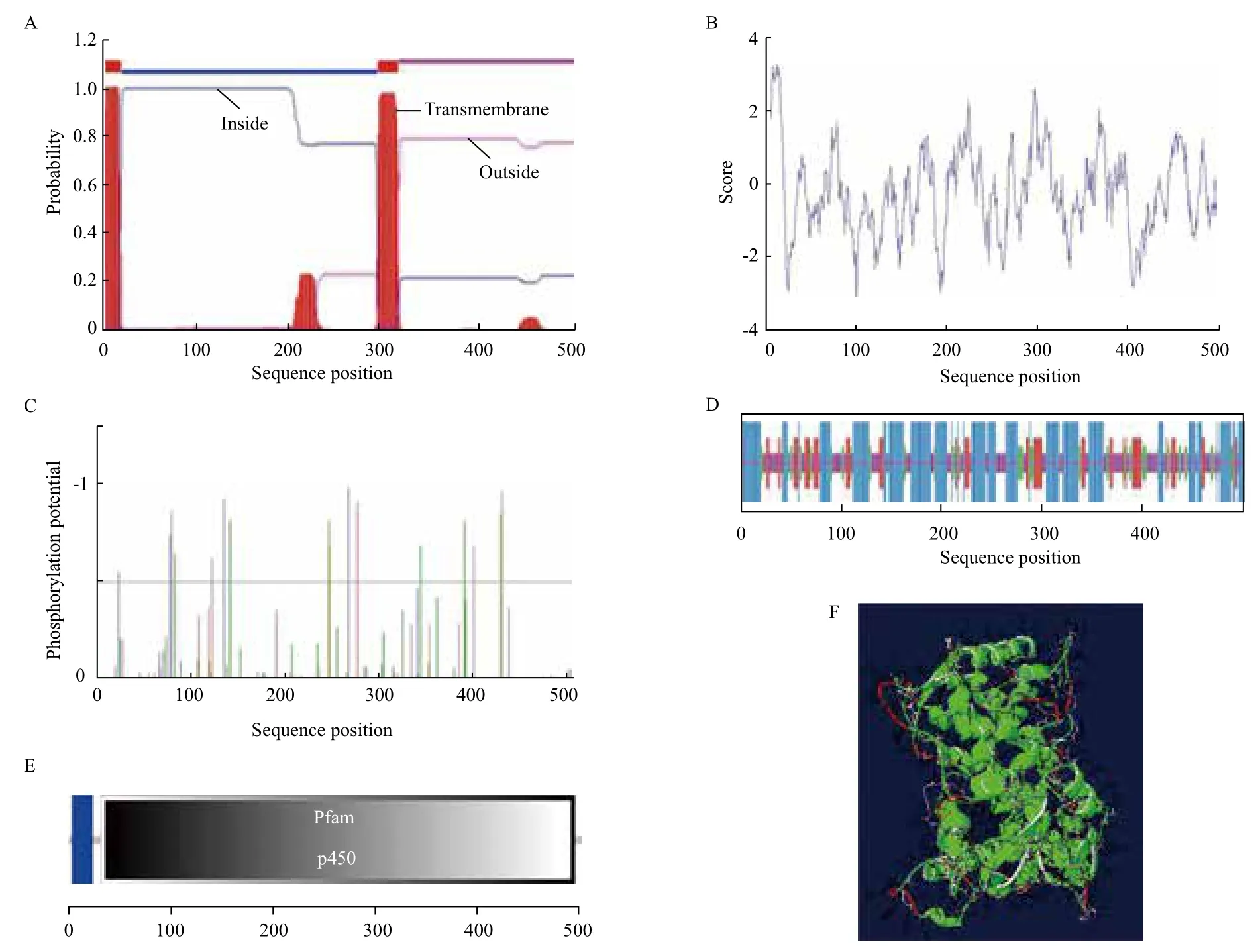
图5 BoCYP83A1蛋白质理化性质分析
3 讨论
根据西兰花转录组测序结果与GenBank数据库中油菜、苜蓿、拟南芥等CYP83A1基因CDS序列进行比对,获得BoCYP83A1同源保守序列。以西兰花4周大叶片的总RNA反转录得到的cDNA为模板,克隆得到该基因的CDS全长序列。通过测序和NCBI中的BLASTN、BLASTP程序[21]分析表明,该基因的核苷酸序列及其编码的氨基酸序列与大白菜、油菜的相似性最高,分别为97 %和98 %。由此可知,CYP83A1在西兰花、大白菜以及油菜种具有很高的保守性。利用生物信息学分析软件对西兰花CYP83A1基因编码的蛋白质进行预测和分析,根据Protparam软件[22]分析以及Netph2.0 Server[23]翻译后修饰预测获得了BoCYP83A1的理化性质,且与拟南芥CYP83A1的理化性质(数据未列出)相比较,二者大体相类似且均为稳定类蛋白。根据TMHMM[24]、SignalP[25]和ProtScale[26]软件预测出BoCYP83A1是一个具有跨膜结构域的亲水性蛋白,无信号肽,属于非分泌型蛋白。其主要的二级元件是α-螺旋和不规则卷曲,同时SMART在线软件分析表明西兰花CYP83A1蛋白具有细胞P450家族特征性结构域及保守功能域,与拟南芥CYP83A1具有相同结构域。利用SWISS-MODEL和SWISS-PDB[27]软件,获得BoCYP83A1蛋白的三维结果和同源建模。上述分析表明,BoCYP83A1与拟南芥CYP83A1的碱基序列和氨基酸序一致性较低,但具有相同结构域,说明功能上同为一个家族,这对研究BoCYP83A1基因奠定了重要的基础。
至今,西兰花中CYP83A1基因的过表达和缺失对于防御虫害、病原菌等起到的作用尚未知晓,并且西兰花CYP83A1基因序列及其功能的研究报道甚少。而在2014年Corina Weis、Ulrich Hildebrandt等[28]以拟南芥CYP83A1缺失突变体和十字花科白粉菌为试验材料,着重研究在CYP83A1基因缺失导致脂肪族乙醛肟和未鉴定的代谢产物的积累的情况下,此改变延缓十字花科白粉菌的生长了,说明拟南芥中CYP83A1基因缺失对于防御真菌起到了积极的作用。因BoCYP83A1与拟南芥CYP83A1功能上具有相似性且为同一功能家族,因此以十字花科模式植物拟南芥CYP83A1基因为依据,对西兰花CYP83A1基因进行深入研究是具有重要意义的。由于脂肪族芥子油苷与十字花科蔬菜的抗癌活性及其风味有关[29],今后若能通过试验将西兰花中的脂肪族芥子油苷含量提高,此种西兰花在食用、医疗和科研等方面将具有重要意义。通过对CYP83A1基因的生物信息学分析,对今后该基因的研究及西兰花芥子油苷合成途径的更深入的了解提供了一定的参考依据。
4 结论
首次成功克隆并报道了西兰花CYP83A1基因的CDS全长序列,利用生物学软件和网站对该序列进行同源性比对、进化树分析、理化性质分析,获得了西兰花CYP83A1基因的部分信息。
[1] Bekaert M, Edger PP, Hudson CM, et al. Metabolic and evolutionary costs of herbivory defense:systems biology of glucosinolate synthesis[J]. New Phytologist, 2012, 196(2):596-605.
[2] Buxdorf K, Yaffe H, Barda O, et al. The Effects of glucosinolates and their breakdown products on necrotrophic fungi[J]. PloS one,2013, 8(8):e70771.
[3] Sønderby IE, Geu-Flores F, Halkier BA, et al. Biosynthesis of glucosinolates-gene discovery and beyond[J]. Trends Plant Sci,2010, 15(5):283-290.
[4] Fahey JW, Zalcmann AT. The Chemical diversity and distribution of glucosinolates and isothiocyanates among plants[J]. Phytochemistry, 2001, 56(1):5-51.
[5] Gachon CMM, Langlois-Meurinne M, Henry Y, et al. Transcription co-regulation of secondary metabolism enzymes in Arabidopsis:functional and evolutionary implications[J]. Plant Molecular Biology, 2005, 58(2):229-245.
[6]黄界颍, 马友华. 油菜硫甙特征功能及其测定方法[J]. 植物生理学通讯, 2003, 39(5):496-500.
[7]徐东辉. 白菜类作物硫代葡萄糖甙及一些主要代谢组分的遗传分析[D]. 北京:中国农业科学院, 2007.
[8] Grubb CD, Abel S. Glucosinolate metabolism and its control[J]. Trends Plant Science, 2006, 11(2):89-100.
[9] Smolen G,Bender J. Arabidopsis cytochrome p450 cyp83B1mutation active the tryptophan biosynthetic pathway[J]. Genetics, 2002,160(2):323-332.
[10] Bak S, Feyereisen R. The involvement of two P450 enzymes CYP-83B1 and CYP83A1 in auxin homeostasis and glucosinolate biosynthesis[J]. Plant Physiologists, 2010, 127(1):108-118.
[11] Wereck-Reichart D, Feyereisen R. Cytochromes P450:a success story[J]. Genome Biology, 2000, 1(6):3003. 1-3003. 9.
[12]季宇彬, 池文杰, 邹翔, 等. 西兰花中萝卜硫素提取、分离与抗癌活性研究[J]. 哈尔滨商业大学学报:自然科学版,2005, 21(3):270-273.
[13] Thomas R, Rüdiger H. Effect of Se-fertilization on the growth and S-metabolism of Broccoli(Brassica oleracea var. italic)[D]. Germany:Combined Faculties for the Natural Sciences and for Mathematics Of the Ruperto-Carola University of Heidelberg, 2010.
[14] 何洪巨, 陈杭. 芸薹属蔬菜中硫代葡萄糖苷鉴定与含量分析[J]. 中国农业科学, 2002, 35(2):192-197.
[15] Navarro SL, Li F, Lampe JW. Mechanisms of action of isothiocyanates in cancer chemoprevention:an update[J]. Food & Function, 2011, 2(10):579-587.
[16]宋廷宇, 侯喜林, 何启伟, 等. 薹菜中硫代葡萄糖苷的鉴定与含量分析[J]. 园艺学报, 2008, 35:1161-1166.
[17] Gao J, Yu X, Ma F, et al. RNA-Seq analysis of transcriptome and glucosinolate metabolism in seeds and sprouts of Broccoli brassica oleracea varitalic[J]. PloS One, 2014, 9(2):e88804.
[18] 程坤, 杨丽梅, 方智远, 等. 十字花科植物中主要硫代葡萄糖苷合成与调节基因的研究进展[J]. 中国蔬菜, 2010(12):1-6.
[19] Mizutani M, Ward E, Ohta D. Cytochrome P450 superfamily in Arabidopsis thaliana:isolation of cDNAs, differential expression and RFLP mapping of multiple cytochromes P450[J]. Plant Mol Biol, 1998, 37(1):39-52.
[20] Müller A, Weiler EW. Indolic constituents and indole-3-acetic acids biosynthesis in the wild-type and a tryptophan auxotroph mutant of Arabidopsis thaliana[J]. Planta, 2000, 211(6):855-863.
[21] Mark J, Irena Z, Yan R, et al. NCBI BLAST:a better web interface[J]. Nucleic Acids Research, 2008, 36:W5-W9.
[22] Elisabeth G, Christine H, Alexandre G, el at. Protein identification and analysis tools on the ExPASy server[M]. The Protocols Handbook:Humana Press, 2005:571-607.
[23] Geourjon C, Deleage G. SOPMA:significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments[J]. Computer Applications in the Biosciences:CABIOS, 1995, 11(6):681-684.
[24] Chen YJ, Yu P, Luo JC, et al. Secreted protein prediction system combining CJ-SPHMM,TMHMM and PSORT[J]. Mammalian Genome, 2003, 14(12):859-865.
[25] Dyrløv Bendtsen J, Nielsen H, von Heijne G, et al. Improved prediction of signal peptides:SignalP 3. 0. [J]. Journal of Molecular Biology, 2004, 340(4):783-795.
[26] Gomase VS, Chitlange NR, Sherkhane AS, et al. Prediction of Wuchereria Bancrofti Troponin antigenic peptides:application in synthetic vaccine design to counter lymphatic filariasis[J]. J Vaccines Vaccin, 2013, 4(169):2.
[27] Guex N, Peitsch MC. SWISS-MODEL and the Swiss-Pdb Viewer:an environment for comparative protein modeling[J]. Electrophoresis, 1997, 18(15):2714-2723.
[28] Weis C, Hildebrandt U, Hoffmann T, et al. CYP83A1 is required for metabolic compatibility of Arabidopsis with the adapted powdery mildew fungus Erysiphe cruciferarum[J]. New Phytologist, 2014,202(4):1310-1319.
[29] Baik HY, Juvik JA, Jeffery EH, et al. Relating glucosinolate content and flavor of broccoli cultivars[J]. Journal of Food Science,2003, 68(3):1043-1050.
.
(责任编辑 李楠)
Cloning and Sequence Analysis of CYP83A1 Gene from Brassica oleracea var. italica
Cao Yanglihui Li Yong Kong Wenwen Li Jing
(Key Laboratory of Agricultural Functional Genes,Northeast Agricultural University College of Life Sciences,Harbin 150030)
To further research the related genes involved in 4-methylsulfinybutyl-glucosinolate biosynthesis in Brassica oleracea var. italica, the key synthetase CYP83A1gene was cloned and analyzed by bioinformatics. The sequence of CYP83A1 from the previous data of broccoli transcriptome sequencing and the sequences of CYP83A1 in seven other plants (Arabidopsis thaliana, Brassica napus and the Brassica rapa subsp. Pekinesis et.al)which obtained from GenBank were alignmented with each other using NCBI blaster, and we confirmed that the homologically conserved region of CYP83A1 gene in Brassica oleracea var. italica (BoCYP83A1). Using RT-PCR method, the CDS region of BoCYP83A1 was obtained. Bioinformatic analysis indicated that the CDS region of BoCYP83A1 was 1 509 bp long which encoded a predicated a protein contains 502 amino acids. Protein analysis showed that BoCYP83A1 molecular weight was 57.47 kD, theoretical pI was 7.1 and contained two span membrane structures, and the BoCYP83A1 does not have signal peptide sequences, while possessed a P450 functional domains. Homology analysis of the deduced amino acids indicated that BoCYP83A1 had 98% similarity with Brassica napus and the Brassica rapa subsp. Pekinesis. The gene registration number of Brassica oleracea var. italica CYP83A1 gene is KM111290.
Brassica oleracea var. italica;CYP83A1 gene;glucosinolates;sequence analysis;antitumor activity
10.13560/j.cnki.biotech.bull.1985.2015.02.015
2014-06-30
国家自然科学基金项目(31370334)
曹阳理惠,女,硕士,研究生,研究方向:植物学;E-mail:caoyanglihui@126.com
李晶,女,博士,教授,研究方向:植物学;E-mail:lijing@neau.edu.cn
