基于2-羟基-3-硝基苯甲酸铜(Ⅱ)配合物的合成、结构与磁性质
2015-10-17陈鹰鹏陈蒙恩余佳纹杨恩翠赵小军
陈鹰鹏,陈蒙恩,余佳纹,杨恩翠,赵小军
(天津师范大学a.化学学院,b.无机-有机杂化功能材料化学省部共建教育部重点实验室,c.天津市功能分子结构与性能重点实验室,天津300387)
基于2-羟基-3-硝基苯甲酸铜(Ⅱ)配合物的合成、结构与磁性质
陈鹰鹏,陈蒙恩,余佳纹,杨恩翠,赵小军
(天津师范大学a.化学学院,b.无机-有机杂化功能材料化学省部共建教育部重点实验室,c.天津市功能分子结构与性能重点实验室,天津300387)
采用水热方法制备了1个新颖的混合配体铜(Ⅱ)配合物[Cu2(C7H3NO5)2(2,2′-bpy)2]n(C7H3NO5为2-羟基-3-硝基苯甲酸二价阴离子,2,2′-bpy为2,2′-联吡啶),并通过单晶和粉末X-射线衍射、元素分析、红外光谱对其进行结构表征.配合物结晶于单斜的P21/c空间群,a=1.8803(2)nm,b=1.8606(2)nm,c=0.89406(10)nm,β=92.671(2)°,V=3.1245(6)nm3,Z=4.配合物中2个晶体学独立的Cu(Ⅱ)离子通过2-羟基-3-硝基苯甲酸二价阴离子拓展形成弯曲的一维链状结构.另外还测试了该化合物的热重和磁化率等磁性能,其分子中相邻的Cu(Ⅱ)离子之间呈现弱的反铁磁相互作用.
晶体结构;混合配体;2-羟基-3-硝基苯甲酸;磁性
近年来,由顺磁的过渡金属离子和有机桥联配体通过配位键作用形成的磁性金属配合物(magnetic metal complexes)吸引了化学家、物理学家以及材料学家的广泛关注和浓厚的研究兴趣[1].一方面,通过巧妙地选择具有不同磁属性的过渡金属离子和结构多样的有机桥联配体可以获得结构新颖、拓扑多变的晶态磁性金属配合物,为其磁构关系的研究奠定了良好的基础;另一方面,磁性金属配合物由于自身多种不同的磁相互作用种类和强度,呈现出不同程度的长程磁有序、单链或单分子磁体行为,在高密度信息储存器件、量子化学运算、分子自旋电子学等高新技术领域具有很好的分子水平的应用前景[2-4].此外,与传统的无机磁性材料相比,金属配合物型的磁性材料具备了无机金属离子的本征磁性和有机配体的可调制性与易于加工性能,并且能够从分子水平上进行剪裁和修饰,从而更有利于进行功能导向的新型磁性材料的设计与合成研究.
研究人员[5-7]利用去质子的羧基和顺磁的过渡金属离子自组装反应,先后获得了许多具有不同结构子单元(三角形的三核、蝴蝶状的四核、沙漏状的五核以及圆盘状的七核等)和维数(零维的有限核分子、弯曲的或螺旋状一维链、二维层状结构以及三维骨架结构)的顺磁配合物.晶体结构研究发现,这些配合物的结构多样性依赖于羧基的去质子化程度、位置、数目以及和溶剂分子间丰富的弱相互作用等众多因素.从磁构关系的角度来看,羧基磁桥与顺磁过渡金属离子不同的键合模式以及羧基自身的构象等因素影响着体系中磁耦合的强度和类型[8-9].
为了进一步研究羧基-顺磁过渡金属磁体系中辅助官能团对于目标配合物的结构和磁构关系的影响,本研究以3-硝基邻苯二甲酸作为有机磁桥,使其与各向同性的无机铜(Ⅱ)离子和辅助配体2,2′-联吡啶进行自组装反应,制备混合配体顺磁金属配合物,并对其进行结构表征和磁性能的测试.
1 实验
1.1 仪器与试剂
仪器:FA2004型精密电子天平,由上海上平仪器有限公司生产;84-3型磁力加热搅拌器,由甄城华鲁电热仪器有限公司生产;23.0 mL不锈钢水热反应釜,由济南恒华试剂公司生产;Bruker APEXⅡCCD X-射线单晶衍射仪和Bruker D8 ADVANCE粉末衍射仪,由德国Bruker公司生产;FT-IR型红外光谱仪(KBr压片法),由美国Varian公司生产;MPMS-XL-7磁性测量仪,由美国量子公司生产;CE-440元素分析仪,由美国Leemanlabs公司生产.
试剂:所有试剂均为分析纯级.水合硝酸铜,由天津化学试剂三厂生产;2,2′-联吡啶,由天津市福晨化学试剂厂生产;3-硝基邻苯二甲酸,由百灵威科技有限公司生产.
1.2 配合物的合成
Cu(NO3)2·6H2O(24.1 mg,0.1 mmol)、3-硝基邻苯二甲酸(44.4 mg,0.2 mmol)、2,2′-联吡啶(15.6 mg,0.1 mmol)和双蒸水(8.0 mL)密封在内衬有聚四氟乙烯的23.0 mL不锈钢高压反应釜内.将该反应釜转移至控温烘箱中,以2.5℃/h的升温速率将其加热到160℃,并在此温度下保持72 h.然后以5.0℃/h的降温速率冷却反应釜到室温.得到适于X-射线单晶衍射分析的蓝色块状晶体,过滤,用去离子水洗涤,在空气中干燥(产率为50%).对C34H22O10N6Cu2做元素分析,理论值:C,58.89%;H,2.74%;N,10.48%.实际值:C,58.85%;H,2.71%;N,10.52%.FT-IR(KBr,cm-1):1 610(s),1 525(m),1 500(s),1 441(m),1 343(w),1152(vs),1076(vs),947(s),858(s),774(m),734(w),618(m),542(w).
1.3 配合物的晶体结构测定
选取尺寸为0.17 mm×0.15 mm×0.14 mm的配合物的单晶体,在显微镜下进行单晶X-射线结构测定.在Bruker APEXⅡCCD衍射仪上,铜(Ⅱ)配合物的衍射强度为296 K,用经石墨单色化的Mo-Kα射线 (λ= 0.071 073 nm),以渍-ω方式收集衍射数据.所有衍射数据通过SADABS软件[10]用multi-scan方法进行半经验吸收校正.晶胞参数用最小二乘法确定.数据还原和结构解析分别使用SAINT和SHELXL程序包[11-12]完成.所有非氢原子用全矩阵最小二乘法进行各向异性精修.配体2-羟基-3-硝基苯甲酸二价阴离子中,硝基是无序的,处在2个不同的位置上,其占有率分别为59.7%和40.6%.配合物的CCDC编号为1054172,其晶体学数据和精修参数如表1所示,重要的键长和键角数据如表2所示.

表1 配合物的晶体学数据和精修参数Tab.1 Structural and refinement parameters of complex

表2 配合物的主要键长和键角aTab.2 Selected bond lengths and angles for complexa
2 结果与讨论
2.1 配合物的晶体结构
配合物结晶于单斜的P21/c空间群,呈现出弯曲的Z字形一维链状结构.配合物的不对称单元含有2个晶体学独立的Cu(Ⅱ)离子、2个中性的2,2′-联吡啶分子和2个2-羟基-3-硝基苯甲酸的二价阴离子.需要特别指出的是,配合物中2-羟基-3-硝基苯甲酸的二价阴离子是由反应物3-硝基邻苯二甲酸在水热反应过程中转化而来的.如图1所示,配合物所含2个晶体学独立的Cu(Ⅱ)离子均采用六配位的CuN2O4拉长的八面体构型.Cu(1)离子的赤道平面分别被2-羟基3-硝基苯甲酸中的羧基氧原子和去质子的羟基氧原子以及1个2,2′-联吡啶分子的2个氮原子螯合配位,其键长在0.187 2(3)~0.198 7(3)nm范围内变化,如表2所示.Cu(1)离子的2个轴向位置分别被2个晶体学独立的2-羟基3-硝基苯甲酸的羧基氧原子和硝基氧原子占据,其中Cu—O的轴向键长比赤道方向的键长长0.08~0.10 nm,如表2所示.Cu(2)离子的配位环境与Cu(1)类似,也呈现拉长的八面体构型.
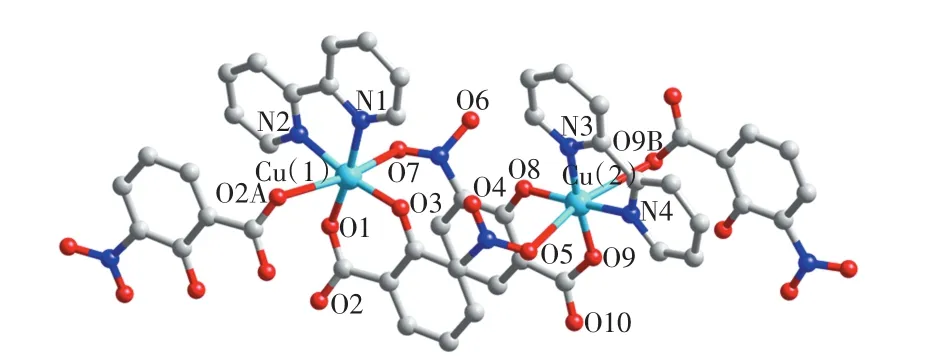
图1 配合物中Cu(Ⅱ)离子的配位环境图Fig.1 Local coordination environments of Cu(Ⅱ)ions in complex
配合物中2,2′-联吡啶采取不对称的双齿螯合的模式与Cu(Ⅱ)离子键合,其键长差别为0.000 4 nm.2-羟基-3-硝基苯甲酸的羧基和羟基均为去质子的阴离子形式,其中羧基、羟基和硝基氧原子均与Cu(Ⅱ)离子配位.如图2所示,相邻的2个Cu1位点通过配体2-羟基-3-硝基苯甲酸中的羧基氧原子双齿桥联形式形成一个二聚体.同样,相邻的2个Cu2原子则通过2-羟基-3-硝基苯甲酸中的羧基氧原子单原子桥联模式连接形成另外一个二聚体.其中,Cu(1)…Cu(1)的距离为0.502 25(3)nm,Cu(2)…Cu(2)的距离为0.361 66(3)nm.2个二聚体之间通过2对硝基氧原子的单齿桥联交替连接形成Z字形一维链,其中Cu(1)…Cu(2)的距离为0.657 7(7)nm.
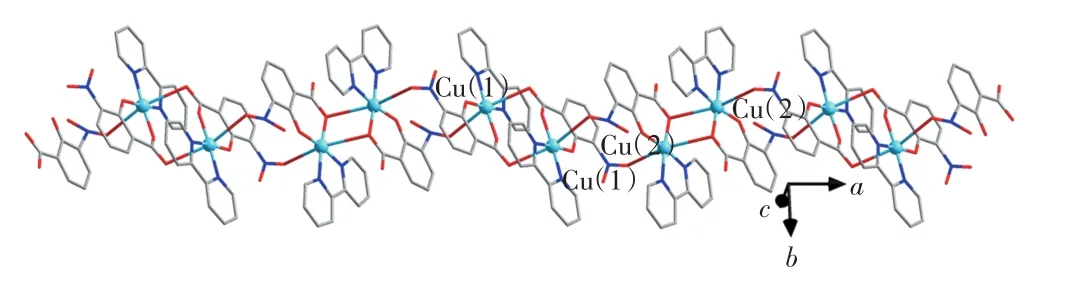
图2 配合物的一维链状结构Fig.2 Polymeric one-dimensional chain of complex
2.2 配合物的红外光谱和粉末衍射结果分析
与自由的3-硝基邻苯二甲酸的红外光谱相比,配合物的红外光谱中1 731cm-1处强特征峰消失,这证明了该配体中羧基是以去质子的形式存在[13].同时,羧基的不对称和对称伸缩振动吸收峰出现在1 441~ 1 610 cm-1处.此外,2,2′-联吡啶配体的特征振动峰出现在1 575、1379、858和734cm-1处.在5°≤2θ≤50°的范围内测定了配合物的X-射线粉末衍射谱图,结果如图3所示.由图3可知,配合物的粉末衍射图谱与理论模拟的图谱相一致,表明宏量制备的配合物具有可靠的相纯度,且与单晶X-射线衍射测定的晶体结构相同.
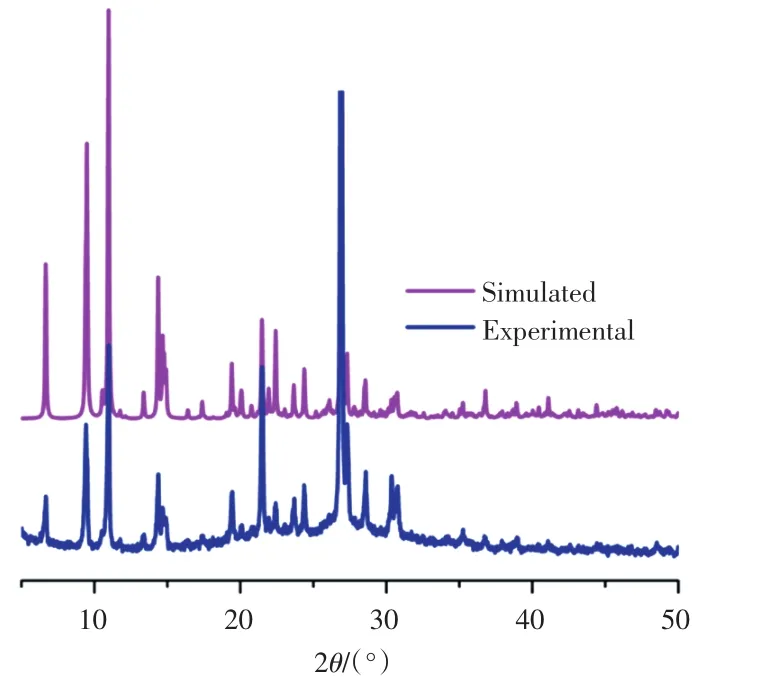
图3 配合物的粉末衍射图Fig.3 Powder X-ray diffraction patterns of complex
2.3 配合物的磁学性质
在外加1 000 Oe的直流磁场下,配合物在2~ 300 K范围内的变温磁率曲线如图4所示.由图4可知,300 K时,配合物中每个二聚的铜单元的χMT值为0.90 cm3·K/mol,这与2个孤立的、无磁相互作用的Cu(Ⅱ)离子(S=1/2和g=2.15)的理论值一致.随着温度不断下降,配合物的χMT值几乎保持不变.当温度降到4.0 K以下时,配合物的χMT值呈现微弱下降趋势,表明配合物中相邻的Cu(Ⅱ)离子之间存在弱的反铁磁作用.对配合物的变温磁化率曲线进行2~300 K范围内的Curie-Weiss拟合,可得C=0.92 cm3·K/mol,θ=-0.34 K,如图4所示.θ值较小且为负值证明了配合物中存在着弱的反铁磁作用.
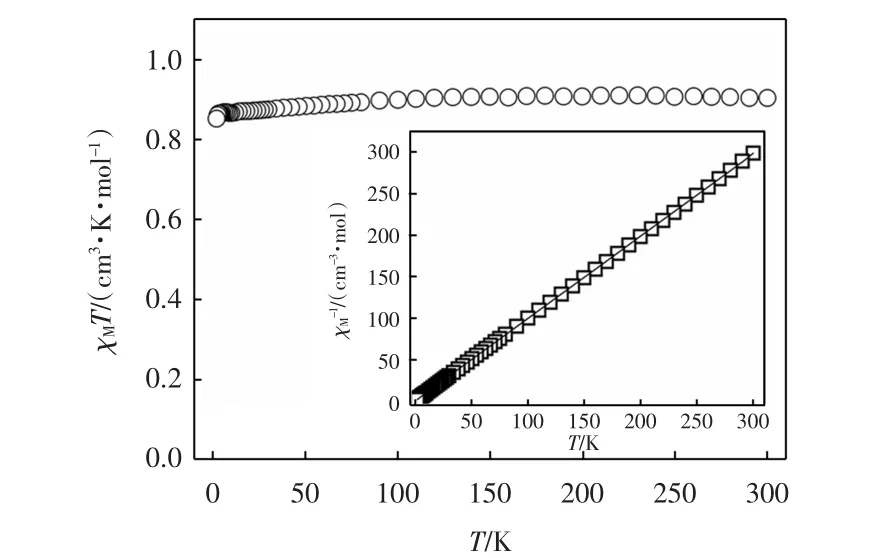
图4 配合物的变温磁化率曲线Fig.4 Temperature dependence of χMT and χM-1(inset)for complex
温度为2.0 K时,对配合物进行变场磁化强度测定,得到M-H曲线,如图5所示.当外加磁场为70 kOe时,配合物的磁化强度为2.14 μB,这与2个Cu(Ⅱ)离子的饱和磁化强度值一致.此外,配合物的MH曲线与S=1、g=2.16的Brillouin函数吻合,表明配合物存在顺磁基态.
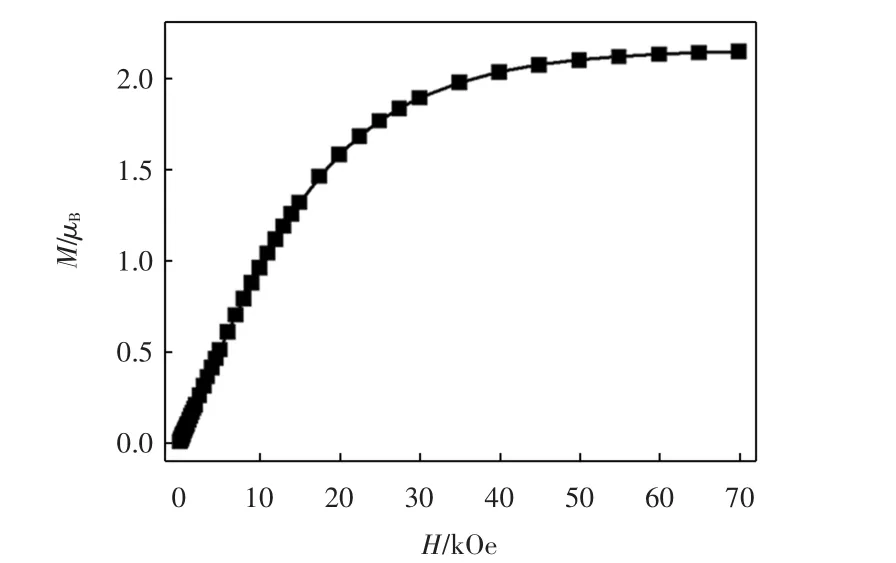
图5 配合物的变场磁化强度曲线Fig.5 Field dependence of magnetization for complex
3 结论
3-硝基邻苯二甲酸和2,2′-联吡啶及无机铜盐在水热条件下反应得到了一个新的基于2-羟基-3-硝基苯甲酸铜(Ⅱ)的顺磁金属配合物.该配合物中2个晶体学上独立的Cu(Ⅱ)离子被有机羧酸配体拓展形成非线性的一维链状化合物,其中相邻的Cu(Ⅱ)离子间存在弱的反铁磁相互作用.
[1]KURMOO M.Magnetic metal-organic frameworks[J].Chem Soc Rev,2009,38(5):1353-1379.
[2]TROIANI F,AFFRONTE M.Molecular spins for quantum information technologies[J].Chem Soc Rev,2011,40(6):3119-3129.
[3]LEUENBERGER M N,LOSS D.Quantum computing in molecular magnets[J].Nature,2001,410:789-793.
[4]VERDAGUER M.Molecular magnetism:a three-headed Janus material [J].Nature Chem,2012(4):871-872.
[5]YANG E C,LIU Z Y,ZHAO X J,et al.A 3D CoⅡframework with alternating vertex-and edge-sharing-ribbons showing a two-step fieldinduced magnetic transition[J].Chem Commun,2011,47(30):8629-8631.
[6]YANGEC,LIUZY,ZHAOXJ,etal.Two3Dtriazolate-tricarboxylatebridged CuⅡ/I frameworks by one-pot hydrothermal synthesis exhibiting spin-canted antiferromagnetism and strong antiferromagnetic couplings [J].Inorg Chem,2010,49(17):7969-7975.
[7] 杨恩翠,刘茜,赵小军,等.唑基-羧基-过渡金属离子三元体系的结构和磁性能研究进展[J].天津师范大学学报:自然科学版,2015,35(1):54-64.
[8] WANG X Y,WANG Z M,GAO S.Constructing magnetic molecular solids by employing three-atom ligands as bridges[J].Chem Commun,2008(3):281-294.
[9] ZENG Y F,HU X,LIU F C,et al.Azido-mediated systems showing different magnetic behaviors[J].Chem Soc Rev,2009,38(2):469-480.
[10]SHELDRICK G M.SADABS:Program for Empirical Absorption Correction of Area Detector Data[M].G觟ttingen:University of G觟ttingen,1996.
[11]BRUKER A X S.SAINT Software Reference Manual[M].Madison:WI,1998.
[12]SHELDRICK G M.SHELXL-97:Program for X-ray Crystal Structure Refinement[M].G觟ttingen:University of G觟ttingen,1997.
[13]BELLAMY L J.The Infrared Spectra of Complex Molecules[M].New York:Wiley,1958.
(责任编校 纪翠荣)
Synthesis,structure and magnetism of a new 2-hydroxy-3-nitrobenzoate-based Cu(Ⅱ)complex
CHEN Yingpeng,CHEN Meng′en,YU Jiawen,YANG Encui,ZHAO Xiaojun
(a.College of Chemistry,b.Key Laboratory of Inorganic-Organic Hybrid Functional Material Chemistry,Ministry of Education,c.Tianjin Key Laboratory of Structure and Performance for Functional Molecules,Tianjin Normal University,Tianjin 300387,China)
A novel complex,[Cu2(C7H3NO5)2(2,2′-bpy)2]n(C7H3NO5=2-hydroxy-3-nitrobenzoate,2,2′-bpy=2,2′-bipyridine)was hydrothermally synthesized,which was structurally and magnetically characterized by single-crystal and powder X-ray crystallography,elemental analysis and FT-IR spectrum.The complex crystallizes in the monoclinic P21/c space group with a=1.880 3(2)nm,b=1.860 6(2)nm,c=0.894 06(10)nm,β=92.671(2)°,V=3.124 5(6)nm3and Z=4.Two crystallographically independent Cu(Ⅱ)ions in the complex are infinitely extended by 2-hydroxy-3-nitrobenzoate,generating a bent one-dimensional chain.Additionally,thermal stability and magnetic property of the complex were also measured,in which weak antiferromagnetic coupling was observed between the adjacent Cu(Ⅱ)ions.
crystal structure;mixed ligands;2-hydroxy-3-nitrobenzoic acid;magnetism
1671-1114(2015)04-0090-04
O614
A
2015-03-18
天津市教委重点资助项目(2012ZD02);天津市高等学校创新团队培养计划资助项目(TD12-5038);大学生创新创业训练计划资助项目(201410065004).
陈鹰鹏(1994—),男,本科生.
赵小军(1955—),男,教授,主要从事功能配合物方面的研究.
