E3泛素连接酶对卵巢癌细胞系SKOV3/DDP顺铂耐药性的影响
2015-10-16王小特曹怡
王小特++曹怡
[摘要] 目的 探讨E3泛素连接酶(EDD)基因在SKOV3/DDP细胞顺铂耐药中的作用。 方法 采用RT-PCR和Western blot检测人卵巢癌SKOV3细胞和SKOV3/DDP细胞内EDD表达水平的差异。通过转染EDD-siRNA沉默EDD的表达后,噻唑蓝法检测顺铂对SKOV3/DDP细胞增殖的影响,Annexin V-FITC/PI双染法检测顺铂对细胞凋亡的影响;Western blotting检测髓样细胞白血病-1(Mcl-1)和细胞周期检测点激酶2(CHK2)蛋白表达水平。 结果 SKOV3细胞EDD的表达水平显著低于卵巢癌耐药细胞SKOV3/DDP(P < 0.05)。EDD-siRNA转染24 h后,EDD mRNA和蛋白表达水平均显著低于未转染组(P < 0.05);SKOV3/DDP细胞IC50值显著降低(P < 0.05),Mcl-1蛋白的表达受到抑制(P < 0.05),而CHK2无明显变化(P > 0.05)。 结论 EDD-siRNA能沉默EDD基因,降低Mcl-1蛋白的表达水平,增强顺铂对SKOV3/DDP细胞的促凋亡作用,降低SKOV3/DDP细胞对顺铂的耐药性,有效恢复SKOV3/DDP细胞顺铂敏感性。
[关键词] EDD;卵巢癌;顺铂耐药;细胞凋亡
[中图分类号] R737.31 [文献标识码] A [文章编号] 1673-7210(2015)09(b)-0020-05
卵巢癌是最常见的妇科恶性肿瘤之一,其最主要的治疗策略是肿瘤细胞减灭术联合铂类药物为基础的化疗法,然而铂类耐药的形成是目前肿瘤治疗过程中的主要障碍之一,因此,研究卵巢癌细胞的耐药机制对卵巢癌提供新的治疗方法具有十分重要的作用。E3泛素连接酶(E3 isolated by differential display,EDD)包括一个羟基末端的连接酶(HECT)泛素连接酶域,是果蝇肿瘤抑制因子hyd的人同源因子[1],位于染色体8q22.3上,这个染色体区域通常与顺铂耐药具有一定的联系[2]。EDD在卵巢癌、乳腺癌和胃癌中均存在过表达的现象[3-6],高表达的EDD蛋白可作用于钙整合素结合蛋白1和细胞周期检测点激酶2(checkpoint kinase 2,CHK2),上调DNA损伤通路相关基因的表达,增强DNA损伤修复能力,增加顺铂等化疗药物的耐药性[7-9],DNA损伤通路的大部分基因与铂类等化疗药物敏感性降低之间有一定的联系[10]。本研究旨在通过转染EDD-siRNA沉默EDD在耐药细胞SKOV3/DDP的表达,探讨EDD的表达在卵巢癌顺铂耐药形成过程中的作用,并初步探索其相关机制,以期为恢复卵巢癌的顺铂敏感性提供理论基础,为卵巢癌的治疗提供有力的线索。
1 材料与方法
1.1 细胞及主要试剂
SKOV3、SKOV3/DDP(北京肿瘤医院药物研究所);胎牛血清(FBS)、RPMI 1640(美国Gibco);四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)和胰蛋白酶(美国Sigma);顺铂(齐鲁制药有限公司);RNA提取试剂盒(美国Invitrogen);逆转录试剂盒[宝生物工程(大连)有限公司];SsoFastTM EvaGreen Supermix (BIO-RAD);RIPA细胞裂解液及BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);EDD抗体、2CHK2抗体、髓样细胞白血病-1(Mcl-1)抗体和兔抗β-actin抗体(上海艾碧康生物制品有限公司);Lipofectamine RNAiMAX转染试剂(美国Invitrogen);EDD-siRNA(5'-CCAUUUACCCUGGCUAGUA-3',美国Sigma-Aldrich);非特异性siRNA序列(5'-CUGGAGUUGUCCCAAUUCU-3',Ambion);细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)。
1.2 细胞培养
将SKOV3和SKOV3/DDP细胞各5×104个培养在含10% FBS的RPMI 1640培养基中,在37℃ 5%CO2的饱和湿度条件下培养。每3天传代1次,取对数生长期细胞进行相关实验。
1.3 RNA干扰
siRNA转染SKOV3/DDP细胞步骤按照Lipofectamine RNAiMAX转染试剂说明书进行。转染后培养24 h,实验分为4组细胞:SKOV3细胞,SKOV3/DDP细胞,SKOV3/DDP细胞+非特异性siRNA(NC siRNA)和SKOV3/DDP细胞+EDD-siRNA。
1.4 RT-PCR检测EDD mRNA的表达
按试剂盒说明提取细胞中RNA并进行逆转录和PCR扩增。EDD mRNA上游引物:5'-TTAGGCTTTTGGTAAATGGCTGCG-3',下游引物:5'-TGAGGGCATAGGCTGGAATCCTTC-3'。内参GAPDH上游引物:5'-ACCACAGTCCATGCCATCAC-3',下游引物:5'-TCCACCACCCTGTTGCTGTA-3'。PCR扩增反应体系(10 μL)为:上下游引物各2 μL,5 μL SsoFastTM EvaGreen Supermix,1 μL cDNA;反应条件:94℃ 4 min,94℃ 20 s,55℃ 30 s,72℃ 20 s,共35个循环,72℃ 10 min。PCR产物经1.5%琼脂糖电泳鉴定。试验重复3次,每次5个复孔。
1.5 Western blotting检测蛋白表达
提取细胞蛋白并测量蛋白浓度,Western blot检测EDD、CHK2以及Mcl-1蛋白表达。以β-actin为内参,每组上样量50 μg,一抗(1∶400稀释)温室孵育2 h,二抗(1∶2000稀释)孵育1.5 h,DAB显色,暗室曝光。试验重复3次,每次5个复孔。
1.6 MTT检测SKOV3/DDP细胞顺铂半数抑制浓度(IC50)的变化
取对数生长期细胞进行培养,分别加入终浓度为0(对照组)、4、8、12、16、20、24、28、32、36、40 μg/mL的顺铂培养基培养48 h,每孔加入20 μL 5 mg/mL MTT后培养4 h,弃上清液并在每孔加入200 μL DMSO,振荡10 min使其充分溶解后,酶标仪上测定OD490值。抑制率=(对照组OD值-用药组OD值)/对照组OD值×100%,Logistic回归法计算IC50。相对逆转效率=[IC50(SKOV3/DDP)-IC50(SKOV3+EDD-siRNA)]/[IC50(SKOV3/DDP)-IC50(SKOV3)]×100%。试验重复3次,每次5个复孔。
1.7细胞凋亡检测
20 μg/mL的顺铂处理各组细胞24 h,流式细胞仪检测细胞凋亡率。细胞凋亡的检测参照细胞凋亡试剂盒说明书进行。收集5×105个细胞,加入500 μL结合缓冲液悬浮细胞,分别加入5 μL Annexin V-FITC和5 μL PI,混匀后室温避光反应15 min,上机进行检测。试验重复3次,每次5个复孔。
1.8 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用LSD-t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 EDD在SKOV3和SKOV3/DDP细胞中的表达
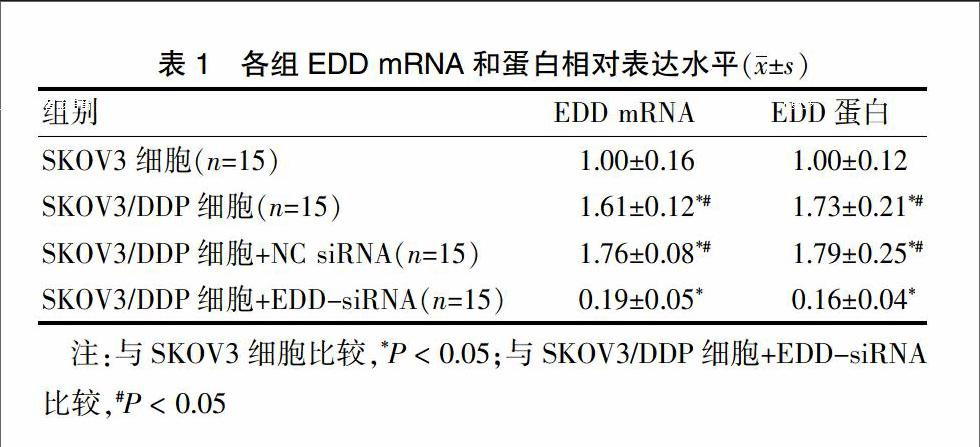
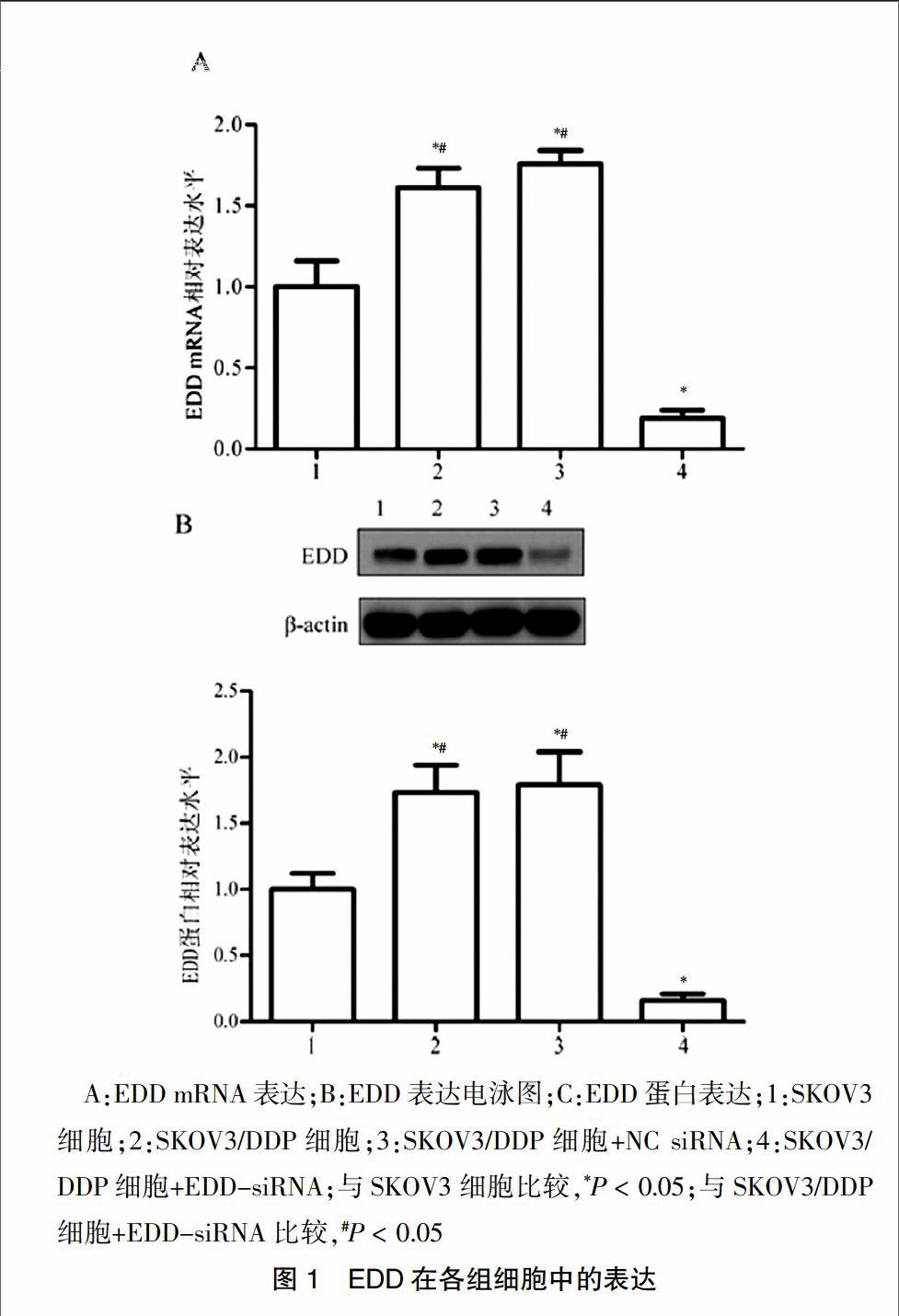
EDD基因和蛋白表达水平如图1所示,SKOV3细胞中EDD基因与蛋白表达水平均显著低于耐药细胞SKOV3/DDP(P < 0.05);EDD-siRNA处理24 h后,EDD mRNA表达水平显著降低(P < 0.05)。Western blot结果显示EDD-siRNA显著抑制了SKOV3/DDP细胞中EDD蛋白的表达(P < 0.05),而NC siRNA对EDD mRNA和蛋白表达水平均无影响(P > 0.05)。见表1。
A:EDD mRNA表达;B:EDD表达电泳图;C:EDD蛋白表达;1:SKOV3细胞;2:SKOV3/DDP细胞;3:SKOV3/DDP细胞+NC siRNA;4:SKOV3/DDP细胞+EDD-siRNA;与SKOV3细胞比较,*P < 0.05;与SKOV3/DDP细胞+EDD-siRNA比较,#P < 0.05
2.2 EDD-siRNA对SKOV3/DDP细胞顺铂耐药指数的影响
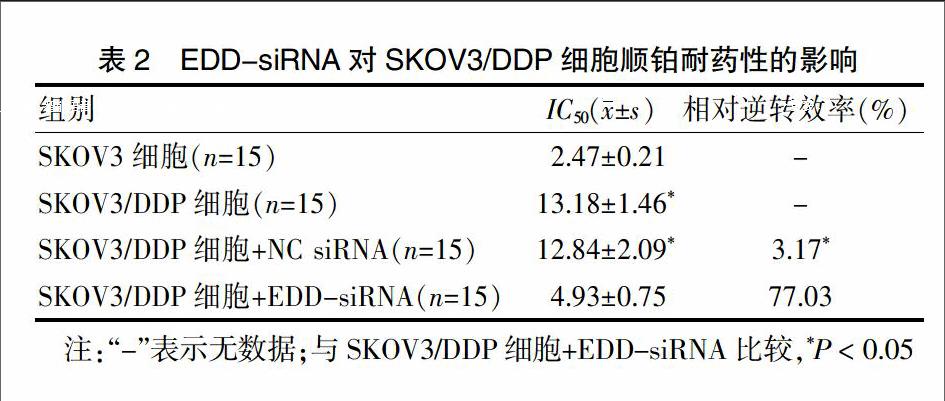
MTT检测细胞顺铂耐药结果显示,EDD-siRNA显著降低了SKOV3/DDP细胞的IC50值[(4.93±0.75)比(13.18±1.46),P < 0.05],对顺铂耐药的逆转效率高达77.03%,表明EDD-siRNA降低了SKOV3/DDP细胞对顺铂的耐药性(P < 0.05)。见表2。
2.3 EDD-siRNA对顺铂诱导SKOV3/DDP细胞凋亡的影响
为了研究顺铂对细胞凋亡的影响,本试验用20 μg/mL的顺铂作用细胞后,采用Annexin Ⅴ-FITC/PI双染法检测了细胞的凋亡率。结果显示(图2),转染EDD-siRNA使细胞凋亡率从(5.00±1.10)%上升到(40.12±3.78)%,显著增强了顺铂对SKOV3/DDP细胞的凋亡诱导作用(P < 0.05)。
2.4 沉默EDD对SKOV3/DDP细胞CHK2和Mcl-1蛋白表达的影响
为检测沉默SKOV3/DDP细胞中EDD的表达对CHK2和Mcl-1蛋白的影响,在成功转染EDD-siRNA后,用Western blotting检测了各组细胞中CHK2和Mcl-1蛋白表达水平(图3)。结果显示,EDD-siRNA使EDD沉默后,Mcl-1蛋白的表达被显著抑制(P < 0.05),而CHK2蛋白未检测到明显差异(P > 0.05)。见表3。
3 讨论
随着对肿瘤研究的深入,肿瘤治疗过程中细胞的化疗耐药越来越被重视。研究表明,EDD mRNA在化疗后卡铂耐药性卵巢癌细胞[11-12]和顺铂耐药黑素瘤细胞中[13]表达水平均升高,提示EDD在肿瘤细胞顺铂耐药性中具有一定的作用。本试验检测了顺铂耐药细胞SKOV3/DPP和非耐药细胞SKOV3细胞中EDD的表达水平,结果发现,无论是在mRNA水平还是蛋白水平,SKOV3/DDP细胞中EDD表达水平均显著高于SKOV3细胞,表明EDD可能是卵巢癌细胞顺铂耐药形成的相关因子。
为进一步明确EDD与卵巢癌细胞顺铂耐药性的相关性,本研究用EDD-siRNA转染SKOV3/DDP细胞沉默EDD表达后,对细胞的顺铂耐药指数进行了检测,结果发现使EDD基因表达沉默后,SKOV3/DDP细胞对顺铂的耐药性性显著降低,对顺铂耐药的逆转效率高达77%。O'Brien等[7]研究发现,沉默对顺铂高度耐药的卵巢癌细胞A2780-CP70中EDD的表达后,其对顺铂的敏感性增加。Bradley等[14]的研究也发现A2780ip2和OVCAR5 EDD shRNA细胞的顺铂敏感性显著高于对照组。以上结果表明EDD在卵巢癌细胞顺铂耐药的形成过程中担任着重要的角色,进一步了解EDD影响卵巢癌细胞的顺铂耐药机制,对于卵巢癌的临床治疗将具有十分重要的意义。
顺铂作为抗肿瘤药物的主要原因之一是其具有诱导肿瘤细胞凋亡的效力,用合适的手段刺激耐药细胞凋亡,或调控促凋亡相关基因的表达,是恢复肿瘤细胞敏感性的一个重要方法。本试验中,流式细胞仪的检测结果显示,通过转染EDD-siRNA沉默EDD表达后,其细胞凋亡率显著升高,表明转染EDD-siRNA恢复了顺铂对SKOV3/DDP细胞的抗肿瘤作用。抗凋亡因子Mcl-1是顺铂作用的重要靶基因[15],其过高表达会使癌细胞对化疗产生抗性,甚至可能促进癌症的复发[16]。本研究结果发现,沉默EDD导致Mcl-1蛋白表达也同步下调,表明抗凋亡因子Mcl-1与EDD对于调节SKOV3/DDP细胞顺铂耐药可能具有一定的协同作用。
肿瘤化疗过程中产生顺铂耐药的机制之一就是DNA损伤细胞周期检查点通路的激活[17]。CHK2在DNA复制-监测S/G2检查点系统中具有十分重要的作用[18],越来越多的研究发现CHK2与肿瘤细胞的顺铂耐药具有一定的相关性[19-20]。EDD与细胞检查点激酶CHK2之间可相互影响[8]。为找出通过沉默EDD基因表达提高肿瘤细胞顺铂敏感性,是否对EDD和CHK2的结合有直接的影响,本试验通过Western blotting检测了EDD-siRNA处理后的卵巢癌耐药细胞中CHK2蛋白水平,结果发现,siRNA使EDD沉默后,CHK2蛋白的表达并无明显差异,其相关机制有待进一步的研究。
综上所述,EDD-siRNA转染可成功地抑制SKOV3/DDP耐药细胞EDD和Mcl-1蛋白的表达,增加顺铂对SKOV3/DDP细胞的凋亡刺激作用,恢复卵巢癌耐药细胞的顺铂敏感性。因此,本试验结果为EDD作为卵巢癌增敏治疗的靶基因提供了理论证据。
[参考文献]
[1] Callaghan MJ,Russell AJ,Woollatt E,et al. Identification of a human HECT family protein with homology to the Drosophila tumor suppressor gene hyperplastic discs [J]. Oncogene,1998,17(26):3479-3491.
[2] Wasenius VM,Jekunen A,Monni O,et al. Comparative genomic hybridization analysis of chromosomal changes occurring during development of acquired resistance to cisplatin in human ovarian carcinoma cells [J]. Genes Chromosomes Cancer,1997,18(4):286-291.
[3] Fuja TJ,Lin F,Osann KE,et al. Somatic mutations and altered expression of the candidate tumor suppressors CSNK1 epsilon,DLG1,and EDD/hHYD in mammary ductal carcinoma [J]. Cancer Res,2004,64(3):942-951.
[4] Clancy JL,Henderson MJ,Russell AJ,et al. EDD,the human orthologue of the hyperplastic discs tumour suppressor gene,is amplified and overexpressed in cancer [J]. Oncogene,2003,22(32):5070-5081.
[5] Mori Y,Sato F,Selaru FM,et al. Instabilotyping reveals unique mutational spectra in microsatellite-unstable gastric cancers [J]. Cancer Res,2002,62(13):3641-3645.
[6] Ziebarth A,Zheng H,Bradley A,et al. The ubiquitin ligase EDD mediates platinum resistance and is a target for therapy in epithelial ovarian cancer [J]. Gynecol Oncol,2011,130(120):S26-S27.
[7] O'Brien PM,Davies MJ,Scurry JP,et al. The E3 ubiquitin ligase EDD is an adverse prognostic factor for serous epithelial ovarian cancer and modulates cisplatin resistance in vitro [J]. Br J Cancer,2008,98(6):1085-1093.
[8] Henderson MJ,Munoz MA,Saunders DN,et al. EDD mediates DNA damage-induced activation of CHK2 [J]. J Biol Chem,2006,281(52):39990-40000.
[9] Bohgaki M,Hakem A,Halaby M,et al. The E3 ligase PIRH2 polyubiquitylates CHK2 and regulates its turnover [J]. Cell Death & Differentiation,2013,20(6):812-822.
[10] O'Grady S,Finn SP,Cuffe S,et al. The role of DNA repair pathways in cisplatin resistant lung cancer [J]. Cancer Treat Rev,2014,40(10):1161-1170.
[11] Peters D,Freund J,Ochs RL. Genome-wide transcriptional analysis of carboplatin response in chemosensitive and chemoresistant ovarian cancer cells [J]. Mol Cancer Ther,2005,4(10):1605-1616.
[12] Davidson B,Tropé CG. Ovarian cancer:diagnostic,biological and prognostic aspects [J]. Women's Health,2014,10(5):519-533.
[13] Gy■rffy B,Serra V,Materna V,et al. Analysis of gene expression profiles in melanoma cells with acquired resistance against antineoplastic drugs [J]. Melanoma Res,2006,16(2):147-155.
[14] Bradley A,Zheng H,Ziebarth A,et al. EDD enhances cell survival and cisplatin resistance and is a therapeutic target for epithelial ovarian cancer [J]. Carcinogenesis,2014,35(5):1100-1109.
[15] Yang C,Kaushal V,Shah SV,et al. Mcl-1 is downregulated in cisplatin-induced apoptosis,and proteasome inhibitors restore Mcl-1 and promote survival in renal tubular epithelial cells [J]. Am J Physiol,2007,292(6):F1710-F1717.
[16] Schwickart M,Huang X,Lill JR,et al. Deubiquitinase USP9X stabilizes MCL1 and promotes tumour cell survival [J]. Nature,2009,463(7277):103-107.
[17] Galluzzi L,Senovilla L,Vitale I,et al. Molecular mechanisms of cisplatin resistance [J]. Oncogene,2011,31(15):1869-1883.
[18] Liang X,Mueller MD,Yu JJ. Activation of checkpoint kinase Chk2 by cisplatin and its role in cisplatin resistance [J]. Cancer Research,2010,70(8 Suppl):2982.
[19] Alkema N,Tomar T,van der Zee A,et al. Checkpoint kinase 2 (Chk2) supports sensitivity to platinum-based treatment in high grade serous ovarian cancer [J]. Gynecol Oncol,2014,133(3):591-598.
[20] Usanova S,Piée-Staffa A,Sied U,et al. Cisplatin sensitivity of testis tumour cells is due to deficiency in interstrand-crosslink repair and low ERCC1-XPF expression [J]. Mol Cancer,2010,9(248):19.
(收稿日期:2015-05-14 本文编辑:任 念)
