路易斯酸催化下不对称烯反应的研究进展
2015-10-13汪丹杰项斌
汪丹杰,项斌
路易斯酸催化下不对称烯反应的研究进展
汪丹杰,项斌*
(浙江工业大学化学工程学院,浙江杭州310032)
烯反应是一类有效构建碳碳键、碳杂键的方法,特别是对不活泼的烯烃。它是由一个含有重键的化合物作为亲烯体和一个含有烯丙基氢的烯烃作为烯组分的加成反应。本文将按照亲烯体的分类分为全碳化合物、氮杂化合物、氧杂化合物等进行综述。
路易斯酸;不对称;烯反应
0 前言
烯反应是一种有效的构建C-C键的方法,特别是对不活泼的烯烃。因此烯反应是一种可以作为一种有效的合成方法合成各种具有重要作用的有机分子例如:樟脑、红蛾的雌性激素中间体和具有抗生活性的8-羟基-5,6-辛二烯酸甲酯[1]。
烯反应是Alder在1943年首次提出,又称Alder-烯反应,它由一个含有重键的缺电子化合物如亚胺、羰基等和一个含有烯丙基氢的烯烃通过六元环过渡态并且将双键移至原烯丙基位置和1,5-氢迁移有效构建碳碳键的方法[2](Eq.1)。
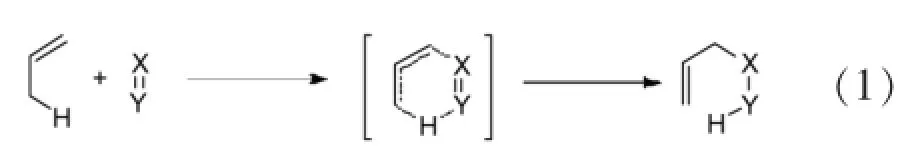
由于简单的烯反应的活化能较高,需要在较高的温度下进行反应,这也限制了烯反应的机理研究和在合成上的应用。直到近40年路易斯酸催化烯反应的研究以及多种类型活泼亲烯体的发掘,才使得烯反应在有机合成中,特别是不对称合成显示它应有的地位。下面按全碳化合物、氮杂化合物、氧杂化合物等进行综述。
1 亲烯体为全碳化合物的反应
亲烯体是全碳的不对称烯反应的研究较多,这里将从分子内反应和分子间反应的两方面进行介绍。
1.1分子内的烯反应
1.1.11,6-烯炔的分子内烯反应
在2000年之前人们对于消旋的烯反应合成环状化合物的研究较多,近年来对于不对称烯反应研究较多。2000年张绪穆小组[3]报道了含杂原子的1,6-烯炔的分子内反应。该反应实现了一系列1,6-烯炔的分子内烯反应并且得到高对映选择性。这是第一例烯炔的具有高对映选择性的环异构化反应,但是对于底物的适用性较窄(Eq. 2)。

2002年张绪穆课题组[4]将这一反应的氧杂的底物进行了进一步的扩展(Eq.3)。

2001年Mikami课题组[5]报道了含氧原子的1,6-烯炔的分子内反应。其最优体系是用Pd(OCOCF3)2和SEGPHOS得到一个ee>99%的季碳手性中心(Eq.4)。

2005年Mikami课题组[6]使用了tropos TE TRAPHOS-Rh络合物催化这个反应,这个配体不仅可以从轴向控制还可以从螺旋形控制手性(Eq. 5)。

1.1.21,7-烯炔的分子内烯反应
2003年Mikami课题组[7]报道了通过1,7-烯炔的不对称烯反应合成喹啉衍生物。这是第一次用烯反应来合成六元环化合物并且具有高的收率和ee(Eq.6)。

2008年Nishibayashi小组[8]用Rh催化分子内环化反应。该反应可以合成一系列具有光学活性的杂环如二氢苯并呋喃、色烷、1,2,3,4-四氢化喹啉衍生物(Eq.7)。

1.2分子间烯反应
2006年Hayashi课题组[9]第一次报道了分子间的不对烯反应。他们用α,β-二烯醛和环戊二烯,采用了二苯基脯硅醚催化反应,使其进行烯反应而不是Diels-Alder reaction。最后得到产物具有82:18的异构化和95%的ee(Eq.8)。

2 亲烯体为氧杂化合物的反应
近年来对于氧杂烯反应研究较多,这里我们将它们分成分子间乙醛酸酯烯反应、分子间非乙醛酸酯烯反应和分子内羰基烯反应两方面进行介绍。
2.2.1分子间乙醛酸酯烯反应
1989年Mikami课题组[10]在4Å分子筛存在下与二氯甲烷中搅拌(i-PrO2)TiX2(X=Cl或Br)和BINOL作用,生成配合物,该催化剂不经过分离直接应用于乙醛酸酯的烯反应,取得较好的ee(Eq.9)。

2003年丁奎岭小组[11]用低催化量的BINOLTi催化乙醛酸酯和一系列烯烃为底物。该反应是第一个用无溶剂法的烯反应,从而得到高收率和ee的α-羟基酯(Eq.10)。
BINOL配体类催化剂发展迅速,但该类催化剂只能催化1,1-二取代烯烃,而对其他烯烃如单取代烯烃的催化效果不佳。于是人们开始寻找一类对各种烯烃均有效的催化剂。
2006年Singh小组[12]用双恶唑膦和铜催化乙醛酸酯的烯反应。最后得到了高达99%的ee的结果。该反应用了两种配体得到了高的ee,但是其构型相反(Eq.11)。

2012年Kim课题组[13]实现了α-甲基苯乙烯和乙醛酸为底物的烯反应并得到高收率和ee的结果。该反应用疏水性的离子液体作为溶剂并且证明离子液体对反应结果影响很大,同时该反应的催化剂-配体可以反复使用8次(Eq.12)。

2000年Mikami课题组[14]实现了酮和活性较低的单取代和1,2-二取代的烯烃能够发生反应,最后得到高对映选择性和ee的产物(Eq.13)。

2007年Rawal课题组[15]用了一系列1,1-二取代的烯烃和乙醛酸乙酯反应得到了高的收率和ee。该反应采用了一种新的钴-席夫碱络合物催化反应,同时该反应的条件十分的理想,只需要0.1 mol%的催化剂在室温下反应(Eq.14)。

2.2.2分子间非Glyoxylate-Ene反应
1996年Makami小组[16]实现了环状的烯烃和三氟甲醛的不对称烯反应。其产物具有重要的生物和合成意义(Eq.15)。

2002年Jacobsen小组[17]用三齿席夫碱铬衍生物催化芳醛和富电子烯烃,得到较高收率和ee。2003年Jacobsen小组扩展了底物,得到的结果较好(Eq.16)。

2.2.3分子内羰基烯反应
2003年Zhu课题组[18]实现了α-酮酸酯的分子内烯反应。最后得到高收率和ee的五元环产物(Eq.17)。

2010年Loh课题组[19]以Sc(OTf)2和Pybox体系催化这个反应。这是第一例α-酮酸酯和阳离子烯烃发生环化反应(Eq.18)。


2013年Jacobsen课题组[20]用一种新的Cr(Ⅲ)三氟甲磺酸三齿的席夫碱络合物催化酮的烯反应。本文底物是以一个没有活化的酮为底物进行的跨环反应(Eq.19)。

3 亲烯体为氮杂化合物的反应
1998年Lectka小组[21]用Cu(ClO4)2和BINAP体系,最后得到94%的收率和99%的ee。这是第一例催化不对称亚氨基的反应得到氨基酸。2001年Lectka小组[28]进一步扩展了底物,用Cu(Ⅰ)和磷酸配体催化α-亚胺酯和烯醇硅烷、烯丙基硅烷和烯烃的反应,最后得到高的ee和收率(Eq. 20)。

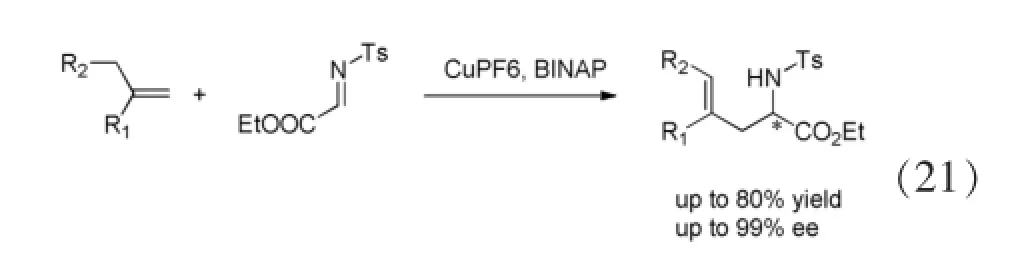
1998年Jorgensen小组[22]用手性的仅使用0.1 mol%的CuPF6-BINAP络合物体系。该方法可以合成具有光学活性的非自然界的α-氨基酸(Eq. 21)。
2006年Sorimachi小组[23]成功报道了N-苯甲酰亚胺和烯氨基甲酸酯的Ene反应。该反应用了极其少量的催化量而不影响ee(Eq.22)。

4 结论
本文主要介绍了在路易斯酸催化下含有烯丙基氢的烯烃与一系列亲烯体的不对称烯反应。通过筛选催化剂、活化亲烯体底物或是用负电子烯组分等方法实现了亚胺、羰基、烯炔的不对称烯反应。但是仍然有一些难题尚未解决,如烯烃作为亲烯体的烯反应、醛亚胺的烯反应等。
[1]潘斌,王慧.烯反应及其在有机合成中的应用[J].南昌高专学报,2003,49(2):66-67.
[2]张建恒,黄志镗.杂原子烯反应研究进展[J].化学进展,1999,11(2):129-138.
[3]Cao P,Zhang X M.The first highly enantioselective Rhcatalyzed enyne cycloisomerization[J].Angew.Chem.Int.Ed,2000,39:4104-4106.
[4]a)Lei A W,Zhang X M.Highly enantioselective Rh-catalyzedintromaolecular alder-ene reactions for the syntheses of chiral tetrahydrofurans[J].Angew.Chem.Int.Ed,2002,41:3457-3460.b)Lei A W,Zhang X M.Highly enantioselective syntheses of functionalizedα-methylene-butyrolactones via Rh(Ⅰ)catalysted intramolecular Alder-Ene reactions:application to formal synthesis of(+)-pilocarpine[J].J.Am.Chem.Soc,2002,124:8198-8199.
[5]Hatano M,Mikami K.Highly enantioselective palladiumcatalyzed ene-type cyclization of a 1,6-enyne[J].Angew. Chem.Int.Ed,2001,40:249-253.
[6]Mikami K,Aikawa K,et al.Troops or atropos nature of rhodium complexes bearing a tetrakis(phosphany)terphenyl ligand:highly enantioselective catalysis of ene-type cyclization[J].Org.Lett,2005(7):5777-5780.
[7]Hatano M,Mikami K.Highly enantioselective quinoline synthesis via ene-type cyclization of 1,7-enynes catalyzed by a cationic BINAP palladium(Ⅱ)complex[J].J.Am. Chem.Soc,2003,125:4704-4705.
[8]Fukamizu K,Nishibayashi K.Ruthenium-catalyzed enantioselective carbon-carbon bond form ing reaction via al-lenylidene-ene process:synthetic approach to chircal heterocycles such as chromane,thiochromane,and 1,2,3,4-tetrahydroquinoline derivatives[J].J.Am.Chem.Soc,2008,130:10498-10299.
[9]Gotoh H,Hayashi Y.Enantioselective ene reaction of cyclopentadiene andα,β-enals catalyzed by a diphenylproli nol silyl ether[J].Angew.Chem.Int.Ed,2006,45:6853-6856.
[10]Mikam i K,Nakai K.Asymmetric glyoxylate-ene reaction catalyzed by chiral titanium comp lexes:A practical access toα-hydroxy esters in high enantimeric purities[J].J.Am. Chem.Soc,1989,111:1940-1941.
[11]Yuan Y,Ding K L.Quasi solvent-free enantioselective carbonyl ene reaction with extremely low catalyst loading[J].Angew.Chem.Int.Ed,2003,42:5478-5480.
[12]Pandey M K,Singh V K,et al.Enantioselective turnover in glyoxylate-ene reactions catalyzed by chiral copper complexes[J].Tetrahedron Letters,2006,47:897-900.
[13]Kim M,Kim BM.Enhanced reactivity and enantioselectivity in catalytic glyoxylate-ene reactions using chircal bis(oxazoline)-copper complex in an ionic liquid[J].Tatrahedron:Asymmetry,2012,23:1019-1022.
[14]Hao J,Mikami K.Chircal palladium(Ⅱ)-catalyzed asymmetric glyoxylate-ene reaction:alternative approach to the enantioselective synthesis ofα-hydroxy esters[J].Org.Lett,2000,2:4059-4062.
[15]Hutson C E,Rawal V H.Highly enantioselective carbonyl-ene reactions catalyzed by a hindered sily-salencobalt complex[J].Org.Lett,2007,9:3869-3872.
[16]Mikami K,Maruta M.Asymmetric catalysis of carbonylene and aldol reactionswith fluoral by chircal binaphtholderived titanium complex[J].Tereahedron,1996,52:85-98.
[17]Ruck R T,Jacasben E N.Asymmetric catalysis of heteroene reactions with tridentate schiff base chromium(Ⅲ)comp lexes[J].J.Am.Chem.Soc,2012,124:2882-2883.
[18]Yang D,Yang M,Zhu N Y.Chiral lewis acid-catalyzed enantioselective intramolecular carbonyl ene reactions of unsaturatedα-keto esters[J].Org.Lett,2003,5:3749-3752.
[19]Zhao Y J,Loh T P.Enantioselective cationic polyene cyclization vs enantioselective intramolecular carbonyl-ene reaction[J].J.Am.Chem.Soc,2010,132:10242-10244.
[20]Rajapaksa N S,Jacobsen N E Enantioselective catalytic transannular ketone-ene reactions[J].Org.Lett,2013,15:4238-4241.
[21]Ferraris D,Dudding T.Catalytic,enantioselective alkylation ofα-imino esters:the synthesis of nonnaturalα-imino esters derivatives[J].J.Am.Chem.Soc,2002,124:67-77.
[22]Yao S,Jorgensen K A.Catalytic,enantioselective ene reactions of imines:a simple approach for the formation of optically activeα-Imino acids[J].Chem Commun,1998,34:2547-2548.
[23]Terada M,Sorimacji K.High substrate/catalystorganocatalysis by a chiral bronsted acid for an enanthioselective azaene-type reaction[J].Angew.Chem.Int.Ed,2005,45:2254-2257.
Advances of Lew is Acid-catalyzed Asymmetric Ene Reaction
WANG Dan-jie,XIANG Bin*
(College of Chemical Engineering,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Ene reaction is a highly efficientmethod to construct carbon-carbon bond and carbon-hetero bond,especially for unactive alkene.It is an addition reaction composed of a containingmultiple bonds compounds as enophile and a containing allylic hydrogen compound as ene component.This article summarized the classification under the enophile was divided into all-carbon compounds,aza compounds,oxygen compounds.
lewis acid;asymmetric;ene reaction
1006-4184(2015)6-0039-05
2015-01-21
汪丹杰(1989-),男,浙江宁波人,硕士研究生,主要研究方向:有机合成。E-mail:834255300@qq.com。
