醋糟栽培对杏鲍菇胞外酶活性的影响
2015-10-09杨曼曼等
杨曼曼等


摘要:以醋糟为主料栽培杏鲍菇(Pleurotus eryngii Quei),并在其生长发育的不同阶段测定了8种胞外酶的活性。结果表明,以醋糟为主料栽培杏鲍菇头潮菇生物学效率可达80.8%;其纤维素酶系完整,β-葡萄糖苷酶、HC酶、CMC酶、FP酶、淀粉酶和果胶酶的活性在子实体生长发育时期较高,在幼菇期均出现峰值;漆酶和过氧化物酶在菌丝满袋期活性出现峰值,随后呈下降趋势,过氧化物酶活性迅速下降,幼菇期和成熟期酶活性消失。
关键词:醋糟;杏鲍菇(Pleurotus eryngii Quei);生物学效率;胞外酶
中图分类号:S646.1+9;S816.46 文献标识码:A 文章编号:0439-8114(2015)17-4214-03
DOI:10.14088/j.cnki.issn0439-8114.2015.17.027
醋糟是固态发酵法酿造食醋过程中所产生的下脚料,其中含有大量的粗蛋白质、粗纤维及矿物质等成分[1],有较高的利用价值。目前,醋糟主要用于生产饲料[2]、有机肥[3]及植物无土栽培基质[4,5],尚不能被充分利用,迫切需要进一步挖掘其应用潜力。为提高醋糟的综合利用率,近年已有学者利用醋糟栽培食用菌做了一些研究[6]。为此,以醋糟为主料栽培杏鲍菇(Pleurotus eryngii Quei),并测定了杏鲍菇各生长期的8种胞外酶活性,以期对醋糟栽培食用菌的理论基础进行探索。
1 材料与方法
1.1 材料
1)菌种。杏鲍菇由烟台大学应用微生物实验室提供。
2)试剂和材料。木聚糖、果胶、半乳糖醛酸和羧甲基纤维素钠均为Sigma公司生产,其他多为国产分析纯。醋糟为江苏镇江恒顺醋业提供,麦麸为市售。
3)醋糟培养基。培养基配方:醋糟78%,麦麸20%,石膏1%,蔗糖1%,料水比为1∶1.4(m∶V)。
1.2 方法
1)栽培方法。培养料按比例加水搅拌均匀后装入17 cm×33 cm的聚丙烯塑料袋,每袋折合干料400 g,121 ℃高压蒸汽灭菌1.5 h。接入原种约3 g,22 ℃恒温培养。菌丝满袋后移入温度为15~18 ℃,湿度为85%~95%的菇房开袋出菇,出菇管理按常规,试验只统计和测定了第一潮杏鲍菇的产量及胞外酶活性。
2)粗酶液制备方法。在杏鲍菇生长发育的不同阶段(半袋期、满袋期、原基期、幼菇期、成熟期),分别取3个菌袋,将培养物取出后,每袋多点取样2份,每份湿重7 g,然后把从3袋中取出的样品(21 g)混匀,共得2份样品。一份样品加100 mL超纯水,20 ℃浸提4 h,4层纱布过滤后,4 000 r/min离心10 min,上清液即为粗酶液;另一份样品在80 ℃恒温箱中烘至恒重,用于计算酶活力。
3)酶活性的测定方法。淀粉酶、果胶酶参照王玉万等[7]的方法;羧甲基纤维素酶(CMC)、滤纸纤维素酶(FP)参照Mandels等[8]的方法;β-葡萄糖苷酶、半纤维素酶(HC)、漆酶和过氧化物酶分别参照Sengupta等[9]、Shamala等[10]、潘迎捷等[11]和张志良等[12]的方法。
淀粉酶、CMC酶、β-葡萄糖苷酶和果胶酶的酶活力单位均为:1 U=1 mg葡萄糖/(30 min·g干培养物)。FP酶的酶活力单位为:1 U=1 mg葡萄糖/(60 min·g干培养物)。HC酶的酶活力单位为:1 U=1mg木糖/(30 min·g干培养物)。漆酶的酶活力单位为:1 g干培养物中的酶量每分钟使OD600 nm改变0.01为一个活力单位。过氧化物酶的酶活力单位为:1 g干培养物中的酶量每分钟使OD470 nm改变0.01为一个活力单位。
2 结果与分析
2.1 杏鲍菇在醋糟培养基中的菌丝生长速度及生物学效率
由试验数据统计分析得出,杏鲍菇在醋糟培养基中生长发育过程中菌丝生长速度为0.49 cm/d,第一潮杏鲍菇平均每袋产量为323.2 g,生物学效率达80.8%。
2.2 杏鲍菇在醋糟培养基中生长期间胞外CMC酶、FP酶和β-葡萄糖苷酶活性变化规律
从图1可以看出,在整个生长发育阶段杏鲍菇3种胞外酶活性大小为β-葡萄糖苷酶>FP酶>CMC酶,但它们的活性变化趋势大致相同,即在菌丝生长初期活性较低,满袋期后3种酶活性逐渐上升,同时在幼菇期出现最高酶活性峰值,随后进入成熟期的过程中酶活性显著下降。
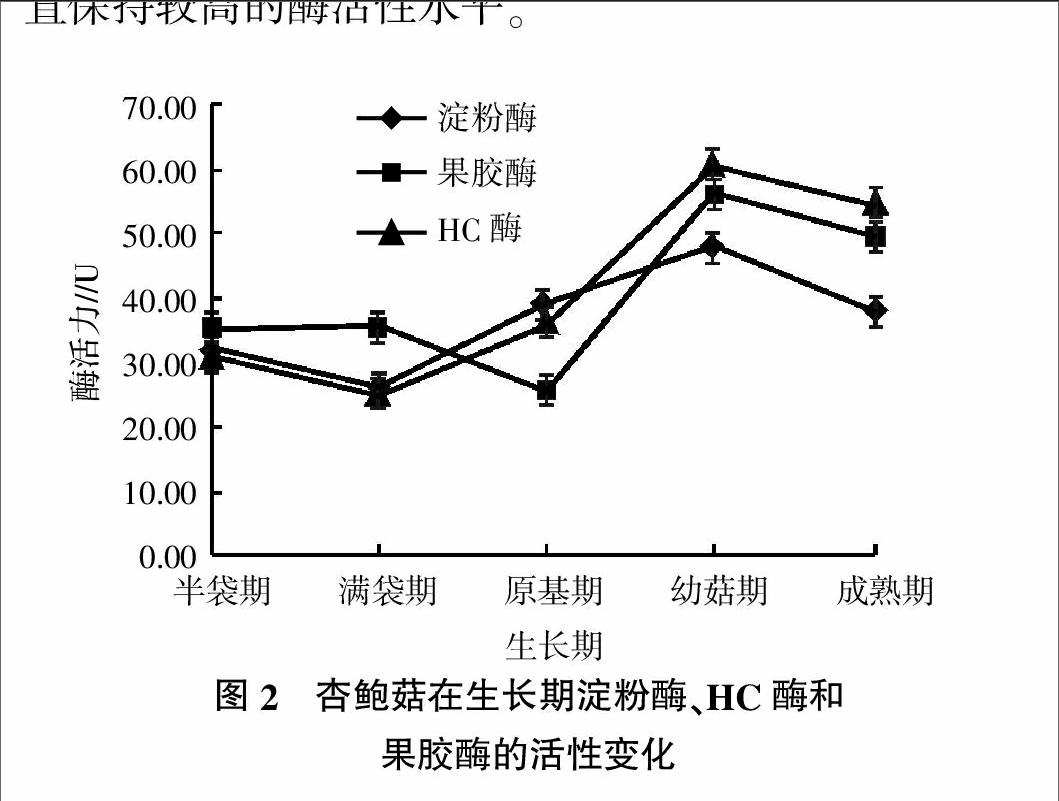
2.3 杏鲍菇在醋糟培养基中生长期间胞外HC酶、淀粉酶和果胶酶活性变化规律
由图2显示,在菌丝生长的最初阶段,杏鲍菇淀粉酶、果胶酶和HC酶活性较低,HC酶和淀粉酶活性在菌丝满袋时期出现最低点,果胶酶活性在原基时期出现最低点,随后3种酶活性迅速增长,并同时在幼菇期出现峰值,随着生长培养基的降解,3种酶活性虽略有下降,但在子实体成熟过程中一直保持较高的酶活性水平。
2.4 杏鲍菇在醋糟培养基中生长期间胞外漆酶和过氧化物酶活性变化规律
由图3得知,漆酶和过氧化物酶活性在菌丝生长的初期阶段持续增长,在满袋期和原基期一直维持在较高水平。原基形成后,漆酶酶活性呈下降趋势;过氧化物酶活性迅速下降,幼菇期和成熟期酶活下降为0。
3 小结与讨论
以醋糟为主料栽培杏鲍菇过程中可测得8种胞外酶活性,由此可推测杏鲍菇能分解利用醋糟中的纤维素、半纤维素、木质素和淀粉等大分子碳源营养物质。杏鲍菇在菌丝生长期间胞外纤维素酶系(CMC酶、β-葡萄糖苷酶和FP酶)、淀粉酶、HC酶和果胶酶变化较平稳,在生殖生长阶段都有所提高,到幼菇期达到了顶峰。这说明杏鲍菇子实体发育阶段需大量分解纤维素、半纤维素、淀粉等物质以满足其生殖生长和子实体形成的需要,这与其同属的金顶侧耳(P. citrinopileatus)[13]较相似。漆酶和过氧化物酶均属于降解木质素的酶类[14],由两种酶活性变化趋势可推断,木质素的降解速率与杏鲍菇在醋糟中各生长期相对应,菌丝生长初期木质素降解速率较快,原基形成后降解速率下降。漆酶降解木质素的组分所占比重较大[15],原基形成后过氧化物酶活性消失,但是木质素降解仍在进行。总体来说,木质素的降解随杏鲍菇培养时间的增长而降低,这与巴西蘑菇(Agaricus blazei)[16]和金顶侧耳(P. citrinopileatus)[13]等的情况相似。
由以上结果得出结论,以醋糟为主料栽培杏鲍菇是可行的,并且第一潮菇生物学效率可达80.8%。下一步可结合木质纤维素降解转化的试验添加其他辅料,进一步优化其配方以提高生物学效率。
参考文献:
[1] 杨致玲,李建英,张拴林.微生物发酵可提高醋糟营养价值[J].中国饲料,1999(6):24.
[2] 宋曾廷,董晓芳,佟建明,等.醋糟的营养价值及其在饲料生产中的应用[J].中国畜牧杂志,2011(11):73-76.
[3] 禹兰景,郭伟珍,王彦芝,等.城市污泥与树皮、秸秆、醋糠混合堆肥研究[J].河北林果研究,2008,23(3):271-275.
[4] 李萍萍,胡永光,赵玉国,等.利用醋糟开发植物栽培基质的发酵技术[J].城市环境与城市生态,2003,16(4):79-80.
[5] HAN D S, NIIMI Y, TAKASHIMA T. Effect of using brown ricevinegar and brown rice vinegar lees composts during raisingseedling on growth of seedlings and field plants in cucumber[J].Bulletin Faculty Agricul Niigata University,2007,60(1):27-31.
[6] 周永治.利用醋糟培养食用菌的研究[J].江苏调味副食品,2011(28):24-26.
[7] 王玉万,王 云.构菌栽培过程中对木质纤维素的降解和几种多糖分解酶的活性变化[J].微生物学通报,1989,16(3):137-140.
[8] MANDELS M, HONTZ L, NYSTROM J, et al. Enzymatic hydrolysis of waste cellulase[J].Biotechnol Bioeng,1974,16:1471-1493.
[9] SENGUPTA S, SENGUPTA S. β-Glucosidase production by the mycelial culture of the mushroom Termitomyces clypeatus[J]. Enzyme and Microbial Technology, 1990,12(4):309-314.
[10] SHAMALA T R, SREEKANTIAH K R. Production of cellulases and D-xylanase by some selected fungal isolases[J].Enzyme Microb Technol, 1986, 8(3):178-182.
[11] 潘迎捷,陈明杰,郑海歌,等.香菇和平菇生长发育中漆酶、酪氨酸酶和纤维素酶活性的变化[J].上海农业学报,1991,7(2):21-26.
[12] 张志良,瞿伟青.植物生理学实验指导[M]. 第二版. 北京:高等教育出版社,1990.
[13] 李 娟,倪新江,樊守金,等.金顶侧耳不同生长期几种胞外酶活性变化[J].吉林农业大学学报, 2006,28(6):619-622.
[14] 朱启忠,王宜磊.毛栓菌胞外漆酶的纯化及部分性质研究[J].生物技术,2000,10(2):22-27.
[15] ZHAO J, KWAN H S. Characterization, molecular cloning, and diferential expression analysis of Laccase genes from the edible mushroom, Lentinula edodes[J]. Appl Environ Microbol, 1999, 65(11):4908-4913.
[16] 杨立红,倪新江,黄清荣,等. 栽培基质对巴西蘑菇胞外酶活性的影响[J]. 吉林农业大学学报,2004,26(2):284-286,290.
