大赖草基因组DNA提取方法比较分析
2015-10-09寇小霞等
寇小霞等
摘要:为了研究不同提取方法对大赖草[Leymus racemosus (Lam.) Tzvel]基因组DNA提取质量的影响,以大赖草的嫩叶为材料,采用CTAB法、CTAB改良法、SDS法、SDS-CTAB法4种提取方法提取大赖草叶片基因组DNA,对提取的基因组DNA进行琼脂糖凝胶电泳及紫外分光光度计法检测,获得最佳大赖草DNA提取方法,并利用ISSR标记验证其质量。结果表明,改良的CTAB法提取的大赖草基因组DNA纯度较高、完整性较好,ISSR扩增条带清晰,多态性高。最终确定CTAB改良法为最佳提取方法,完全适合于进一步的分子生物学研究。
关键词:大赖草[Leymus racemosus (Lam.) Tzvel]; 基因组DNA;提取方法;CTAB 法;CTAB改良法;SDS法;SDS-CTAB法
中图分类号:Q78;S543+.9 文献标识码:A 文章编号:0439-8114(2015)17-4324-04
DOI:10.14088/j.cnki.issn0439-8114.2015.17.057
大赖草[Leymus racemosus (Lam.) Tzvel]又名巨大滨草、巨野麦,禾本科多年生根茎型草本。主要分布在新疆准噶尔盆地古尔班通古特沙漠沿额尔齐斯河两岸的沙丘上及俄罗斯东南部的一些沙漠中[1,2]。大赖草的耐风蚀、耐高温、耐严寒、耐沙埋、抗旱等较强的沙生适应特性及其强烈的克隆生长能力和密集的地上、地下构件等特征使其成为一种优良的固沙植物,对于增加荒漠地表的粗糙度、防风固沙等方面有重要的生态价值[3],是保护干旱荒漠化土地的重要生物屏障。然而,由于受自然和人类活动的长期作用,大赖草种群已严重退化成为濒危物种,迫切需要恢复与重建。因大赖草穗大、多花、茎秆强壮,具有抗干旱、寒冷、盐碱和多种病虫害等特点,国内外不少学者在小麦育种及转基因工作中对大赖草的优良种质进行了大量的应用[3-7],并将大赖草列为改良成多年生谷物或饲料候选物种。刘宇等[8]进行了多次野外调查,发现种子的初始萌发时间长,萌发速率低,虽然穗大、花多,异花受粉且具有自交不亲和性[9],可以产生种子,但其结实率并不高,种子产量仅为开花数量的25%左右,且自然生境中干旱少雨、水分缺少,导致种子萌发后易“闪苗”。这些因素导致大赖草有性繁殖更新率低[10]。目前对大赖草进行分子生物学研究的报道较少,特别是大赖草DNA提取相关的研究。基因组DNA的提取质量直接影响到后期的分子生物学试验结果,为使所得的DNA纯度高,断裂降解程度小、量足,在提取时应根据不同研究需要,保证其结构的相对完整性,尽量排除其他大分子成分如蛋白质、多糖等的污染[11]。目前植物基因组DNA提取常用的方法有CTAB法、SDS法、SDS-CTAB法、高盐低pH法等[12-15]。针对研究目的和试验材料的不同,提取植物基因组DNA的方法侧重点也不同,各有其优缺点。而获取高质量的DNA是进行限制性酶切、PCR扩增、分子杂交、遗传多样性分析以及基因组学等分子生物学研究的基础。因此,本研究拟通过不同的DNA提取方法比较,旨在获得提取质量较高的大赖草总DNA方法,以期为后续的分子生物学研究奠定一定的基础。
1 材料与方法
1.1 材料
供试材料大赖草于2013年5月采自新疆阿尔泰地区,用硅胶干燥,带回实验室备用。
DNA抽提缓冲液:①CTAB抽提缓冲液。100 mmol/L Tris-HCl(pH 8.0)、20 mmol/L EDTA (pH 8.0)、350 mmol/L NaCl、2% CTAB抽提缓冲液、2% β-巯基乙醇。②CTAB改良法抽提缓冲液。溶液Ⅰ:100 mmol/L Tris-HCl(pH 8.0)、2 mmol/L EDTA(PH 8.0)、14 mmol/L NaCl、0.35 mmol/L葡糖糖、PVP40;溶液Ⅱ:100 mmol/L Tris-HCl(pH 8.0)、20 mmol/L EDTA(pH 8.0)、1.4 mmol/L NaCl、2% CTAB、2% PVP40、0.1% VC。③SDS抽提缓冲液。100 mmol/L Tris-HCl(pH 8.0)、50 mmol/L EDTA(PH 8.0)、500 mmol/L NaCl、3% SDS、2% β-巯基乙醇。④SDS-CTAB抽提缓冲液:100 mmol/L Tris-HCl(pH 8.0)、50 mmol/L EDTA(pH 8.0)、500 mmol/L NaCl、20% SDS、40% PVP40。
试验所使用的试剂均为国产分析纯。Taq DNA聚合酶、Mg2+、dNTP等均购自北京鼎国昌盛生物技术有限公司;ISSR引物选用哥伦比亚大学公布的UBC815,由上海生工生物技术有限公司合成。
1.2 方法
1.2.1 DNA提取方法
1)CTAB法。称取0.02 g干燥的大赖草叶子置于液氮中速冻,用研钵磨成细粉。装入1.5 mL的Eppendorf管,迅速加入700 μL 65 ℃预热的CTAB抽提缓冲液,轻轻混匀,于65 ℃条件下保温10 min,4 ℃、12 000 r/min离心10 min。吸取上清液移入到新的1.5 mL Eppendorf管中,加入等体积的三氯甲烷/异戊醇(体积比为24∶1)混合溶液混匀2 min,4 ℃、12 000 r/min离心10 min。重复上一步骤。之后,吸取上清液移入到新管中,加入2倍体积预冷的无水乙醇,混匀,于- 20 ℃条件下静置10 min,4 ℃、10 000 r/min离心10 min,弃上清。用70%乙醇洗涤沉淀1次,待自然风干后,加入20 μL ddH2O溶解DNA,-20 ℃贮存备用。
2)CTAB改良法。称取0.02 g干燥的大赖草叶子置于液氮中速冻,用研钵磨成细粉。装入1.5 mL Eppendorf管,迅速加入700 μL溶液Ⅰ,2%β-巯基乙醇,剧烈振荡,4 ℃、12 000 r/min离心10 min。弃上清液,迅速加入700 μL溶液Ⅱ及2%β-巯基乙醇,轻轻混匀,65 ℃水浴50 min,期间摇动,4 ℃,12 000 r/min离心5 min。吸取上清液移入到新的1.5 mL Eppendorf管中,加入等体积的三氯甲烷/异戊醇(体积比为24∶1)混合溶液和200 μL 3 mol/L NaAc溶液,混匀2 min,4 ℃、12 000 r/min离心5 min。重复上一步骤。吸取上清液移入到新管中,加入2倍体积预冷的无水乙醇,混匀,于-20 ℃条件下静置20 min,4 ℃、10 000 r/min离心15 min,弃上清。用500 μL 75% 乙醇漂洗沉淀,短暂离心,待自然风干后,加入20 μL ddH2O溶解DNA,-20 ℃贮存备用。endprint
3)SDS法。称取0.02 g干燥的大赖草叶子置于液氮中速冻,用研钵磨成细粉。加入650 μL预热65 ℃的SDS抽提缓冲液混匀,65 ℃保温40 min,其间缓慢颠倒4次,取出,于-20 ℃条件下静置10 min,4 ℃、10 000 r/min离心10 min。吸取上清液移入到新的1.5 mL Eppendorf管中,加入等体积三氯甲烷/异戊醇(体积比为24∶1)混合溶液缓慢颠倒混匀2 min,4 ℃、10 000 r/min离心10 min。重复上述步骤1次。吸取上清液,加入2倍体积无水乙醇,于-20 ℃条件下静置20 min,4 ℃、12 000 r/min离心10 min,弃上清液。沉淀用70%乙醇洗涤2次,待自然风干后,沉淀加ddH2O溶解,-20 ℃贮存备用。
4)SDS-CTAB法。称取0.02 g干燥的大赖草叶子置于液氮中速冻,用研钵磨成细粉。加入600 μL预热65 ℃的SDS-CTAB抽提缓冲液,临时加80 μL 20% SDS以及150 μL 40% PVP混匀,65 ℃保温60 min,其间缓慢颠倒4次,然后于-20 ℃条件下静置10 min,4 ℃、12 000 r/min离心10 min。吸取上清液,加入等体积三氯甲烷/异戊醇(体积比为24∶1)混合溶液抽提,缓慢颠倒混匀至乳状,4 ℃、12 000 r/min离心10 min。重复上述步骤1次。加入2倍体积无水乙醇,于-20 ℃条件下静置20 min,4 ℃、12 000 r/min离心10 min,弃上清液。沉淀用70%乙醇洗涤2次,待自然风干后,加ddH2O溶解,-20 ℃贮存备用。
1.2.2 DNA的紫外分光光度法及琼脂糖凝胶电泳检测 用紫外分光光度计测定230、260、280 nm 的吸光度,根据OD260 nm/OD280 nm、OD260 nm/OD230 nm的比值判断纯度。吸取4 μL DNA,加1 μL上样缓冲液,在1.0%琼脂糖凝胶上进行电泳,电压80 V,电泳时间20 min,电泳结果经溴化乙锭染色液染色后,在凝胶成像系统中观察拍照,检测其完整性。
1.2.3 ISSR-PCR扩增产物检测 以所选取最佳的方法提取的DNA为模板进行ISSR-PCR检测。PCR反应体系为 25 μL,其中10×PCR Buffer 2.5 μL,10 mmol/L dNTPs 混合液 0.5 μL,10 mmol/L 引物 0.5 μL,2.5 U Taq DNA 聚合酶 0.5 μL,30 ng/μL DNA 1 μL, ddH2O 20 μL。扩增程序:94 ℃预变性 5 min;94 ℃变性30 s,53 ℃退火 45 s,72 ℃延长45 s,35个循环;72 ℃延伸7 min;4 ℃保存。用ISSR引物UBC815检验不同 DNA模板的 PCR 效果,产物在1.0%琼脂糖凝胶上进行电泳,电泳结果在EB染色液中染色,凝胶成像系统中观察。
2 结果与分析
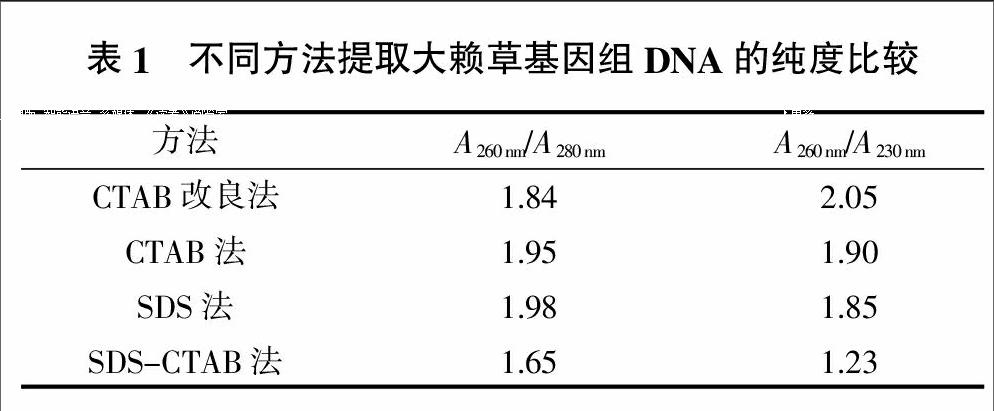
2.1 大赖草DNA样品的纯度鉴定
使用紫外分光光度计分别测定260、280、230 nm波长下4种方法所提DNA样品的吸光度,每个方法获取的样品测3次值,平均结果见表1。从表1可以看出,用CTAB改良法提取的DNA纯度较高、污染度低,为下一步进行大批量提取大赖草基因组DNA奠定一定的基础。
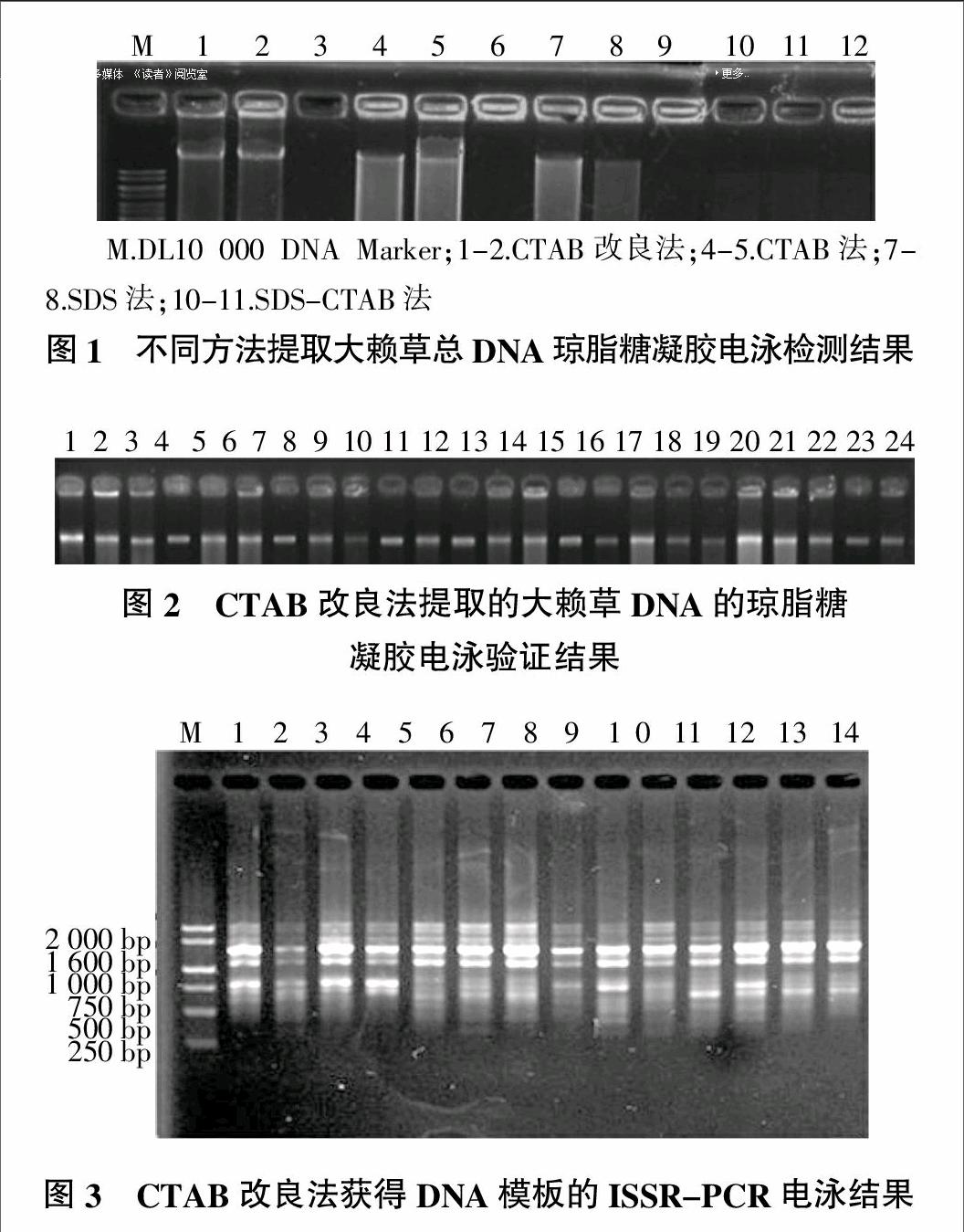
2.2 大赖草DNA样品的琼脂糖凝胶电泳结果
图1为4种方法提取的大赖草DNA的琼脂糖凝胶检测结果。由图1可以看出,CTAB改良法提取的DNA亮度均匀一致、条带清晰、整齐、几乎无拖尾现象,质量较好;SDS法与CTAB法提取的DNA出现降解现象且降解严重;而SDS-CTAB法提取的DNA条带不明显。相比较而言,改良的CTAB法的提取效果最好,说明该方法对于大赖草中的多糖和次生代谢产物去除效果相对其他3种方法的效果较好,所提取DNA的完整性较好。对CTAB改良法提取DNA的效果进行进一步验证,结果如图2所示。由图2可知,CTAB改良法所提取的24份大赖草DNA条带整齐、完整、无降解,表明其质量较高,完全可以满足后续试验需要。
2.3 大赖草DNA样品的ISSR扩增反应检测结果
以CTAB改良法提取的总DNA为模板,用引物UBC815进行ISSR-PCR扩增,进一步验证CTAB改良法所提取DNA的可靠性,结果如图3所示。由图3可知,CTAB改良法提取的总DNA的扩增效果图谱清晰、多态性高。
3 小结与讨论
植物DNA的提取方法较多,基本上是比较成熟的,但对不同的植物来说,由于其各自的生物化学成分和结构不同,在具体操作中存在较大的差异。多酚、多糖、蛋白质等物质的含量是DNA提取质量的关键影响因素。一般来说,CTAB缓冲液比较适用于草本植物和不含酚类或含酚类较少的植物DNA提取[15,16]。
本研究根据试验材料大赖草所具有的特性,选用了4种常见的方法提取了基因组DNA,在试验过程中为了提高DNA的质量,首先,提取前在抽提缓冲液中加入了EDTA、PVP40等能络合多种酚类物质的试剂,可以防止DNA发生褐变;其次,加入了β-巯基乙醇以降解蛋白质并抑制多种酶的氧化活性;再次,考虑到细胞裂解的充分性,在水浴的过程中,将水浴时间延长到了50 min;此外,利用三氯甲烷/异戊醇(体积比为24∶1)混合溶液抽提时,可根据大赖草叶子的老与嫩选择抽提的次数,老叶子适当增加抽提次数。如果琼脂糖凝胶电泳图谱的点样孔有残留杂质,说明该DNA样品中含有较多的未被去除的蛋白质、多糖及一些其他次生代谢产物,由于这些物质具有黏连特性,常与DNA结合成复合物,使得DNA分子无法离开点样孔或电泳速度较慢。试验利用ISSR-PCR检测CTAB改良法提取的基因组DNA质量,发现扩增效果图谱清晰、多态性高,说明此方法在提取的过程中蛋白质、多糖等物质除去的较干净,从而提高了对PCR反应体系中TaqDNA聚合酶的活性以及引物结合模板的能力。endprint
综上可知,采用CTAB法、CTAB改良法、SDS法、SDS-CTAB法4种方法提取大赖草叶片基因组DNA时,以CTAB改良法提取的效果最佳,可以满足后续的分子生物学研究。
参考文献:
[1] 王 丽,邹明谦,李沿宁,等.大赖草的组织培养及植株再生的研究[J].草业科学,1995,12(6):42-44.
[2] 崔乃然.新疆植物志(第六卷).[M].乌鲁木齐:新疆科技卫生出版社,1996.213.
[3] 董玉琛,孙小珍,钟干远,等.新疆阿尔泰地区大赖草的考察和初步研究[J].中国农业科学,1985(2):54-56.
[4] MUJEEB K A,RODRIGUEZ R. An intergenetic hybrid of Triticum aestivum×Leymus rcemosus[J].Heredity,1981,72:217-252.
[5] 张茂银,王子霞,海热古力,等.新疆大赖草的性状鉴定及与普通小麦有性杂交[J].西北农业学报,2000,9(4):1-4.
[6] PERNILLA L S, ARNULF M. Genome composition,stability and fertility of hexaploid allopliods between Triticum turgidum var. carthlicum and Leymus racemosus[J]. Hereditas,2001, 134(1):79-84.
[7] 吴 彬.用SSR标记鉴定大赖草染色体及其片段[D].南京:南京农业大学,2003.
[8] 刘 宇,周桂玲.大赖草种子的休眠和寿命[J].新疆农业科学,2008,45(2):356-361.
[9] 刘 宇,周桂玲.大赖草的交配系统及生殖对策[J].中国沙漠,2010,30(1):92-96.
[10] 古丽娜儿·阿不来提,周桂玲,王 轶,等.不同贮藏条件对大赖草种子萌发的影响[J].干旱区研究,2014,31(3):502-507.
[11] 袁云香,李海娟.水稻基因组DNA提取方法的研究进展[J].湖北农业科学,2010,49(4):968-971.
[12] 孙璐宏,鲁周民,张 丽.植物基因组DNA提取与纯化研究进展[J].西北林学院学报,2010,25(6):102-106.
[13] 李金璐,王 硕,于 婧,等.一种改良的植物DNA提取方法[J].植物学报,2013,48(1):72-78.
[14] ZHANG X X,WANG L,SHOU L L.Modified CTAB method for extracting genomic DNA from wheat leaf[J]. Agricultural Science & Technology,2013,14(7):946-949.
[15] 盛 璐,张逢凯,潘 婷,等.不同提取方法的铁线莲属叶片总DNA提取效果[J].林业科技开发,2014,28(2):16-19.
[16] 苏 前,吕 杰,任曼丽,等. 硅胶干燥罗布麻叶片DNA提取及RAPD反应体系建立[J].新疆农业科学,2013,50(3):524-529.endprint
