精子核蛋白组型转换对精子DNA损伤程度和精液参数的影响
2015-09-22郑九嘉黄学锋
张 欢 郑 屹 郑九嘉 周 颖 黄学锋
浙江省温州医科大学附属第一医院生殖医学中心(温州 325000)
精子核蛋白组型转换对精子DNA损伤程度和精液参数的影响
张 欢 郑 屹 郑九嘉 周 颖 黄学锋*
浙江省温州医科大学附属第一医院生殖医学中心(温州 325000)
目的 探讨精子核蛋白组型转换异常对精子DNA损伤程度和精子质量的影响。方法 收集511例本中心接受精液检查的标本,采用苯胺蓝染色法检测精子核蛋白组型转换,分析其与精子DNA损伤程度、常规参数及形态学之间的相关性。结果 将精子核蛋白组型异常率分为≤10%、10%~20%、20%~30%和≥30% 4组,发现核蛋白组型异常率≥30%这组的DNA碎片指数(DNA fragmentation index,DFI)为(18.7±9.7)%,正常形态精子为(3.7±3.3)%,均低于异常率<30%的各组,其差异具有统计学意义(P<0.05)。双变量相关分析表明,精子核蛋白组型转换与无DNA晕轮和中DNA晕轮精子数及DFI呈显著正相关,Pearson相关系数分别为0.255、0.115和0.208(P<0.01);与大DNA晕轮的精子及精子浓度、精子总数、正常形态精子呈显著负相关,Pearson相关系数分别为-0.209、-0.152、-0.181、-0.193(P<0.05或P<0.01)。多元逐步回归分析显示,DFI、精子总数和正常形态精子数是3个独立的相关变量。结论 精子核蛋白组型转换与精子形态、DNA损伤程度和精子总数等指标之间存在显著的相关性,与精液常规指标存在弱或中等相关性;因此,精子核蛋白组型转换可能是评价精子质量和功能的另一项重要的参考指标。
不育, 男性; 核蛋白类; 精子能动性; DNA损伤
据报道,近年来全球约有15%已婚夫妇受到不孕不育的困扰,其中约一半是由男性不育引起[1],在影响男性精子质量和功能的诸多因素中,较为常见的有精子染色体畸变和DNA损伤[2,3]、精子线粒体异常导致能量供应障碍[4]以及某些病毒的感染(如乙型肝炎病毒感染[5])等。而在可能影响精子质量的众多因素中,精子DNA损伤及核蛋白组型转换异常是当前生殖医学研究的热点之一。目前较多的研究发现,精子DNA损伤会降低精子受精能力和胚胎发育潜能,从而降低妊娠率,同时还会使流产率增高[6],因此,精子DNA损伤被认为是一项新的评价精子质量的指标[7]。此外,一些学者认为[8]在精子发生过程中,睾丸生精细胞内DNA含量发生着规律性变化,富含赖氨酸的组蛋白逐渐被富含精氨酸和胱氨酸的鱼精蛋白所取代,这种转变过程即为精子核蛋白组型转换。如果生精细胞内的核蛋白组型转换异常或受阻,可使精子DNA不稳定,增加DNA的损伤程度,可能导致男性不育,甚至在精子受精后精核不能正常解聚,影响雌雄原核的融合引起胚胎早期夭折,因此认为精子核蛋白组型异常可能是导致精子DNA损伤的机制之一;同时一些研究表明,在男性不育患者的精液中存在大量核蛋白组型转换异常的精子[8]。
目前尚无详细的报道阐明精子核蛋白组型异常与精子DNA损伤及精子质量之间存在一定的相关性,本研究试图通过对精子核蛋白组型转换异常率的详细分组,探讨不同的核蛋白组型异常与精子DNA损伤程度之间的相关性以及对精子参数和质量的影响,以期为男性不育的临床诊断和治疗提供一定的理论依据。
对象与方法
一、对象
511例精液标本来自2012年6月至2013年4月就诊于本中心的男性患者,平均年龄为(32.7±4.8)岁,经临床检查:性功能正常,无生殖系统感染,无全身和内分泌系统疾病,无隐睾、睾丸发育不良和精索静脉曲张,抗精子抗体阴性。所有患者禁欲3~5d,手淫方法收集精液标本,在37℃ 20~30min完全液化后按世界卫生组织《人类精液与宫颈粘液相互作用实验室检验手册》(第4版)行精液常规参数检查,采用CASA系统(西班牙MLCRORTICS.L公司,型号: SCA2002型)检测精子活动力。
二、方法
(一)精子形态学分析
精子形态学分析方法按照WHO(第五版)[9]推荐的改良巴氏染色和形态学评价方法。
(二)精子核蛋白组型转换检测
按试剂盒(试剂盒购自深圳华康生物医学工程有限公司)操作说明采用苯胺蓝染色法检测精子核蛋白组型转换。
(三)精子染色质扩散(SCD)检测精子DNA损伤
采用精子Halosperm试剂盒(Halotech DNA, Spain)说明书方法进行SCD检测,步骤简述如下:新鲜精液用PBS稀释至精子密度1×107/mL,取出60μL加入溶解的低熔点琼脂糖凝胶60μL中,37℃下混匀, 加20μL精子凝胶混合液于预处理载玻片上,盖上22 cm×22 cm盖玻片,4℃冰箱水平放置5 min。移去盖玻片,放入酸性DNA变性液中,室温避光孵育7 min,取出玻片浸泡于裂解液中,避光孵育23 min。在蒸馏水中静置5 min洗去残余裂解液,玻片依次放入70%、90%和100%乙醇中各2 min脱水。晾干后玻片用染色液(Wright's染色剂和磷酸盐缓冲液等比例混合)覆盖于样本表面,曝光10~15 min。用自来水冲洗掉染液,烘干。400倍光镜下观察,比较精子核和核周围晕轮大小,计算精子DNA碎片指数(DNA fragmentation index, DFI)。DFI的计算方法:小光晕和无光晕精子所占计数精子总数的百分率即为精子的DFI。
三、统计学分析
定量数据以均数±标准差表示,各组均数比较采用单因素方差分析,多重比较采用LSD法检验,方差不齐时用Dunnert 法;两变量相关分析比较精子核蛋白组型与其他精液检查指标的相关性,对有相关的变量采用多元逐步回归分析筛选相关变量;以P<0.05为差异有统计学意,应用SPSS 19.0软件进行分析。
结 果
一、精子核蛋白组型转换与精子参数的相关性分析
我们将所有入选的511例精液标本按核蛋白组型检测阳性率分为≤10%组(68例)、10%~20%组(245例)、20%~30%组(140例)和≥30%组(58例),比较4组间精子参数的差异。比较发现各组患者年龄、精液量、液化时间和pH之间均无统计学意义(P>0.05);当精子核蛋白组型转换异常率≥30%时,精子浓度显著降低于≤10%组(P<0.05),前向运动活动率(a+b)级低于10%~20%组(P<0.05),静止精子率(d级)高于≤10%组和10%~20%组(P<0.05),见表 1。
二、精子核蛋白组型转换对精子DNA损伤程度的影响
随着核蛋白组型转换异常率的升高,精子DNA的损伤也逐渐增加,当核蛋白组型转换异常率≥30%时,大晕轮精子(正常DNA精子)数显著降低,无晕轮精子(带DNA损伤的精子)数显著升高,其差异均具有统计学意义(P<0.05);同时,核蛋白组型转换异常率≥30%组的精子DNA碎片指数(DNA fragmentation index, DFI)也显著高于核蛋白组型≤30%的各组,其差异具有统计学意义(P<0.05),见表2。
精子核蛋白组型异常率和精子DNA损伤之间的相关性分析表明,精子蛋白组型与DNA损伤程度呈显著的线性相关,见表3。
表 1 精子核蛋白组型转换与精子参数的相关性(±s)
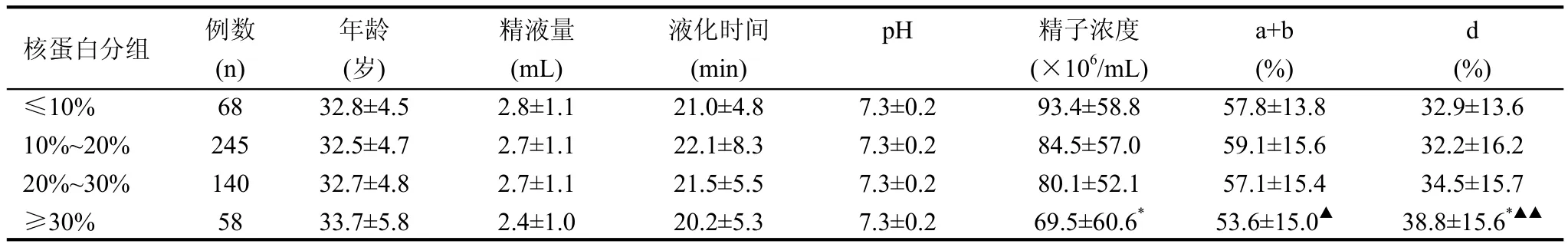
表 1 精子核蛋白组型转换与精子参数的相关性(±s)
与≤10%组比较,*: P<0.05; 与10%~20%组比较,▲: P<0.05;▲▲: P<0.01
核蛋白分组 例数 年龄 精液量 液化时间 pH 精子浓度 a+b d (n) (岁) (mL) (min) (×106/mL) (%) (%)≤10% 68 32.8±4.5 2.8±1.1 21.0±4.8 7.3±0.2 93.4±58.8 57.8±13.8 32.9±13.6 10%~20% 245 32.5±4.7 2.7±1.1 22.1±8.3 7.3±0.2 84.5±57.0 59.1±15.6 32.2±16.2 20%~30% 140 32.7±4.8 2.7±1.1 21.5±5.5 7.3±0.2 80.1±52.1 57.1±15.4 34.5±15.7≥30% 58 33.7±5.8 2.4±1.0 20.2±5.3 7.3±0.2 69.5±60.6*53.6±15.0▲38.8±15.6*▲▲
表2 精子核蛋白组型转换与精子DNA碎片指数(DFI)的相关性(±s)

表2 精子核蛋白组型转换与精子DNA碎片指数(DFI)的相关性(±s)
与≤10%组比较,*: P<0.05;**: P<0.01; 与10%~20%组比较,▲: P<0.05;▲▲: P<0.01; 与20%~30%组比较,☆: P<0.05;☆☆: P<0.01
核蛋白分组 例数 大晕轮精子 中晕轮精子 小晕轮精子 无晕轮精子 DFI n (%) (%) (%) (%) (%)≤10% 68 76.8±9.1 9.4±4.3 6.6±3.1 7.2±5.8 13.9±7.9 10%~20% 245 77.6±9.9 8.6±3.8 6.2±3.1 7.5±5.2 13.7±7.5 20%~30% 140 76.7±9.5 8.7±4.2 6.2±3.0 8.4±5.2 14.6±7.2≥30% 58 70.6±12.6**▲▲☆☆10.7±4.2▲▲☆☆7.2±3.8▲11.5±7.2**▲▲☆18.7±9.7*▲▲☆
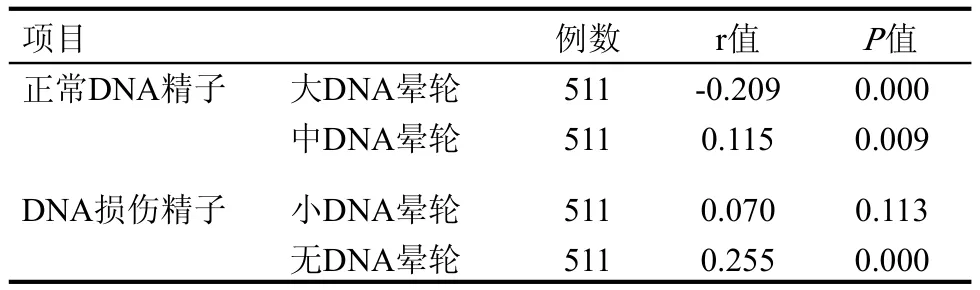
表3 精子核蛋白组型转换与精子DNA损伤程度的相关性分析
三、精子核蛋白组型转换与精子形态学分析
比较核蛋白组型各异常组精子形态学指标,4组间的颈中段缺陷、精子畸形指数(SDI)、多重异常指数(MAI)、正常形态精子均具有显著性差异(P<0.05),随核蛋白组型异常率的升高,正常形态精子数逐渐降低,尤其当核蛋白组型异常率≥30%时,正常形态精子百分数小于正常范围(WHO手册 第4版,<4.0%)见表4。
四、精子核蛋白组型转换与DFI及精子各指标的相关性分析
相关性分析表明,精子核蛋白组型转换与d级精子数和DFI存在正相关,而与精液量、精子浓度、前向运动精子、精子总数、正常形态精子数之间存在负相关,见表5。多元逐步回归分析显示,精子总数、正常形态精子和DFI是3个独立的相关变量。
表4 精子核蛋白组型转换与精子形态的相关性(±s)
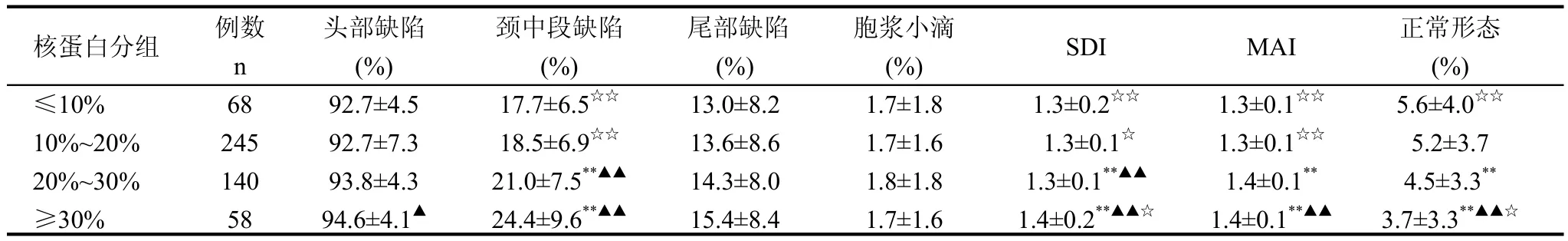
表4 精子核蛋白组型转换与精子形态的相关性(±s)
与≤10%组比较,**: P<0.01; 与10%~20%组比较,▲: P<0.05;▲▲: P<0.01; 与20%~30%组比较,☆: P<0.05;☆☆: P<0.01
核蛋白分组 例数 头部缺陷 颈中段缺陷 尾部缺陷 胞浆小滴 SDI MAI 正常形态n (%) (%) (%) (%) (%)≤10% 68 92.7±4.5 17.7±6.5☆☆13.0±8.2 1.7±1.8 1.3±0.2☆☆1.3±0.1☆☆5.6±4.0☆☆10%~20% 245 92.7±7.3 18.5±6.9☆☆13.6±8.6 1.7±1.6 1.3±0.1☆1.3±0.1☆☆5.2±3.7 20%~30% 140 93.8±4.3 21.0±7.5**▲▲14.3±8.0 1.8±1.8 1.3±0.1**▲▲1.4±0.1**4.5±3.3**≥30% 58 94.6±4.1▲24.4±9.6**▲▲15.4±8.4 1.7±1.6 1.4±0.2**▲▲☆1.4±0.1**▲▲3.7±3.3**▲▲☆
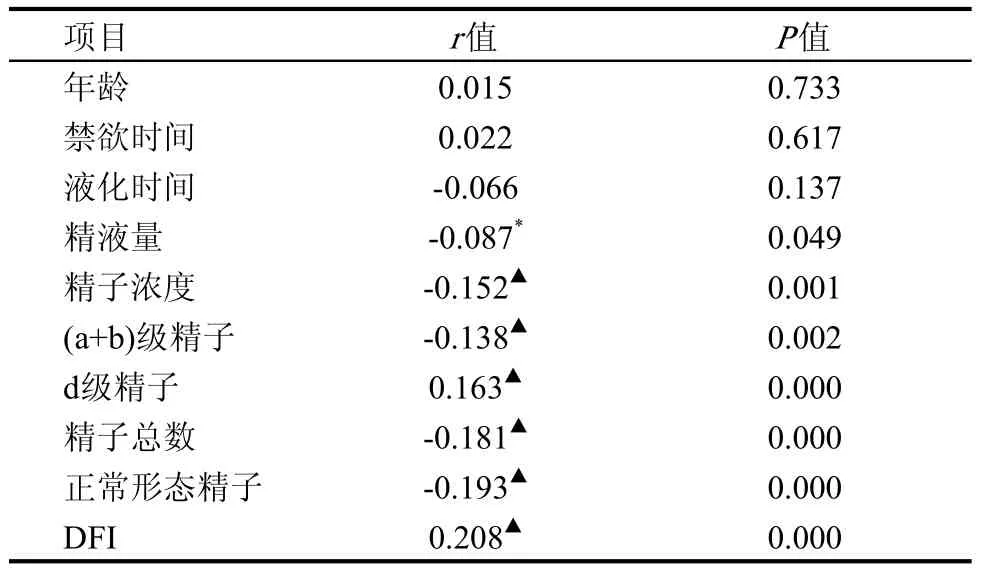
表5 精子核蛋白组型转换与DFI及精子参数双变量相关性分析
讨 论
在人类精子发生的过程中,除染色体数目和DNA含量规律性的变化外,睾丸特异性表达的与DNA相结合的核蛋白也会发生一系列的组型转换,主要包括富含赖氨酸的组蛋白逐渐被过渡蛋白1(TNP1)和过渡蛋白2(TNP2)取代,随后这两种过渡蛋白又逐渐被鱼精蛋白1(PRM1)和鱼精蛋白2(PRM2)取代[10],这种取代使染色体结构更加紧密,从而保护人类精子DNA免受氧化应激和其他内外环境因素的影响[11],同时对精子的正常发育和能否正常受精也具有重要的意义[12]。据报道,鱼精蛋白能中和并降低DNA分子间的电荷和静电排斥作用,并且能抑制DNA转录,抑制某些基因表达,使遗传物质保持稳定。如果在精子成熟过程中,核蛋白组型转换出现异常可能会使染色质的结构变得松散,精子DNA链上的电荷无法被中和,从而使精子DNA发生损伤,这些损伤又会使精子头部甚至线粒体内的某些重要蛋白的转录甚至合成发生障碍,进而影响精子的相关功能,诱发男性不育[13-15]。一些研究表明[16,17],精子核蛋白组型转换发生异常可使精子DNA的不稳定性增加,影响精子正常功能并且不容易受精,即使受精,精子核不能正常解聚,同时异常的核蛋白可使过量的精源性组蛋白再次被包装入受精卵染色质中,妨碍卵裂时染色体的行为及胚胎发育过程中基因的表达与调控,进而影响了雌雄原核的融合,并且导致胚胎不能正常发育,造成胚胎早期夭折或流产。Soderlund等[18]研究发现,精子核成熟度会影响精子受精和卵裂能力,同时会影响受精后原核的形成、胚胎的早期发育及胚胎着床。
目前,精子DNA碎片的检测被认为是一个新的评价精子质量和预测生育能力的指标[19],一些研究也显示精子DNA 损伤与精子一些功能指标相关[20,21]。而在精子发生时其DNA的变化与核蛋白规律性的变化往往都是相互伴随发生的,那么精子核蛋白组型转换与精子DNA损伤及精子质量之间是否会存在一定的关联性,目前较少有见相关报道。陈康等[22],对精子核蛋白组型正常组与异常组的精子DNA完整性分析发现,精子核蛋白组型转换异常率与DNA碎片指数呈显著的线性相关。在我们前期的初步研究中已发现[23],精子核蛋白组型转换异常会使精子DNA的稳定性降低,导致DNA碎片率显著的高于核蛋白正常精子;同时精子浓度,活动力和精子总数等精液相关参数及顶体酶活性也均低于核蛋白正常精子;并且影响胚胎发育质量,增加流产概率。因此,在前期初步研究的基础上,本研究通过对精子核蛋白组型异常的详细分组,探讨核蛋白组型转换异常与精子DNA损伤程度及精子质量之间的相关性。分析发现,比较精子核蛋白组型不同的异常率,当核蛋白组型异常率增加,活动力及正常形态精子数均随之降低;同时,随着核蛋白组型异常率的升高,带DNA碎片的精子数(小晕轮和无晕轮精子)也逐渐增加。目前临床上广泛认为30%是精子核蛋白组型正常的临界值,我们发现,当核蛋白组型异常率≥30%时,大晕轮精子数显著降低,无晕轮精子数显著升高,精子DNA碎片指数(DNA fragmentation index, DFI)也显著高于核蛋白组型≤30%的各组,同时,精子蛋白组型与DNA损伤程度呈显著的线性相关。根据以上结果,我们推测正常的精子DNA结合紧密且具有抗酸性,能够维持双链的稳定,而核蛋白组型转换异常的精子则不能正常的完成组蛋白到鱼精蛋白的转换,同时DNA链上的电荷不能被完全中和,使DNA呈现松散结构的染色质状态,或变性为单链结构,从而更容易造成精子DNA损伤,而精子DNA损伤的累积超过一定的阈值时,可能使精子遗传物质受到破坏,继而影响精子质量。
随着生殖医学的发展,临床和实验室对部分男性不育患者精液常规参数的检查已经不能完全对男性生育力及不育原因做出准确的判断,而且约有15%的男性不育患者精液常规或形态学检查是正常的,因此有必要探讨新的不育评价指标。近年来,关于精子DNA损伤与核蛋白组型转换的研究已成为生殖医学领域的热点之一。在本研究中我们采用国际认可的苯胺蓝染色法半定量检测精子核蛋白成熟度,利用染色质扩散法(SCD)检测精子DNA损伤,通过分析发现,精子核蛋白组型转换与精子常规参数、正常精子形态、DNA损伤程度等指标之间存在显著相关性。由此可见,对精子DNA与核蛋白组型转换的关注和研究变得尤为重要,虽然目前均认为精子DNA损伤与核蛋白组型转异常是一个新的评价精子质量和预测生育能力的指标,但对其原因及对人类生殖结局的全面影响仍知之甚少,同时,辅助生殖技术中行ICSI(卵胞浆内单精子显微注射)治疗时,绕过了精子的自然选择过程,人为选择仅仅是形态和活动力较好的精子,但这并不能确保其遗传物质必定正常,故子代个体存在一定的遗传风险[24]。目前精子DNA损伤与核蛋白组型转换的检测方法逐渐趋于成熟和完善,并在临床上得到了一定的应用[25,26],因此,精子核蛋白组型转换可考虑作为评价精子质量和功能的另一项重要的参考指标。
综上所述,我们将在本研究通过苯胺蓝染色半定量法对精子核蛋白组型转换评估精子DNA损伤和精子质量的基础上,深入探讨鱼精蛋白在人类精子发生中的调控机制,为男性不育可能的发生机制和临床诊断治疗及辅助生殖技术的研究提供新的方向。
1 Sharlip ID, Jarow JP, Belker AM, et al. Best practice policies for male infertility. Fertil Steril 2002; 77(5): 873-882
2 邱毅, 王磊光, 张丽红, 等. 男性不育患者精子染色体畸变及精子DNA完整性分析. 中华医学遗传学杂志 2008; 25(6): 681-685
3 费前进, 金建远, 倪吴花, 等. 不育夫妇中男性精子DNA碎片指数变异的研究. 中华医学遗传杂志 2013; 30(3): 357-361
4 郑九嘉, 楼哲丰, 郑蔚虹, 等. 线粒体呼吸功能与精子活力核DNA损伤的相关性分析. 中国细胞生物学学报2012; 34(1): 34-40
5 郑九嘉, 王佩玉, 李庆兴等. 乙型肝炎病毒感染对精液参数和精子相关功能的影响. 中华传染病杂志 2013; 31(9): 543-547
6 Evenson DP, Wixon R. Clinical aspects of sperm DNA fragmentation detection and male infertility. Theriogenology 2006; 65(5): 979-991
7 Evenson DP, Larson KL, Jost LK. Sperm chromatin structure assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl 2002; 23(1): 25-43
8 Katayose H, Yanagida K, Hayashi S, et a1. Fertilization failure from a sperm chromatin defect in couples with unexplained infertility. J Reprod Med 2004; 49(9): 727-732
9 World Health Organization. Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. 5-th ed. New York: Cambridge University Press, 2010, 59-67
10 Sassone-Corsi P. Unique chromatin remodeling and transcriptional regulation in spermatogenesis. Science 2002; 296(5576): 2176-2178
11 Braun RE. Packaging paternal chromosomes with protamine. Nat Genet 2001; 28(1): 10-12
12 Ward WS, Coffey DS. DNA packaging and organization in mammalian spermatozoa: comparison with somatic cells. Biol Reprod 1991; 44(4): 569-574
13 Evenson DP, Larson KL, Jost LK. Sperm chromatin structure assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl 2002; 23(1): 25-43
14 Hazout A, Dumont-Hassan M, Junca AM, et al. Highmagnifcation ICSI overcomes paternal effect resistant to conventional ICSI. Reprod Biomed Online 2006; 12(1): 19-25
15 Saleh RA, Agarwal A, Nelson DR, et al. Increased sperm nuclear DNA damage in normozoospermic infertile men: a prospective study. Fertil Steril 2002; 78(2): 313-318
16 Aoki VW, Liu L, Carrell DT. A novel mechanism of protamine expression deregulation highlighted by abnormal protamine transcriptretention in infertile human males with sperm prota-mine defciency. Molecular Mol Hum Reprod 2006; 12(1): 41-50
17 陈松, 曹坚, 费仁仁, 等. 弱精子症患者精核蛋白含量的分析. 中华男科学杂志 2005; 11(8): 587-589
18 Soderlund B, Lundin K. Choosing fertilization method by analyzing sperm morphology or by performing swimup preparation. Acta Obstet Gynecol Scand 2006; 85(3): 306-311
19 Cooper TG. WHO laboratory manual for the Examination and processing of human semen. Fifth Edition. Switzerland: WHO Press, 2010: 157
20 黄祝, 蒋超, 徐会茹, 等. 不育患者精子活力与精浆及精子核DNA完整性关系的初步研究. 临床检验杂志2008; 26(3): 191-193
21 Sills ES, Fryman JT, Perloe M, et al. Chromatin fuorescence characteristics and standard semen analysis parameters:correlations observed in andrology testing among 136 males referred for infertility evaluation. J Obstet Gynaecol 2004; 24(1): 74-77
22 陈康, 周宇林, 余波澜, 等. 精子核蛋白组型异常及DNA损伤与精子活动力的相关性研究. 中华临床医师杂志2013; 7(2): 89-91
23 郑九嘉, 肖仕全, 杨旭, 等. 精子核蛋白组型转换与精液参数、胚胎发育的相关性分析. 中华泌尿外科杂志2013; 34(9): 694-698
24 宋学茹, 姜珊, 白晓红, 等. 精子DNA完整性检测的临床应用. 国际生殖健康/计划生育杂志 2011; 30(1): 61-64
25 熊承良. 人类精子学. 武汉: 湖北科学技术出版社, 2002: 414-415
26 Shamsi MB, Kumar R, Dada R. Evaluation of nuclear DNA damage in human spermatozoa in men opting for assisted reproduction. Indian J Med Res 2008; 127(2): 115-123
(2015-02-02收稿)
Impact of sperm-nucleoprotein transition on degree of sperm DNA damage and seminal parameters
Zhang Huan, Zheng Yi, Zheng Jiujia, Zhou Ying, Huang Xuefeng*Reproductive Medicine Center, the First Hospital of Wenzhou Medical University, Wenzhou, Zhejiang 325000, China Corresponding author: Huang Xuefeng, E-mail: shuoz10@126.com
Objective To investigate the impact of sperm- nucleoprotein transition on sperm DNA damage, semen parameters and sperm morphology. Methods Total of 511 semen samples were collected. Sperm-nucleoprotein transition was assessed by aniline blue staining, then correlation analysis between sperm-nucleoprotein transition and sperm DNA damage, semen parameters and sperm normal morphology were performed. Results Semen samples were classifed into four groups according to the sperm-nucleoprotein transition of ≤10%, 10~20%, 20~30% and ≥30%. In ≥30% group, the DFI, sperm normal morphology were (18.7±9.7)%, (3.7±3.3)%, which were lower than those in <30% groups, the differences were significantly(P<0.05). The correlative analysis showed sperm-nucleoprotein transition was negatively correlated to large-sized DNA dispersion halo, sperm concentration, total amount of sperm, normal morphology (r = -0.209、-0.152、-0.181、-0.193, P<0.05 or P<0.01), but positively correlated to none-sized or medium-sized dispersion halo sperm and DFI(r =0.255,0.115 and 0.208, P<0.01). Stepwise linear regression analysis demonstrated that DFI, totalamount of sperm and normal morphology were independent variables related to sperm-nucleoprotein transition. Conclusion Sperm-nucleoprotein transition is closely related with sperm normal morphology, the degree of sperm DNA damage and total amount of sperm, and may become another important independent parameter for the evaluation of sperm quality.
infertility,male; Nucleoproteins; sperm motility; DNA Damage
10.3969/j.issn.1008-0848.2015.06.005
R 698.2
*通讯作者, E-mail: shuoz10@126.com
