磁响应性三元复合材料制备及引导骨缺损修复的研究
2015-09-16郝绥绥吴凤新黄宇光顾许海燕
校 搏 郝绥绥 吴凤新 孟 洁 张 宇 刘 健 黄宇光顾 宁#* 许海燕#*
1 (中国医学科学院北京协和医院麻醉科,北京 100730)2 (中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)3 (东南大学生物科学与医学工程学院生物电子学国家重点实验室,南京 210096)
磁响应性三元复合材料制备及引导骨缺损修复的研究
校 搏1郝绥绥2吴凤新2孟 洁2张 宇3刘 健2黄宇光1顾 宁3#*许海燕2#*
1(中国医学科学院北京协和医院麻醉科,北京 100730)2(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)3(东南大学生物科学与医学工程学院生物电子学国家重点实验室,南京 210096)
创伤、感染、肿瘤和先天畸形等均会造成骨组织的缺损,当缺损超过临界尺寸时,骨组织无法完成自我修复,应用生物材料引导骨组织的再生从而修复缺损组织是极为重要的治疗策略,而骨形成速度慢则是当前引导骨再生支架面临的难点之一。氧化铁磁性纳米颗粒(γ-Fe2O3-NP)和纳米羟基磷灰石(nHA)与消旋聚乳酸(PDLLA)以不同比例共混,利用高压静电纺丝技术制备具有纳米纤维网络结构的复合材料薄膜。应用振荡样品磁强计研究复合材料的磁学性质与氧化铁磁性纳米颗粒含量之间的关系,通过扫描电镜观察薄膜材料的微观结构特征。选取12只健康雄性成年新西兰大白兔,在横突骨组织离断模型上,采用CT成像技术,研究术后10、30、50 d时复合材料植入组、复合材料植入加磁场组以及离断无治疗对照组的骨组织再生与缺损修复效果;此外,在术后20 d采集每组中2只动物的植入部位组织进行病理观察。研究结果显示,复合材料具有超顺磁响应性质,且随材料中氧化铁纳米颗粒比例的提高而增强;该复合材料可以在外加磁场的作用下,加速引导离断缺损部位的骨组织再生。
骨修复;氧化铁磁性纳米颗粒;复合材料;纳米纤维支架
引言
创伤、骨疾病、肿瘤切除等,经常会造成大块骨缺损且很难自我修复。随着社会快速发展与日益增加的人口老龄化,骨修复已成为临床医学和社会经济的迫切需求,目前,骨科治疗中通常使用自体骨或异体骨移植来治疗大块骨缺损,但是这些方法受到很多方面的限制,如来源有限、移植感染、免疫排斥反应等[1-2]。过去数十年中,研究人员探索和开发了多种人工生物材料支架作为自体或同种异体骨移植的替代品,并取得了重要进展,这些支架不仅具有良好的生物相容性和接近天然骨组织的微观结构,而且可以携带和缓释骨形成蛋白等促进骨形成的生物分子[3-6]。尽管如此,支架在体内诱导成骨速度较慢而导致大块缺损难以修复仍然是其面临的巨大挑战。
在正常生理条件下,骨组织感受由重力产生的负荷和由机体运动及体内生理流体产生的剪切、挤压与牵拉,通过将力刺激转化为生物化学信号而促进成骨细胞的功能和诱导骨的形成,以维持正常骨量和骨组织的最佳性能。例如,骨小梁受到的流体剪切应力为0.8~3.0 N/m2,组织的应变为0.03%~0.1%[7]。分析认为,在骨缺损环境中,支架引导新骨形成速度缓慢的重要原因之一是植入初期支架与正常骨组织间还没有形成紧密连接,因而无论是来自生理环境的力刺激还是体外施加的机械力,都难以有效传递到植入的支架上,所以支架中的成骨细胞在其增殖和向成骨分化的过程中缺少持续和适度的力刺激。因此,使支架在骨缺损部位给细胞以力学刺激是加速支架诱导成骨的一个关键因素。
一些研究结果表明,外加磁场能加速骨折的愈合[8],如中等强度的静磁场能促进兔子的骨及软骨的愈合[9];而对MC3T3-E1细胞施加磁刺激,可增加细胞液中游离钙离子浓度,并将刺激信号传至细胞核内,促进成骨细胞合成、分泌BMP等生长因子[10];此外,有报道说,将磁化的金属材料植入到大鼠股骨中,可以预防骨密度下降[11]。近年来,国内外均有研究组制备含磁性纳米颗粒的复合材料支架,探究磁性颗粒对成骨细胞的作用及其在骨缺损修复方面的应用。例如,含有超顺磁纳米颗粒(MNP)的陶瓷复合物对人成骨细胞Ros17/2.8和MG63表现出良好的相容性,其中超顺磁纳米颗粒不影响骨形成蛋白(BMP)与复合物的结合,磁性Fe3O4纳米颗粒与壳聚糖(CS)和聚乙烯醇(PVA)的复合纳米纤维膜也表现出促进人成骨细胞(MG63)增殖的功能,含磁性氧化铁颗粒的多孔生物活性玻璃支架(Fe-MBG)可提高人骨髓间充质干细胞(BMSC)的线粒体活性和骨相关基因(ALP和OCN)的表达[12-14]。本课题组曾经报道,采用溶液混合方法,可制备含有氧化铁磁性纳米颗粒的纳米纤维支架材料;在骨的部分缺损模型上,该支架可以响应外加磁场的作用而对生长在支架上的细胞产生力学刺激功能,从而加速新骨的形成[15-16]。
本研究在上述工作的基础上,采用热熔共挤出技术制备三元复合材料,研究了复合材料的磁学性质与氧化铁纳米颗粒含量的关系,并在兔横突骨组织离断模型上,研究了在外加磁场条件下磁响应性纳米纤维复合材料引导骨缺损的修复作用。结果显示,复合材料的超顺磁响应性质随材料中氧化铁纳米颗粒比例的提高而增强,该复合材料可以在外加磁场作用下加速引导离断部位骨组织的再生和修复。
1 材料与方法
1.1原料、试剂、手术器械和实验动物
消旋聚乳酸(Poly (DL-lactide)),简称PDLLA购自四川成都迪康公司,平均分子量为80 KD。羟基磷灰石纳米粒子(hydroxyapate nanoparticles, nHA)购自南京埃普瑞纳米材料有限公司,纯度为97%,粒径为20 nm,低菌低重金属03型。氧化铁磁性纳米颗粒(γ-Fe2O3-NP)由东南大学顾宁教授实验室合成,粒径约为14 nm。二甲基乙酰胺(DMAc)、无水乙醇均为北京化工厂生产分析纯试剂。双抗(青霉素、硫酸链霉素):1×D-Hank’s配制浓度为20万U/mL的溶液,过滤除菌后分装至EP管中,封口膜封口,-20 ℃保存。4%多聚甲醛4 ℃保存。
手术用器械主要包括骨科手术常规器械、骨刀、骨膜剥离子、咬骨钳等。健康雄性成年新西兰大白兔12只,体重2.5~3.0 kg,购自北京维通利华实验动物公司。
1.2方法
1.2.1复合材料的制备
称量PDLLA、nHA、γ-Fe2O3-NP等3种材料,按照不同比例混合均匀,通过加样漏斗加入到热熔挤出机中(Haake MiniLab Ⅱ (Thermo Fisher Scientific, Karlsruhe, Germany),在120 ℃下共混挤出,得到三元复合材料。将复合材料溶于DMAc中,制成20%(W/V)PDLLA/DMAc溶液,灌注于5 mL的注射器中,针头与高压静电发生器输出端连接,针头与接收屏(铝箔)的距离20 cm,施加电压20 kV,缓慢转动铝箔接收针头喷射出的丝束,得到电纺丝薄膜材料,放入真空干燥箱中,常温下干燥48 h,彻底除去薄膜上残留的有机溶剂,之后在纯净水中揭下薄膜。部分薄膜用于理化性质表征和磁学性质测定;其余材料折叠成质量相同的块状材料,用于动物骨缺损植入实验。
1.2.2复合材料表征和磁学性质测定
采用扫描电镜(FEI nova nanosem 450)观察电纺丝薄膜的微观结构。用振动样品磁强计(Vibrating sample magnetometer,VSM)测量电纺丝薄膜的磁化曲线和磁滞回线,从中得出样品的饱和磁化强度MS。
1.2.3动物骨缺损模型及材料植入实验
动物称重,耳缘静脉缓慢注射3%戊巴比妥纳/生理盐水溶液(3 mg/kg)麻醉,术中可视情况经耳缘静脉追加麻醉。待结膜反射消失后,以棉线将四肢固定于动物手术台上,剪除髂骨手术区域及周围的被毛,以碘伏消毒。背部和双侧髂骨常规消毒,铺巾。
沿背部正中做5 cm纵切口,以手术节段L5~L6为中心。切开皮肤、皮下,逐层解剖到椎旁筋膜。止血。切开椎旁筋膜暴露L5、L6棘突,沿棘突中间右侧向下钝性分离肌肉,深度约为1. 5 cm处可见L5横突。用咬骨钳咬断横突距其根部约1 cm处的骨组织,造成横突骨组织完全离断,将复合材料填充至离断部位。设离断无治疗组为对照(n=4)。对分离的筋膜进行缝合,椎旁筋膜用1-0的Vicryl可吸收线缝合,皮下组织用两层2-0 Vicryl可吸收线缝合。3-0尼龙线褥式缝合皮肤,伤口以碘伏消毒。术后对所有实验动物肌注双抗20万U/次,1次/d,共3 d。术后将实验动物按随机法分为3组,放养于兔笼,自由活动:材料植入组(在常规笼中饲养,n=4),材料植入加磁场组(置于两侧固定了磁条的笼中饲养,n=4),磁场强度为2.5~30 mT。
1.2.4病理观察分析和CT造影
在材料植入术后10、30、50 d,对各组动物进行CT扫描成像(Somatom Sensation 64, Siemens Medical Solutions, Forchheim, Germany)。其中,在材料植入术后20 d时,各组处死动物2只,取植入材料部位及周围骨组织,包石蜡块,切片,进行常规HE染色,观察新骨形成和材料被吸收的情况。
1.2.5评价骨组织形成的速度
对骨缺损材料植入术后20 d的病理结果进行骨基质所占比例的分析,通过计算单位材料面积下骨基质和血管所占比例,评价磁场环境对于顺磁性纳米纤维复合材料促进骨组织形成的影响。对骨基质或血管占组织总面积比例的计算遵循以下原则:
1)均在20倍物镜下观察;
2)当材料面积较大时,选取多个视野作为兴趣区域,以代表总体组织;
3)当植入材料在组织切片上分散为多块时,默认体积相当的每一块为独立组织,其中央的区域具有代表性,并作为兴趣区域进行计算;
4)计算组织的总面积时,边缘以材料为界,不包括周围包裹的成纤维细胞;
5)当看到材料周围存在血管结构时,将此血管结构的面积计算在内。
1.2.6统计分析
所有数据资料以平均值±标准差表示,统计分析采用单因素方差分析,P<0.05时认为有统计学显著性差异。
2 结果
2.1复合材料的微观结构
电纺丝薄膜的宏观面积可达700 cm2以上,材质柔软,有一定韧性(见图1(a)),可以剪裁、卷绕或折叠成需要的形状(见图1(b))。薄膜具有纳米纤维网络特征的微观结构(见图1(c)),纤维的直径在100~300 nm范围,纤维相互无规缠结,形成直径数十微米的孔隙。纳米纤维和微米尺度贯通孔隙构成了三维网络结构。
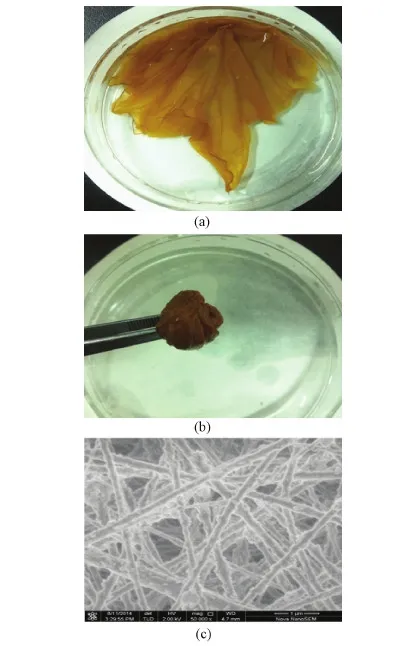
图1 电纺丝薄膜材料的宏观特征和微观结构。(a) 电纺丝材料的宏观形貌照片;(b)电纺丝薄膜材料可以缠绕和折叠;(c)电纺丝薄膜材料的扫描电镜图片Fig.1 Morphological characterizations of nanofibrous film. (a) The photograph of nanofibrous film; (b) Twisting and folding of nanofibrous film; (c) The representative SEM image of nanofibrous film.
2.2复合材料的磁学性质
电纺丝薄膜材料的磁化曲线如图2所示。由图可见,当施加外加磁场时,复合材料的磁感应强度迅速增加并达到饱和,当外加磁场撤去,复合材料随即退磁,几乎没有出现磁滞现象,磁化曲线为对称的S型,表明该复合材料具有超顺磁性。此外,随着复合材料中氧化铁纳米颗粒的质量百分比从1%逐步增加到5%,其磁响应能力随之增强,表现在磁饱和强度相应增大。

图2 电纺丝薄膜材料的磁学性质。(a)氧化铁纳米颗粒含量不同的电纺丝薄膜材料的磁化曲线;(b)不同氧化铁纳米颗粒含量不同的电纺丝薄膜材料的饱和磁化强度Fig.2 Magnetic property of nanofibrous film. (a) Magnetization curve of nanofibrous with different proportions of iron oxide nanoparticles; (b) Saturation magnetization of nanofibrous film with different proportions of iron oxide nanoparticles
2.3病理学观察
对植入顺磁性纳米纤维复合材料的骨缺损部位的病理组织切片进行观察,分析材料诱导骨基质形成(见图3)和血管形成(见图4)的进程。成骨过程分为成骨细胞增殖期、细胞外基质成熟期及细胞外基质钙化期。材料植入离断部位后,会随着时间而逐渐被降解,由新骨基质所代替,并建立新的血供系统。由图3可见,术后20 d时,部分成骨细胞(箭头)的胞质颜色加深;与此同时,材料加磁场组的新骨组织更多(粗箭头指示的浅粉色区域),这意味着成骨细胞的合成分泌骨基质的功能更强。此外,可以看到植入的支架材料更多被吸收,表现为棕色区域相对较少。从图4可以看出,在材料加磁场组的植入部位,由内皮细胞形成的血管结构相对较多,同样棕色的材料区域相对较少。这些结果说明,在外加磁场的作用下,磁响应性支架可以更快地引导血管结构的形成,有利于在支架内部形成新骨组织。
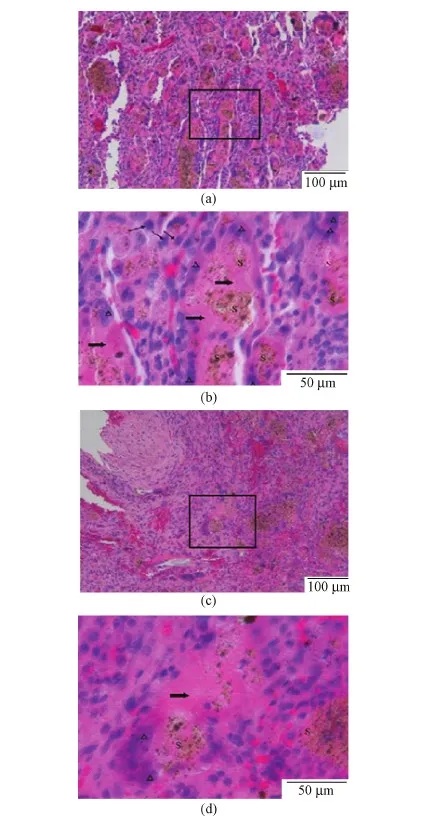
图3 材料植入后20 d骨缺损部位组织的HE染色。(a)和(c)无磁场和施加磁场下的组织;(b)和(d)(a)和(c)中黑色方框区域的放大(细箭头所指为单核巨噬细胞,粗箭头所指为新形成的骨基质,三角形所标为成骨细胞)Fig.3 HE staining of pathological on day 20 after implantation. (a) and (c) Newly formed bone tissue without and with magnetic field; (b) and (d) The magnified area of (a) and (c), respectively (Arrow: macrophage cells, bold arrow: newly formed bone matrix, triangle: osteoblast cells)
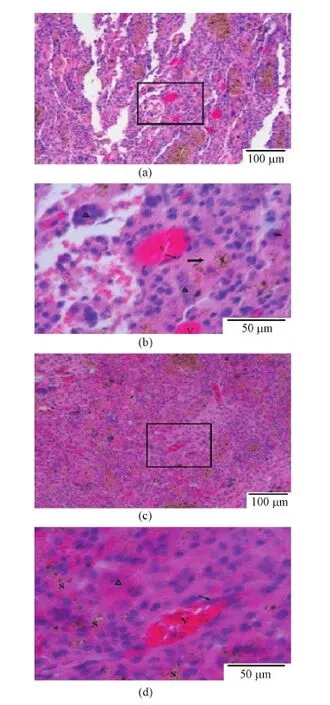
图4 材料植入20 d后骨缺损部位组织的HE染色。(a)和(c)无磁场和施加磁场下的组织;(b)和(d)(a)和(c)中黑色方框区域的放大(细箭头所指为血管内皮细胞,V所标为血管结构)Fig.4 HE staining of pathological on day 20 after implantation. (a) and (c) Newly formed bone tissue without and with magnetic field; (b) and (d) The magnified area of (a) and (c), respectively (Arrow: endothelial cells, V: vascular structure)
2.4骨基质和血管形成速度的半定量分析
通过对比材料植入后骨基质和血管结构在相同时间点的形成程度,可以评价在外加磁场下磁响应性支架诱导新骨组织形成的作用。
图5为在施加磁场或无磁场条件下,材料植入20 d后在离断部位形成的骨基质、血管结构占组织总面积的比例分析结果。可见,在施加磁场的条件下,骨基质所占的比例为4.41%,而无磁场环境下骨基质的比例为1.7%(见图5(a)),骨离断部位的植入材料中有更多的骨基质形成,提示外加磁场与磁响应性纳米纤维复合材料协同作用,显著促进了骨组织的生成;同时,当外加磁场存在时,植入的磁响应性纳米纤维复合材料支架中所形成的血管结构比例也表现出增加的趋势,提示有利于缺损部位血管的形成(见图5(b))。

图5 在施加磁场或无磁场条件下,材料植入20 d后在离断部位形成的骨基质、血管结构占组织总面积的比例(随机视野数n=12)。(a)骨基质占组织总面积比例(*P<0.05);(b)血管结构占组织总面积比例Fig.5 The percentage of newly formed bone matrix and vascular structure in the total area of tissue sample post 20 days of implantation with or without magnetic field. (a) The percentage of bone matrix(*P<0.05); (b) The percentage of vascular structure
2.4骨离断部位植入复合材料后影像学观察
由图6可见,术后10 d,材料组和材料加磁场组的离断处均可见植入材料,皮质密度较低;术后30 d,材料组和材料加磁场组的横突骨组织缺损处的密度不均匀性升高,说明开始有新骨形成,但骨皮质仍不连续;术后50 d,不论在磁场环境还是无磁场环境下,植入部位骨离断处的骨组织密度仍有不均匀性增高,部分皮质密度较低,但骨皮质已经连续,说明支架已经诱导新骨,将离断的两端连接起来;而单纯骨缺损组在术后50 d时,骨离断处的密度仍显示不均匀性升高,骨皮质明显不连续。由此表明,在横突骨组织完全离断的情况下,自我修复十分困难;而应用磁响应性纳米纤维复合材料作为支架进行修复,则会明显加快新骨组织的生成和离断部位的重建与修复。
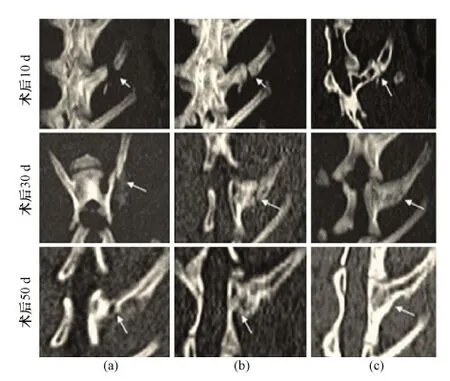
图6 横突离断条件下术后10、30、50 d CT结果(图中白色箭头所指为骨损伤部位)。(a)无植入对照组;(b)施加磁场植入组;(c)无磁场植入组Fig.6 CT images of the bone disarticulation post 10, 30 and 50 days implantation (Bone disarticulation sites pointed by white arrows). (a) Group untreated; (b) Group treated with materials with magnetic field; (c) Group treated with materials without magnetic filed
3 讨论和结论
骨是力敏感组织,骨细胞和成骨细胞均为具有骨传导功能的效应细胞。因此,在骨的再生和修复过程中,给予成骨细胞适当的力学刺激,对于新骨的形成十分重要。笔者对本实验结果进行分析后认为,植入体内的磁响应性复合材料与外源性磁场协同作用,不仅有利于成骨细胞的分化和促进其分泌细胞外基质,而且能够促进血管的生成,从而促进新骨组织的形成。上述协同效应近年来也被其他实验室陆续报道,如以羟基磷灰石为主体的超顺磁性支架在外源性磁场下促进成骨细胞的增殖和分化[17],多孔磁性羟基磷灰石支架在外加磁场下对细胞的早期增殖具有促进作用[18],聚乳酸与氧化铁磁性纳米颗粒的复合纳米纤维支架在外加磁场下引导成骨细胞沿纤维定向排列生长[19]。
此外,磁响应性支架与外加磁场的协同作用也促进其他种类细胞的生长,如Sapir等将大孔隙超顺磁性海藻酸盐支架、无磁性海藻酸盐支架分别与牛主动脉内皮细胞共培养14 d,并在前7 d均施加40 Hz、10~15 G外源性交变磁场,对照组则不施加外源性交变磁场;后7 d撤掉磁场与对照组均进行正常培养,结果发现,外源性磁场协同超顺磁性海藻酸盐支架能够明显提高内皮细胞的代谢活性,促进其迁移和形成血管样结构的能力[20]。Liu等发现,超顺磁性甘油磷酸化壳聚糖聚合物支架在外加磁场条件下,有利于施旺氏细胞的黏附和增殖,促进其分泌与神经末梢再生密切相关的细胞因子、脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、神经营养因子3(NT-3)和血管内皮生长因子(VEGF)等[21]。Fuhrer等发现,超顺磁性水凝胶支架联合周期性外源性磁场(0.8 T),能够有效地诱导人骨髓间充质干细胞(hMSC)向软骨分化,显著提高硫酸化糖胺聚糖(AGA)的沉积,从而促进软骨生成[22]。
综上所述,笔者提出如下机理假说:支架中磁性氧化铁纳米颗粒在外磁场的作用下,其磁矩由无序趋向于与磁场同向;由于与基体材料复合,磁场驱动的无数微小磁矩的趋向运动将使支架产生局部微振动和微形变,使黏附在支架上的细胞受到牵拉或者扭曲作用,支架由此将外磁场的作用转化为机械力并直接作用于细胞。这种协同效应适用于引导多种组织修复,因此该性质在生物材料支架引导组织再生方面可能具有普适性的促进作用。
[1] Sun Kang, Tian Shaoqi, Zhang Jihua,etal. Anterior cruciate ligament reconstruction with BPTB autograft, irradiated versus non-irradiated allograft: a prospective randomized clinical study[J]. Knee Surg Sports Traumatol Arthrosc, 2009,17(5):464-74.
[2] Shafiei Z, Bigham AS, Dehghani SN,etal. Fresh cortical autograftversusfresh cortical allograft effects on experimental bone healing in rabbits: Radiological, Histopathological and Biomechanical evaluation[J]. Cell Tissue Bank,2009,10:19-26.
[3] Li Xiaoming, Wang Lu, Fan Yubo,etal. Nanostructured scaffolds for bone tissue engineering[J]. J Biomed Mater Res A,2013,101(8): 2424- 2435.
[4] Lopa S, Madry H. Bioinspired scaffolds for osteochondral regeneration[J].Tissue Eng Part A,2014,20(15-16):2052-2076.
[5] Ko E, Cho SW. Biomimetic polymer scaffolds to promote stem cell-m ediated osteogenesis[J]. Int J Stem Cells,2013,6(2):87-91.
[6] Li Jianhua, Baker BA, Mou Xiaoning,etal. Biopolymer/Calcium phosphate scaffolds for bone tissue engineering[J]. Adv Healthc Mater,2014,3(4):469-484.
[7] Orr AW, Helmke BP, Blackman BR,etal. Mechanisms of mechanotransduction[J]. Dev Cell, 2006,10(1):11-20.
[8] 熊建卫, 戴闽. 静电场对成骨细胞和骨组织影响的研究进展[J]. 国际骨科学杂志, 2008,29(4): 260-261.
[9] Jaberi FM, Keshtgar S, Tavakkoli A,etal. A moderate- intensity static magnetic fields enhances repair of cartilage damage in rabbits [J]. Arch Med Res, 2011,42(4): 268-273.
[10] Brighton CT, Wang W. Seldes R,etal. Signal transduction in electrically stimulated bone cells[J]. J Bone Joint Surg Am, 2001,83(10):1514-1523.
[11] 阎启昌. 静磁场对骨组织影响的实验研究[J]. 中国医学大学学报,2001,30(4): 258-260.
[12] Wu Yao, Jiang Wen, Wen Xiantao,etal. A novel calcium phosphate ceramic-magnetic nanoparticle composite as a potential bone substitute[J]. Biomed Mater, 2010,5(1):15001.
[13] Wei Yan, Zhang Xuehui, Song Yu,etal. Magnetic biodegradable Fe3O4/CS/PVA nanofibrous membranes for bone regeneration[J]. Biomed Mater,2011,6(5): 055008.
[14] Wu Chengtie, Fan Wei, Zhu Yufang,etal.Multifunctional magnetic mesoporous bioactive glass scaffolds with a hierarchical pore structure[J]. Acta Biomater, 2011,7(10): 3563-3572.
[15] Meng Jie, Zhang Yu, Qi Xiaojin,etal. Paramagnetic nanofibrous composite films enhance the osteogenic responses of pre-osteoblast cells[J]. Nanoscale,2010,2(12): 2565-2569.
[16] Meng Jie, Xiao Bo, Zhang Yu,etal. Super-paramagnetic responsive nanofibrous scaffolds under static magnetic field enhance osteogenesis for bone repairinvivo[J]. Sci Rep, 2013,3: 2655.
[17] Zeng Xiaobo, Hu Hao, Xie Liqin,etal. Magnetic responsive hydroxy- apatite composite scaffolds construction for bone defect reparation[J]. Int J Nanomedicine,2012,7:3365-3378.
[18] Panseri S, Cunha C, D’Alessandro T,etal. Magnetic hydroxyapatite bone substitutes to enhance tissue regeneration: evaluationinvitrousing osteoblast-like cells andinvivoin a bone defect[J]. PLoS One, 2012,7(6): e38710.
[19] Li Long, Yang Guang, Li Jinrong,etal. Cell behaviors on magnetic electrospun poly-D, L-lactide nanofibers[J]. Mater Sci Eng C Mater Biol Appl, 2014,34: 252-261.
[20] Sapir Y, Cohen S, Friedman G,etal. The promotion of in vitro vessel-like organization of endothelial cells in magnetically responsive alginate scaffolds[J]. Biomaterials,2012,33(16):4100-4109.
[21] Liu Zhongyang, Huang Liangliang, Liu Liang,etal. Activation of Schwann cells in vitro by magnetic nanocomposites via applied magnetic field[J]. Int J Nanomedicine. 2014,10:43-61.
[22] Fuhrer R, Hofmann S, Hild N,etal.Pressureless mechanical induction of stem cell differentiation is dose and frequency dependent[J]. PLoS One, 2013,8(11):e81362.
Magnetic Responsive Scaffolds Enhance Bone Repair in the Applied Magnetic Field
Xiao Bo1Hao Suisui2Wu Fengxin2Meng Jie2Zhang Yu3Liu Jian2Huang Yuguang1Gu Ning3#*Xu Haiyan2#*
1(Department of Anesthesia, Peking Union Medical College Hospital, Chinese Academy of Medical Science Sciences & Peking Union Medical College, Beijing 100730, China)2(Institute of Basic Medical Sciences Chinese Academy of Medical Sciences, School of Basic Medicine Peking Union Medical College, Beijing 100005, China)3( School of Biological Science and Medical Engineering, State Key Laboratory of Bioelectroncs, Southeastern University, Nanjing 210096, China)
Bone tissue cannot accomplish self-healing in critical size bone defects resulted from trauma, infection, tumor and congenital malformation. Using biomaterials that induce bone tissue regeneration to repair bone defects is an extremely important therapeutic strategy. However, slow bone formation is one of the difficulties in biomaterial-induced bone regeneration. In this work, a magnetic responsive nanofibrous composite film was fabricated with poly lactide acid (PLA), hydroxyapatite nanoparticles (nHA) and γ-Fe2O3nanoparticles (γ-Fe2O3NP) using electrospinning technique. The film was folded into a 3D scaffold that suitable for implantation in bone defect sites. The relationship between magnetic properties of composite materials and the percentage of iron oxide magnetic nanoparticles was investigated using vibrating sample magnetometer (VSM). The microstructure of films was observed by scanning electron microscopy (SEM). The effect of magnetic responsive composites on inducing bone repair and regeneration in situ under an applied magnetic field was evaluated in bone transverse process disartitulation model of 12 healthy male New Zealand rabbits after 10,30,50 days implantation. Results indicate that the composite display a strong paramagnetic property and show a positive correlation with the proportion of iron oxide nanoparticles. In an applied magnetic field, the bone tissue regeneration in the disarticulation sites was accelerated with the guidance of the composite scaffold.
bone repair, iron oxide magnetic particles, composite, nanofibrous scaffold
10.3969/j.issn.0258-8021. 2015. 03.010
2015-03-20, 录用日期:2015-04-30
国家自然科学基金项目(81471793)
R318
A
0258-8021(2015) 03-0330-07
# 中国生物医学工程学会会员(Member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: guning@seu.edu.cn;xuhy@pumc.edu.cn
