血管平滑肌细胞前胶原α-多肽增龄性改变影响血管重构的机制初探
2015-09-16魏美连荣瑗瑗王莹康维强宋达琳
魏美连 荣瑗瑗 王莹 康维强 宋达琳
基础研究
血管平滑肌细胞前胶原α-多肽增龄性改变影响血管重构的机制初探
魏美连 荣瑗瑗 王莹 康维强 宋达琳
目的 探讨增龄影响下大鼠血管平滑肌细胞(VSMC)前胶原α-多肽的改变及潜在的可能机制。方法 通过对刚出生的幼龄(对照组)和9个月成年(成年组)健康雄性Wistar大鼠的胸腹主动脉进行体外试验,采用RT-PCR半定量和定量技术检测VSMCⅠ型和Ⅲ型前胶原α-多肽mRNA,通过VG染色、Western blot及ELISA方法检测前胶原α-多肽蛋白表达。结果 RT-PCR半定量结果显示,Ⅰ型前胶原α-多肽mRNA对照组为76.62±1.05,成年组为78.37±2.42,两组比较未见统计学差异(P>0.05);Ⅲ型前胶原α-多肽mRNA对照组为105.4±2.66,成年组为123.1±3.81,两组比较未见统计学差异(P>0.05)。Ⅰ型前胶原α-多肽mRNA定量成年组为4.63±1.03,但与对照组3.13±0.54比较未见统计学差异(P=0.05);Ⅲ型前胶原α-多肽mRNA定量成年组为7.68±0.63,与对照组6.86±0.41比较未见统计学差异(P>0.05)。Ⅰ型前胶原α-多肽蛋白表达在成年组为0.1±0.03,对照组为0.06±0.03,两组比较差异有统计学意义(P<0.05);Ⅲ型前胶原α-多肽蛋白表达在成年组为0.58±0.06,对照组为0.4±0.02,差异有统计学意义(P<0.05)。结论 前胶原α-多肽增龄性变化的调节通路是老化性血管重构的分子机制之一。
增龄; 血管重构; 血管平滑肌细胞; 前胶原α-多肽
1 材料与方法
1.1 实验动物及分组 选择刚出生(对照组)和9个月(成年组)的雄性Wistar大鼠各12只,购于青岛医学实验动物中心。实验大鼠分笼饲养。所有试验操作均得到青岛市市立医院伦理委员会批准。
1.2 方法
1.2.1 大鼠VSMC培养、传代和鉴定实验 分离大鼠胸腹主动脉在Hank′s液中培养,转入无菌室;除血凝块、血管外膜层、小分支和内膜层内皮细胞;1 mm血管组织至20%胎牛血清的DMEM中贴壁培养3~5 d,组织块的间距为0.5 cm。0.25%胰蛋白酶消化,使细胞脱离消化液,在倒置纤微镜下观察。免疫组化鉴定:特异性鼠抗α-平滑肌肌动蛋白单克隆抗体,采用SP法对细胞爬片进行免疫组织化学染色。镜下观察到细胞爬片,可见细胞浆内大量平行阳性染色,胞核不着色;所有细胞染色,结果均为阳性。
1.2.2 大鼠VSMC前胶原α-多肽mRNA RT-PCR半定量分析和Real-time定量分析 取大鼠胸腹主动脉 VSMC,TRIzol(Invitrogen)提取总 RNA。RTPCR半定量检测Ⅰ型和Ⅲ型前胶原α-多肽(Col-1α和Col-3α)mRNA的变化。PCR半定量按如下程序进行:95 ℃,3 min;94 ℃,20 s;55 ℃,20 s;72 ℃,20 s;32个循环后72℃延伸5 min。引物相见表1。
Real-time定量分析反应混合物:2×SYBR Green PCR Master Mix 5 μl,Forward Primer(2 μm,微 米)0.5 μl,Reverse Primer (2 μm,) 0.5 μl,RNase-free ddH2O 3.5 μl,cDNA 第一链模板 0.5 μl。程序进行荧光定量反应:50 ℃,2 min;95 ℃,10 min;95 ℃,20 s;58 ℃,20 s;72 ℃,20 s;40 个循环。
1.2.3 大鼠胸腹主动脉前胶原α-多肽蛋白表达的VG染色、IHC和Western blot检测 取大鼠新鲜胸腹腔主动脉一段,Tissue TekRO.C.T.Compound冰冻切片包埋剂包埋,直接冻结切片;乙醇固定后苏木素染细胞核;冲洗后VG染色液染色;镜检,胶原纤维红色、肌纤维黄色、胞核蓝色。组织切片依次封闭、一抗、抗小鼠生物素化二抗和HRP标记链亲和素,进行IHC检测。
Western blot蛋白定量:胸腹主动脉加入裂解液,匀浆,冰孵并离心,收集上清液,蛋白浓度用BCA法(Bio-Rad公司)测定。在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。100℃或沸水浴加热3~5 min,以充分变性蛋白。冷却到室温后,把蛋白样品直接上样到SDS-PAGE观察电泳效果和转膜效果,以及判断蛋白相对分子质量大小,使用预染蛋白质分子量标准(MBI)。使用Bio-Rad的标准湿式转膜装置,将凝胶上蛋白印记至硝酸纤维素膜(NC膜)。丽春红染色液对膜进行染色,以观察实际的转膜效果。分别在一抗和二抗结合后,使用ECL类试剂检测蛋白。成像系统采集实验结果。

表1 Ⅰ型胶原和Ⅲ型胶原α-多肽mRNA实时荧光PCR半定量用引物
1.2.4 大鼠胸腹主动脉前胶原ELISA定量分析 取两组Wistar大鼠新鲜胸腹主动脉一段称重(固定重量),组织匀浆后加入5 ml PBS并用枪轻轻吹打洗涤,2500 rpm离心5 min,取上清,分装于0.5 ml EP管中并置于-20℃保存。统一采用大鼠Ⅰ型和Ⅲ型前胶原ELISA试剂盒(PCⅠELISA kit,PCⅢ ELISA kit)定量检测前胶原浓度。
1.3 统计学方法 应用SPSS 13.0软件分析数据。计量资料以±s表示,两组数据之间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠VSMC前胶原α-多肽mRNA RT-PCR半定量分析 Ⅰ型和Ⅲ型前胶原α-多肽mRNA在两组之间未见统计学差异(P>0.05);VSMC前胶原α-多肽mRNA Real-time定量结果显示,Ⅰ型前胶原α-多肽mRNA在成年组升高,但未见统计学差异(P=0.05);Ⅲ型前胶原α-多肽mRNA两组之间未见统计学差异(P>0.05)。见表2。
表2 两组大鼠VSMC前胶原α-多肽mRNA半定量及定量的比较(±s)

表2 两组大鼠VSMC前胶原α-多肽mRNA半定量及定量的比较(±s)
组别 例数 Col-1α mRNA Col-3α mRNA半定量 定量 半定量 定量对照组 12 76.62±1.05 3.13±0.54 105.40±2.66 6.86±0.41成年组 12 78.37±2.42 4.63±1.03 123.10±3.81 7.68±0.63 P值 >0.05 >0.05 >0.05 >0.05
2.2 前胶原α-多肽蛋白表达的Western blot检测VG染色前胶原α-多肽蛋白表达结果见图1。Western blot检测结果显示,两类前胶原α-多肽蛋白在老龄组显著升高(P<0.05),见图2。
2.3 大鼠胸腹主动脉前胶原ELISA检测 成年组与对照组比较,ELISA显示 OD值升高,PCⅠ(76.0±5.2)ng/ml比(64.0±4.2)ng/ml,PCⅢ(78.0±5.3)ng/ml比(66.0±4.3)ng/ml,差异有统计学意义(P均<0.05),结果与Western blot检测结果一致。
3 讨论
本研究表明,大鼠VMSC的Ⅰ型和Ⅲ型前胶原α-多肽表达存在增龄性改变;但是这两个年龄组尚未出现Ⅰ型和Ⅲ型前胶原α-多肽mRNA水平的差异,提示前胶原α-多肽增龄性变化的调节通路可能是血管重构的分子机制之一。
我们前期曾通过临床研究创新性地提出年龄是影响血管重构的独立因素,并首次提出血管重构的增龄机制[6],还认为探讨年龄影响血管重构的分子基础在于VSMC和其分泌胶原的增龄性调节机制。
通常认为,VSMC决定动脉管壁的结构特点,涉及生长、发育、重构及修复[15];VSMC的增殖及迁移是血管重构过程中的核心过程[16]。VSMC可以合成及分泌胶原,它是动脉细胞外基质最丰富的成分。动脉壁胶原的增加不仅导致血管壁结构的改变,还增加了动脉的硬度,是动脉粥样硬化发展及心血管疾病的主要原因[17-19]。血管壁的平衡性、稳定性及柔软度取决于两种蛋白——胶原蛋白及弹力蛋白,而弹力蛋白性能的显著变化及胶原合成的刺激与年龄有关[4]。主动脉包括不同的胶原类型,主要由Ⅰ型和Ⅲ型胶原组成[20]。由于Ⅰ型前胶原和Ⅲ型前胶原是成熟胶原的前体分子,因此它们的水平可以反映胶原合成的程度[21,22]。
胶原生物合成是一个复杂的过程,涉及众多细胞内和细胞外的步骤。简单地说,在核糖体上按照特定的胶原mRNA的碱基序列翻译成不成熟前胶原α-多肽后的第一个步骤就是导入粗面内质网腔,在粗面内质网腔经过一系列的翻译后修饰合成了前胶原分子[23]。见图3。
胶原与其他多亚基蛋白的装配和分泌的模式相同。细胞摄取合成肽链所需的氨基酸,包括脯氨酸、赖氨酸和甘氨酸,在粗面内质网的核糖体上按照特定的胶原mRNA的碱基序列翻译,并在羟化酶的作用下,将肽链中的脯氨酸和赖氨酸羟化;经羟化后3条前胶原α-多肽链互相缠绕成绳索状的前胶原蛋白分子。溶解状态的前胶原蛋白分子两端未缠绕呈球状构型,在粗面内质网腔内或转移到高尔基复合体内加入糖基后分泌到细胞外,再由前胶原转变为原胶原分子,最终聚集和共价形成胶原微纤维,进而聚合形成胶原纤维和胶原束[24,25]。见图4。
本研究两组不同年龄大鼠的前胶原α-多肽基因转录未见统计学差异。如何解释这一现象,主要在于老化影响DNA既存在损伤又可以被修复[26]。新的观点还认为,细胞衰老是一个复杂的动态发展的多步骤过程,而从老化的速度来看存在着急性与慢性之分[27]。因此,本试验的年龄分组可能不完全模拟衰老的过程,而在某一年龄段内基因水平可能不依赖增龄而改变。
前胶原α-多肽增龄性改变的调节机制可能主要来自核糖体翻译,而关于老化过程中核糖体作用的研究确实也是当前学术研究的热点。在核糖体按照特定的mRNA的碱基序列翻译成不成熟前胶原α-多肽的过程中,还显示了寡核糖体RNA(rRNA)核苷酸的修饰功能,这导致了生物机能的改变和依赖rRNA调节的翻译改变寿命和应激反应[28]。有研究表明,核糖体亚单位本身指导监管功能基因组的翻译,调节特定的mRNA结合和组件之间的交互翻译;翻译前mRNA特异性地结合VSMC的40 s核糖体亚单位可能选择地影响多肽链的生成率[29]。
然而,关于增龄影响VSMC前胶原α-多肽基因转录和其蛋白表达的机制争论激烈。线粒体能量代谢及氧化应激一直是研究的核心。新的动物实验显示[30],过氧化物酶体增生物激活受体γ共激活因子PGC-1α/β信号通路在老化过程中扮演重要角色,老化调节PGC-1α/β信号通路影响线粒体与细胞核之间的通讯,导致线粒体核蛋白体介导的多肽合成及将线粒体氧化磷酸化(OXPHOS)改变,但细胞核基因转录未见明显的年龄依赖性改变。
本研究初步探讨了血管平滑肌细胞前胶原α-多肽变化影响增龄性血管重构的机制,从分子水平揭示增龄性血管重构的关键,为老化机制理论的深入探索奠定基础,并为未来抗血管老化和动脉硬化的研究提供依据。

图1 不同年龄组大鼠胸腹主动脉前胶原α-多肽蛋白表达(VG染色×100)

图2 不同年龄组大鼠前胶原α-多肽蛋白Western blot检测
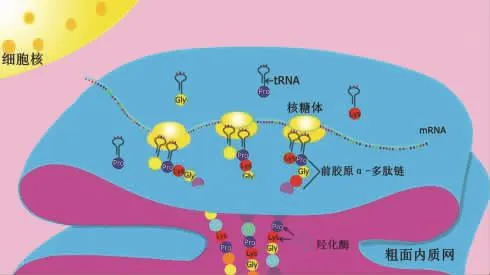
图3 前胶原α-多肽的翻译过程示意图

图4 胶原合成过程示意图
[1]Glagov S,Bassiouny HS,Sakaguchi Y,et al.Mechanical determinants of plaque modeling, remodeling and disruption.Atherosclerosis,1997,131:S13-14.
[2]Langille BL,O′Donnell F.Reductions in arterial diameter produced by chronic decreases in blood flow are endothelium-dependent.Science,1986,231:405-407.
[3]de Kleijn DP,Sluijter JP,Smit J,et al.Furin and membrane type-1 metalloproteinase mRNA levels and activation of metalloproteinase-2 are associated with arterial remodeling.FEBS Lett,2001,501:37-41.
[4]Mirea O,Donoiu I,Plesea IE.Arterial aging:a brief review.Rom J Morphol Embryol,2012,53:473-477.
[5]Durante W.Role of arginase in vessel wall remodeling.Front Immunol,2013,4:111.
[6]Song DL,Kang WQ,Woelki H,et al.Biomarker,age and coronary artery remodeling in patients with acute artery syndrome.Am J Geriatr Cardiol,2008,17:71-77.
[7]Julie CW,Martin B.Aging and Atherosclerosis:Mechanisms,Functional Consequences,and Potential Therapeutics for Cellular Senescence.Circulation Research,2012,111:245-259.
[8]Regan CP.Molecular mechanisms of decreased smooth muscle differentiation marker expression after vascular injury.J Clin Invest,2000,106:1139-1147.
[9]Sartore S,Scatena M,Chiavegato A,et al.Myosin isoform expression in smooth muscle cells during physiological and pathological vascular remodeling.J Vasc Res,1994,31:61-81.
[10]William D.Role of arginase in vessel wall remodeling.Frontiers in immunology,2013,4:1-12.
[11]Garcia M,Ghassan S.Right coronary artery becomes stiffer with increase in elastin and collagen in right ventricular hypertrophy.J Appl Physiol,2009,106:1338-1346.
[12]Touyz RM,Deng LY,He G,et al.AngiotensinⅡ stimulates DNA and protein synthesis in vascular smooth muscle cells from human peripheralresistance arteries:role ofextracellular signal-regulated kinases.J Hypertens,1999,17:907-917.
[13]Díez J.Arterial stiffness and extracellular matrix.Adv Cardiol,2007,44:76-95.
[14]Holzapfel GA.Collagen in arterial walls:biomechanical aspects,collagen structure and mechanics.Springer Publisher,2008:311-319.
[15]Jackson CL,Schwartz SM.Pharmacology of smooth muscle cell replication.Hypertension,1992,20:713-736.
[16]Muyao Li,Naomi KF.Age-Related Changes in Redox Signaling and VSMC Function.Antioxidants&Redox Signaling,2010,12:641-655.
[17]Kearney TM,Murphy MH,Gallagher AM,et al.Accumulated brisk walking reduces arterial stiffness in overweight adults:Evidence from a randomized control trial.J Am Soc Hypertens,2014,8:117-126.
[18]Rammos C,Hendgen-Cotta UB,Deenen R,et al.Age-related vascular gene expression profiling in mice.Mech Ageing Dev,2014,135C:15-23.
[19] AsiaPacificCohortStudiesCollaboration.Theimpactof cardiovascular risk factors on the age-related excess risk of coronary heart disease.Int J Epidemiol,2006,35:1025-1033.
[20]López B,González A,Querejeta R,et al.The use of collagenderived serum peptides for the clinical assessment of hypertensive heart disease.J Hypertens,2005,23:1445-1451.
[21] Koivula MK,Risteli L,Risteli J, et al.Measurement of aminoterminal propeptide of type Ⅰ procollagen(PINP) in serum.Clin Biochem,2012,45:920-927.
[22]Díez J,Laviades C,Monreal I,et al.Toward the biochemical assessment of myocardial fibrosis in hypertensive patients.Am JCardiol,1995,76:14-17.
[23] Myllyharju J.Intracellular post-translational modifications of collagens.Top Curr Chem,2005,247:115-247.
[24]Peter F.Collagen,sructure and mechanics.New York:Springer Science Business Media,2008:33-41.
[25]Niebler S,Bosserhoff AK.The transcription factor activating enhancer-binding protein epsilon (AP-2ε)regulates the core promoter of type IIcollagen(COL2A1).FEBS J,2013,17:335-338.
[26]Carlos LO,Maria AB,Linda P,et al.The Hallmarks of Aging.Cell,2013,153:1194-1217.
[27]van Deursen JM.The role of senescent cells in ageing.Nature,2014,22,509:439-446.
[28]Schosserer M,Minois N,Angerer TB,et al.Methylation of ribosomal RNA by NSUN5 is a conserved mechanism modulating organismal lifespan.Nat Commun,2015,6:6158-6172.
[29]Mauro VP,Edelman GM.The ribosome filter hypothesis.PNAS,2002,99:12031-12036.
[30] Ana PG,Nathan LP,Alvin JYL,et al.Declining NAD+Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging.Cell,2013,155:1624-1638.
Mechanism on age-related changes of procollagen alpha polypeptide effecting vascular remodeling in rat vascular smooth muscle cell
WEI Mei-lian*,RONG Yuan-yuan,WANG Ying,et al.*Profession of Geriatric Cardiology,the Medical College of Qingdao University,Qingdao 266071,China
SONG Da-lin,E-mail:dsong55cn@aliyun.com
Objective To investigate the age-related changes of procollagen alpha polypeptide gene mRNA and protein expression in rat vascular smooth muscle cell(VSMC)and the possible underlying mechanisms.Methods For in vitro culture of VSMC from thoracoabdominal aorta in neonate and 9 months old healthy male Wistar rats,procollagen alpha polypeptide mRNA and procollagen alpha polypeptide protein expression were detected,using of RT-PCR,VG staining,Western blot and ELISA methods.Results Real-time polymerase chain reaction(RT-PCR)Semi quantitative displays that there was no significant difference between the two groups of typeⅠ and typeⅢ collagen α polypeptide chain mRNA.RT-PCR quantitative result displays that type Ⅰ collagen α polypeptide chain mRNA increased in adult group,but no significant difference(P=0.05),there was no significant difference between the two groups of type Ⅲ collagen α polypeptide chain mRNA(P>0.05).Both typeⅠand typeⅢ procollagen alpha polypeptide protein expression were increased significantly in adult group as compared with the young group(P<0.05).Conclusion Regulatory pathway on age-related changes of procollagen al-pha polypeptide is one of the molecular mechanisms of aging vascular remodeling.
Aging; Vascular remodeling; Vascular smooth muscle cell; Procollagen alpha polypeptide血管重构与动脉粥样硬化、支架内再狭窄、静脉瓣膜疾病及移植相关的静脉病变有关。血管重构包括动脉收缩或扩张时动脉壁结构的改变[1],与持续血流剪切力的变化[2,3]及血管分泌功能不全有关[4,5]。前期研究提出增龄(或老化,aging)是影响血管重构的独立因素[6,7]。然而,增龄影响血管重构的分子机制还需要进一步研究。目前的研究提示,血管平滑肌细胞(VSMC)的表型调制和异常增殖是增龄性血管重构的关键因素[8-10],且VSMC合成和分泌细胞外基质蛋白,包括胶原、弹力蛋白和蛋白聚糖。胶原和弹力蛋白的高表达导致血管硬化[11]。而胶原Ⅰ型和Ⅲ型合成和分泌的增加,在动脉壁重建、动脉瘤形成、动脉粥样硬化纤维帽的稳定性方面有主要作用[12]。增龄与胶原和弹力蛋白的定量和定性变化相关[13],可能的结构性改变之一是胶原蛋白的重新定位[14]。本研究通过体外观察VSMC前胶原α-多肽mRNA和前胶原的变化,旨在探讨增龄对VSMC前胶原α-多肽基因转录和蛋白表达的影响。
山东省青岛市科技发展指导计划项目(项目编号:2010KZJ-7)
作者单位:266071 山东省青岛市,青岛大学临床医学院(魏美连);青岛大学附属青岛市市立医院老年内科(荣瑗瑗、康维强、宋达琳);大连医科大学第一临床学院(王莹、宋达琳)
宋达琳,E-mail:dsong55cn@aliyun.com
10.3969/j.issn.1672-5301.2015.09.021
Q95-33;R543
A
1672-5301(2015)09-0851-05
2015-04-28)
