瘦素对大鼠血管张力的影响及机制研究
2015-09-15陈岳林沈粤春
陈岳林 沈粤春
基础研究
瘦素对大鼠血管张力的影响及机制研究
陈岳林 沈粤春
目的 探讨瘦素对Wistar大鼠胸主动脉环血管张力改变及其影响因素。方法 15只雄性Wistar大鼠,按以下分组:①PBS对照组(C);②0.1 mg/kg低浓度瘦素注射组(L);③0.5 mg/kg高浓度瘦素注射组(H)。注射7 d。记录大鼠日进食量、体重,测量平均动脉压(MAP);测定胸主动脉环对各种血管活性药物的反应性;酶联免疫吸附法测定血清中6-酮前列腺素F1α(6-Keto PGF1α)和血栓素B2(TXB2)水平。结果注射瘦素第 2天即明显抑制大鼠进食量[H(21.75±2.41)g比 L(23.84±0.74)g比 C(28.54±1.15)g]。H 组大鼠体重在第 4 天开始显著下降[H(259.25±9.31)g比 C(272.75±12.92)g,P<0.05],持续至第 7天[H(257.5±7.96)g比 C (281.25±11.28)g,P<0.01]。与 C组比较,L组和 H 组 MAP无显著升高[H(80.73±5.56)mm Hg比 L(83.45±7.47)mm Hg比 C(84.53±2.17)mm Hg,P>0.05]。胸主动脉环对血管收缩剂(苯肾上腺素、花生四烯酸)的张力无显著改变[10-3M 苯肾上腺素收缩百分比,H(133.64±26.06)%比L(146.98±20.34)%比C(140.91±22.17)%,P>0.05;10-5M 花生四烯酸收缩百分比,H(22.52±1.55)%比 L(23.78±2.43)%比 C(22.76±1.1)%,P>0.05]。但H组由一氧化氮(NO)介导的内皮细胞依赖性血管舒张剂乙酰胆碱(Ach)和缓激肽(BK)引起的舒张加强,Ach 半大效应浓度值减少(EC50)[H(-6.33±0.11)比 C(-5.69±0.12),P<0.05]。瘦素加强 BK的舒张作用被内皮型一氧化氮合成酶抑制剂L-NAME明显抑制。H组体重变化与Ach最大舒张值百分比(Emax)呈正相关(r=0.737,P<0.05)。另外,H 组血清 TXB2水平显著升高[H(60.15±8.84)ng/ml比 C(50.44±6.4)ng/ml,P<0.05]。结论 较长时间注射瘦素虽上调血小板收缩血管物质TXB2的表达,但综合效应是增强动脉内皮细胞依赖的舒张功能,这与舒血管物质6-Keto PGF1α无关,而与增加内皮细胞NO表达及注射瘦素后摄食量减少、体重减轻、内皮细胞舒张功能改善有关。此研究结果为减肥防治高血压提供了客观依据。
瘦素; 内皮细胞; 环氧化酶-2; 前列环素; 血栓素; 血管张力
瘦素是一种由肥胖基因(ob基因)编码的、167个氨基酸组成、相对分子质量约16 KDa的蛋白质产物,或称为蛋白类激素,主要由脂肪细胞合成和分泌。瘦素进入血液循环后,作用于中枢和外周不同亚型的瘦素受体,主要功能是通过中枢系统抑制食欲、增加能量消耗以调节能量平衡[1]。瘦素还具有广泛的生物学效应,如调节免疫、炎症、造血等[1]。短时间(30 min)内使用超生理剂量(160 ng/ml)瘦素能增加内皮细胞表达内皮型一氧化氮合成酶(eNOS)[2],而使用生理剂量(10 ng/ml)瘦素能上调神经型一氧化氮合成酶(nNOS)的表达[3]。但较长时间(7 d)注射大剂量(1 μg·kg-1·min-1)瘦素却能通过激活交感神经[4]、增加肾内氧化应激[5]等方式升高平均动脉压(MAP)。目前关于较长时间注射瘦素的动物血管环对血管活性物质的反应性改变尚不明确,本研究将就此方面展开探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄SPF级雄性Wistar大鼠15只(中山大学实验动物中心)。
1.1.2 主要试剂 花生四烯酸(AA)(美国Sigma公司);缓激肽(BK)(美国 Merck公司);N-(2-甲氧基环己烷-4硝基)甲砜胺(NS-398)、N-硝基-L-精氨酸甲酯盐酸盐(L-NAME)(上海碧云天);6-Keto PGF1α酶联免疫吸附测定(ELISA)试剂盒(美国Cayman公司);重组大鼠瘦素、TXB2Elisa试剂盒(美国 R&D公司);Krebs-Henseleit(K-H)溶液(NaCl 118 mM,KCl 4.7 mM,CaCl22.5 mM,MgSO41.2 mM,KH2PO41.2 mM,NaHCO325 mM,Glucose 11 mM)(广州化学试剂厂)。
1.1.3 主要器材 无创鼠尾血压计(美国Kent公司);JZ300型高精度张力换能器(量程5 g,北京新航兴业科贸公司);PowerLab数据采集分析系统(澳大利亚AD Instruments公司)。
1.2 方法
1.2.1 分组 将Wistar大鼠随机分成3组:①PBS对照组(C组),注射生理盐水;②0.1 mg/kg低浓度瘦素注射组(相当于瘦素缺乏型小鼠生理补充剂量,L组);③0.5 mg/kg高浓度瘦素注射组(5倍生理补充剂量,H组)。分别向腹腔内注射等体积药物7 d。SPF级饲养环境,自由进食,昼夜时长为12 h∶12 h,记录日进食量、体重及注射瘦素2 h后MAP。
1.2.2 大鼠离体胸主动脉环制备及张力测定 大鼠麻醉,胸主动脉分离,血管环制备及固定参考付阳等[6]方法。麻醉后从右心室抽取3 ml血液用于Elisa实验。每只大鼠制备3条血管环,共15条/组。置37℃ K-H溶液中,平衡60 min,隔15 min更换K-H溶液,调整基础张力值为2 g。用60 mM氯化钾(KCl,预激液)预收缩平衡后,更换K-H溶液,并重复1次。分别测量10-3M苯肾上腺素(Phe,α受体激动剂);10-5M AA(环氧合酶作用底物)及预先孵育3μM NS-398(选择性COX-2抑制剂)[7]30 min后再加入AA各组的张力值。分别测量10-3M Phe预收缩稳定后依次加入不同浓度(10-8~10-3M)乙酰胆碱(Ach,内皮细胞依赖的血管舒张剂);(10-8~10-5M)BK(内皮细胞依赖的血管舒张剂);(10-9~10-3M)硝普钠(SNP,非内皮细胞依赖的血管舒张剂)及预先孵育0.3 mM内皮型一氧化氮合成酶抑制剂 L-NAME 30 min,再加入10-5M测各组的张力值。通过LabChart 7.2读出张力数据,使用GraphPad Prism 5对曲线进行非线性拟合计算半大效应浓度值(concentration for 50%maximal effect,EC50)。
1.2.3 酶联免疫吸附测定 采用ELISA(竞争法)测定各组血清中6-Keto PGF1α和TXB2水平。严格按照各自Elisa说明书进行:血清经离心、2倍稀释、配制标准品、加样、加酶标抗体、显色、孵育及终止反应后,30 min内在酶标仪波长为405 nm处读出各组6-Keto PGF1αOD值,在450 nm处读出各组TXB2OD值。根据OD值及Elisa说明书公式计算出各标准品及待测样品B/B0%。利用Curve Expert 1.3对曲线拟合后得出各自公式,根据公式计算待测样品浓度。
1.3 统计学方法 采用SPSS 13.0统计软件进行统计。数据用±s表示,两组间比较采用独立样本t检验,进食量及张力值采用重复测量方差分析进行组间均值比较。当差异存在显著性时,方差齐性用Bonferroni法,方差不齐用Dunnett′s T3进行两两比较。P<0.05时认为差异有统计学意义。
2 结果
2.1 瘦素对进食量、体重及MAP的影响 注射瘦素第2天后大鼠进食量即开始减少,以H组最为明显。两瘦素注射组抑制大鼠进食量均在第4天达高峰,L组在5 d后不再显著抑制进食量(P>0.05),但H组持续至第7天(图1)。在第4天及第7天观察大鼠体重,与C组比较,注射瘦素后各组体重均有下降趋势,L组变化不显著,但H组体重显著减轻(图2)。随注射时间的延长,各组MAP均有升高趋势,但与C组比较,未见统计学差异(P>0.05)。见表1。
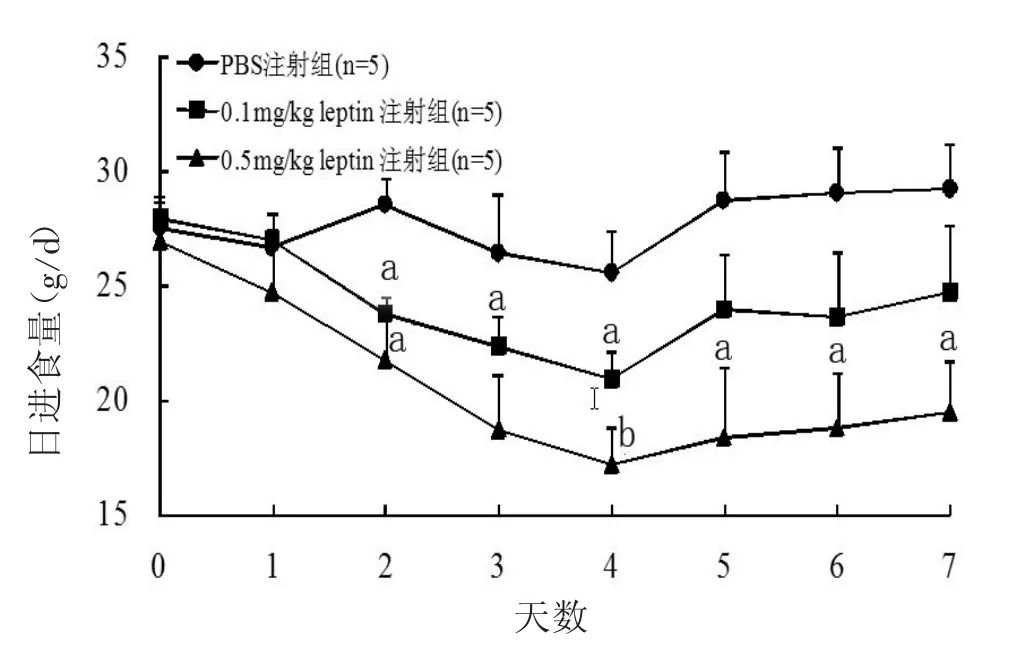
图1 注射瘦素对Wistar大鼠日进食量的影响
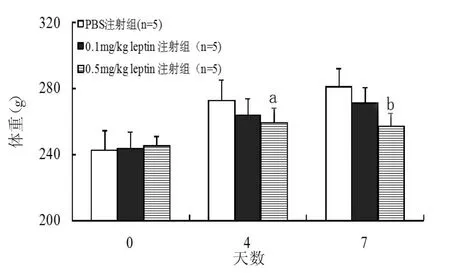
图2 注射瘦素对Wistar大鼠第0、4、7天体重的影响
表1 注射不同浓度瘦素对Wistar大鼠平均动脉压(MAP)的影响(±s)
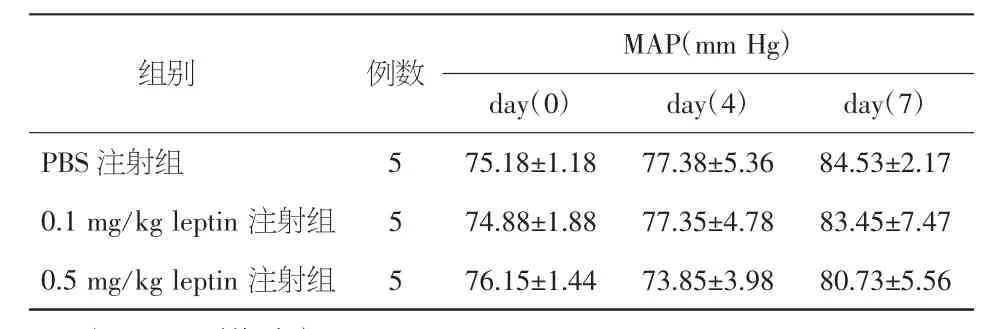
表1 注射不同浓度瘦素对Wistar大鼠平均动脉压(MAP)的影响(±s)
注:MAP:平均动脉压
组别 例数 MAP(mm Hg)day(0) day(4) day(7)PBS 注射组 5 75.18±1.18 77.38±5.36 84.53±2.17 0.1 mg/kg leptin 注射组 5 74.88±1.88 77.35±4.78 83.45±7.47 0.5 mg/kg leptin 注射组 5 76.15±1.44 73.85±3.98 80.73±5.56
2.2 注射瘦素后胸主动脉环血管张力的改变 注射瘦素7 d后Wistar大鼠胸主动脉环对10-3M Phe引起的收缩无显著影响。以60 mM KCl收缩为100%作为对照,H 组[(133.64±26.06)%]比 L组[(146.98±20.34)%]比 C 组[(140.91±22.17)%],P均>0.05。瘦素对10-5M AA及预先孵育3μM NS-398 30 min后再加入10-5M AA引起的收缩也无显著改变(图3)。但H组由NO介导的内皮细胞依赖性血管舒张剂Ach和BK引起的舒张均加强(图4、5),Ach EC50值减小(表 2)。为了进一步说明高浓度瘦素加强由NO介导的内皮细胞依赖性舒张功能,研究通过预先孵育0.3 mM L-NAME 30 min后加入10-5M BK,瘦素加强BK的舒张效应消失(表2),由SNP引起的非内皮细胞依赖的舒张功能并未发生改变(表2)。H组体重变化与Ach Emax呈正相关,r=0.737,P<0.05,与 Ach EC50相关性不显著,r=0.648,P>0.05。
2.3 瘦素对血清6-Keto PGF1α和TXB2表达水平的影响 注射瘦素7 d后对大鼠血清中6-Keto PGF1α表达水平无影响,各组间差异无统计学意义,但高浓度瘦素组血清TXB2水平显著升高。各组TXB2/6-Keto PGF1α比值未见统计学差异。见表3。
3 讨论
瘦素是一种作用广泛的内分泌激素,除抑制摄食外,还有调节免疫、炎症、造血等生物学效应[1]。研究发现,在离体实验中,瘦素通过促进平滑肌肥大[8]、上调内皮素-1[9]及醛固酮表达[10]等方式参与高血压的发病。在活体实验中不断发现,长期注射瘦素的动物通过激活交感神经[4]、氧化应激[5]、增加肾内Na+-K+-ATP酶活性[11]等方式参与高血压的发病。但也有关于瘦素增加内皮细胞表达一氧化氮(NO)[3]、释放内皮细胞衍生性超级化因子(EDHF)[12]从而起舒张血管作用的报道。而目前关于较长时间注射瘦素后动物内皮细胞依赖性舒张功能改变尚不明确。
表2 注射不同浓度瘦素7 d后Wistar大鼠胸主动脉环对血管舒张剂EC50及Emax的改变(±s)
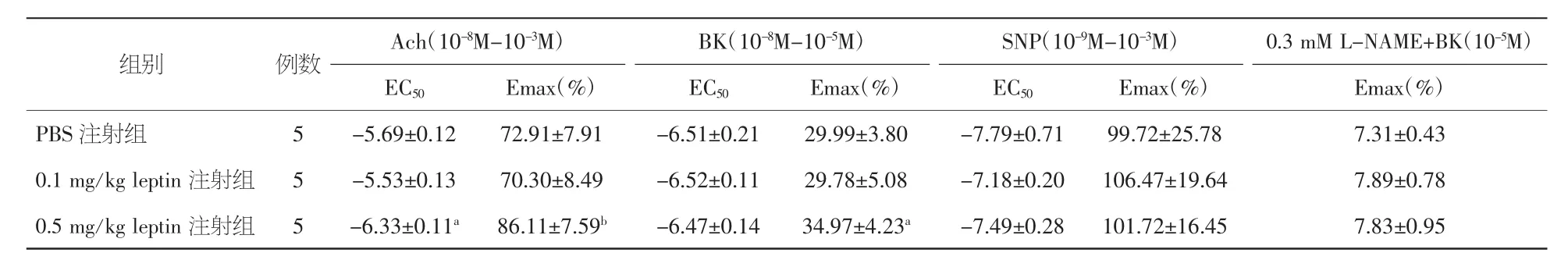
表2 注射不同浓度瘦素7 d后Wistar大鼠胸主动脉环对血管舒张剂EC50及Emax的改变(±s)
注:Ach:乙酰胆碱;BK:缓激肽;SNP:硝普钠;L-NAME:选择性内皮型一氧化氮合成酶抑制剂;EC50:半大效应浓度值;Emax:最大舒张值。与PBS注射组比较,aP<0.05,bP<0.01
组别 例数 Ach(10-8M-10-3M) BK(10-8M-10-5M) SNP(10-9M-10-3M)EC50 Emax(%) EC50 Emax(%) EC50 Emax(%)PBS 注射组 5 -5.69±0.12 72.91±7.91 -6.51±0.21 29.99±3.80 -7.79±0.71 99.72±25.78 0.1 mg/kg leptin 注射组 5 -5.53±0.13 70.30±8.49 -6.52±0.11 29.78±5.08 -7.18±0.20 106.47±19.64 0.5 mg/kg leptin 注射组 5 -6.33±0.11a 86.11±7.59b -6.47±0.14 34.97±4.23a -7.49±0.28 101.72±16.45 0.3 mM L-NAME+BK(10-5M)Emax(%)7.31±0.43 7.89±0.78 7.83±0.95
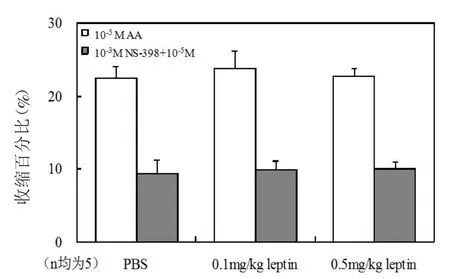
图3 注射瘦素7 d,Wistar大鼠胸主动脉环对10-5M AA及预先孵育10-3M NS-398 30 min后加入10-5M AA收缩百分比改变
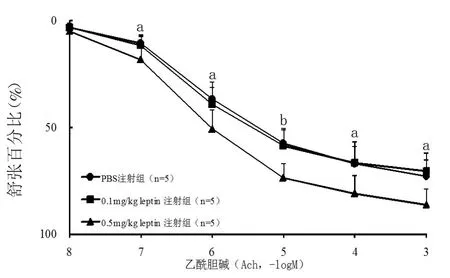
图4 注射瘦素7 d,Wistar大鼠胸主动脉环对不同浓度(10-8-10-3M)Ach的舒张功能反应
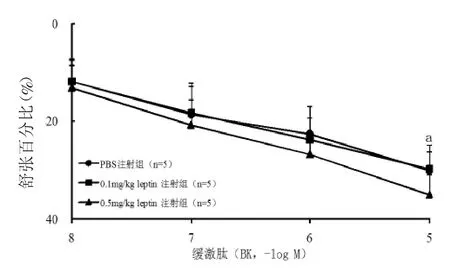
图5 注射瘦素7 d,Wistar大鼠胸主动脉环对不同浓度(10-8-10-5M)BK的舒张功能反应
表3 注射不同浓度瘦素7 d后对Wistar大鼠血清中6-Keto PGF1α和 TXB2表达的影响(±s)
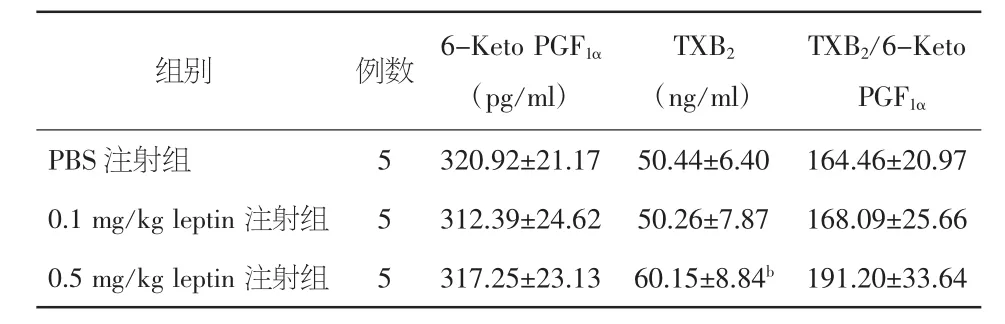
表3 注射不同浓度瘦素7 d后对Wistar大鼠血清中6-Keto PGF1α和 TXB2表达的影响(±s)
注:6-Keto PGF1α:6-酮前列环素 F1α;TXB2:血栓素 B2。与 PBS 注射组比较,aP<0.05
TXB2/6-Keto PGF1αPBS 注射组 5 320.92±21.17 50.44±6.40 164.46±20.97 0.1 mg/kg leptin 注射组 5 312.39±24.62 50.26±7.87 168.09±25.66 0.5 mg/kg leptin 注射组 5 317.25±23.13 60.15±8.84b 191.20±33.64组别 例数 6-Keto PGF1α(pg/ml)TXB2(ng/ml)
为探讨较长时间注射瘦素后大鼠动脉环对血管活性物质的反应性,本研究通过注射不同浓度瘦素后记录进食量、体重、血压及张力值的改变。结果显示,低浓度瘦素注射组(0.1 mg/g)除在第2天到第4天明显抑制大鼠进食量外,对体重、MAP、血管张力及血清6-Keto PGF1α、TXB2水平无显著影响,表明注射低浓度瘦素仅发挥了抑制食欲、增加能量消耗以调节能量平衡的生理学效应。但在高浓度瘦素注射组中,除抑制大鼠进食量、降低体重外,还增强了内皮细胞依赖的舒张功能,这种作用主要源于增加了NO合成及释放。原因包括:⑴高浓度瘦素注射组加强由Ach引起的舒张,而Ach主要通过eNOS产生NO引起血管舒张。⑵BK通过3种方式引起血管张[13]:①通过eNOS合成NO;②在细小血管内释放EDHF;③通过COX-2产生前列环素PGI2。但预先孵育L-NAME(eNOS合成酶抑制剂)后瘦素加强舒张功能消失,证明高浓度瘦素注射组加强BK的舒张效应主要源于增加NO的合成,并不是通过上调COX-2表达,增加PGI2释放,而且血清中6-Keto PGF1α水平并未升高,它是PGI2在血液中的稳定存在形式。但本研究局限之处在于仅用了2个不同浓度瘦素进行对比研究。另外,AA对血管产生收缩或舒张作用主要取决于动物种属及血管半径,通过COXs将AA分解成PGI2和TXA2,舒缩作用取决于两者的比例[14]。本研究发现AA对大鼠胸主动脉环起收缩作用,证明TXA2占主要作用地位。但注射瘦素后动脉环对AA、NS-398+AA引起的收缩并无影响,通过孵育NS-398后各组收缩百分比均下降10%左右,证明外源性AA通过COX-2分解成TXA2约占50%。但注射瘦素后并不能通过诱导内皮细胞中COX-2表达改变AA收缩百分比。另外本研究发现,高浓度组TXB2水平升高,原因可能在于TXB2可由血小板产生,当收集血液后未及时进行离心时会升高。而且在临床上也有报道,高瘦素血症肥胖妇女的血、尿液中11-脱氢血栓素B2表达升高[15],后者也是TXA2的稳定代谢物。所以有足够理由相信,较长时间注射高浓度瘦素能上调动物血小板表达血栓素A2,增加血小板的聚集。
与本研究不同的是Manuel-Apolinar等[16]发现瘦素能上调大鼠内皮细胞 COX-2 mRNA表达,而本研究在细胞实验中发现除此作用外,瘦素还能显著上调大鼠主动脉内皮细胞的COX-2蛋白表达,升高6-Keto PGF1α水平并降低TXB2/6-keto PGF1α比例,但对TXB2无影响。说明瘦素可能通过增加COX-2、PGI2表达以增强内皮细胞依赖的舒张功能。虽然在体内我们发现瘦素并没有升高6-Keto PGF1α水平、降低 TXB2/6-keto PGF1α比例,甚至相反上调血小板表达TXB2,但是在离体动脉环中证实瘦素的确能增加内皮细胞依赖性舒张功能。这与细胞实验总的结果是一致的,即从细胞实验中由各种检测指标推测瘦素能增强动脉舒张功能,并由此动脉环实验得到了验证。至于瘦素对COX-2及其下游产物6-Keto PGF1α和TXB2表达有所差异,笔者认为与使用瘦素浓度不一致、注射方式、瘦素代谢速度及体内有众多因素参与(例如血小板)等有关,这些需要在今后的研究中进一步探讨。另外,本研究中各组MAP随注射时间均有升高趋势,但各组间比较未见统计学差异。原因可能在于:①年龄增长;②反复注射和测量各项指标使动物较长时间处于应激状态。使血压升高可能需要更高浓度瘦素或改变注射方式[4]。
在本研究中高浓度瘦素组由Ach、BK引起的舒张加强,由于Ach主要通过eNOS产生NO引起血管舒张,并且瘦素加强BK的舒张作用被LNAME所抑制,从而证明瘦素增强内皮细胞依赖的舒张功能与NO有关[17]。尽管瘦素增加了血小板缩血管物质TXB2的表达[18],对舒血管物质PGI2的稳定形式6-Keto PGF1α表达水平无影响,但综合效应是增强血管的舒张功能。另外,高浓度瘦素组体重变化与Ach Emax呈正相关,说明瘦素增强血管的舒张功能与体重减轻有关。
综上所述,本研究探讨较长时间注射瘦素后动物血管张力改变及其影响因素。结果发现,瘦素能增强由NO介导的内皮细胞依赖的舒张功能,与通过COX-2产生PGI2的途径无关。同时也证实注射瘦素后,大鼠摄食量明显减少,体重减轻,体重下降有助于改善内皮细胞舒张功能[19],这为减肥防治高血压提供了客观依据。
[1]Munzberg H,Morrison CD.Structure,production and signaling of leptin.Metabolism,2014,42:488-493.
[2]Vecchione C,Maffei A,Colella S,et al.Leptin effect on endothelial nitric oxide is mediated through Akt-endothelial nitric oxide synthase phosphorylation pathway.Diabetes,2012,51:168-173.
[3]Benkhoff S,Loot AE,Pierson I,et al.Leptin potentiates endothelium-dependent relaxation by inducing endothelial expression of neuronal NO synthase.Arterioscler Thromb Vasc Biol,2012,32:1605-1612.
[4]Shek EW,Brands MW,Hall JE.Chronic leptin infusion increases arterial pressure.Hypertension,1998,31:409-414.
[5]Wojcicka G,Jamroz-Wisniewska A,Widomska S,et al.Role of extracellular signal-regulated kinases(ERK)in leptin-induced hypertension.Life Sci,2008,82:402-412.
[6]付阳.丙泊酚对糖尿病大鼠主动脉血管张力的影响.北京协和医学院,2010.
[7]Adeagbo AS,Patel D,Iddrissu A,et al.NS-398,a selective cyclooxygenase-2 blocker,acutely inhibits receptor-mediated contractions of rat aorta:role of endothelium.Eur J Pharmacol,2013,458:145-154.
[8]Shin HJ,Oh J,Kang SM,et al.Leptin induces hypertrophy via p38 mitogen-activated protein kinase in rat vascular smooth muscle cells.Biochem Biophys Res Commun,2005,329:18-24.
[9]Quehenberger P,Exner M,Sunder-Plassmann R,et al.Leptin induces endothelin-1 in endothelial cells in vitro.Circ Res,2012,90:711-718.
[10]de Haro MC,Figueiredo VN,de Faria AP,et al.Highcirculating leptin levels are associated with increased blood pressure in uncontrolled resistant hypertension. J Hum Hypertens,2013,27:225-230.
[11]Beltowski J.Leptin and the Regulation of Renal Sodium Handling and Renal Na-Transporting ATPases:Role in the Pathogenesis ofArterialHypertension.Curr CardiolRev,2010,6:31-40.
[12]Lembo G,Vecchione C,Fratta L,et al.Leptin induces direct vasodilation through distinct endothelial mechanisms.Diabetes,2010,49:293-297.
[13]Rodriguez JA, De la Cerda P, Collyer E, et al.Cyclooxygenase-2 induction by bradykinin in aortic vascular smooth muscle cells.Am JPhysiolHeartCirc Physiol,2006,290:H30-H36.
[14]郭守利,李倩,张一飞,等.花生四烯酸及其3种代谢产物对兔肺动脉环作用的比较.中国药理学通报,2006,22:679-682.
[15]Skurk T,van Harmelen V,Lee YM,et al.Relationship between IL-6,leptin and adiponectin and variables of fibrinolysis in overweight and obese hypertensive patients.Horm Metab Res,2011,34:659-663.
[16]Manuel-Apolinar L,Lopez-Romero R,Zarate A,et al.Leptin mediated ObRb receptor increases expression ofadhesion intercellular molecules and cyclooxygenase 2 on murine aorta tissue inducing endothelial dysfunction.Int J Clin Exp Med,2013,6:192-196.
[17]刘国祥,步秀婷,章莉,等.冠心病患者瘦素含量与一氧化氮水平的相关性研究.中国心血管病研究,2006,4:188-190.
[18]李娇.血清瘦素与相关疾病.中国心血管病研究,2012,10:876-878.
[19]Zanetti M,Barazzoni R,Vadori M,et al.Lack of direct effect of moderate hyperleptinemia to improve endothelial function in lean rataorta: roleofcalorie restriction.Atherosclerosis,2004,175:253-259.
Effect of leptin on rat vascular tone and mechanism studies
CHEN Yue-lin,SHEN Yue-chun.Department of Cardiology,First Affiliated Hospital,Guangzhou Medical University,Guangzhou 510120,China
SHEN Yue-chun,E-mail:shenyc102806@163.com
ObjectiveTo explore the effects of leptin injection on Wistar rats′thoracic aortic rings vascular tension changes and its influencing factors.MethodsFifteen male wistar rat were divided into 3 groups:⑴PBS control group(C).⑵0.1 mg/kg low concentration of leptin injection group(L).⑶0.5 mg/kg high concentration of leptin injection group(H),were injected for 7 days respectively.Daily food intake,body weight changes and mean arterial pressure(MAP)were recorded of each groups.The thoracic aortic rings contraction responses to variety vasoactive mediators were tested.Enzyme linked immunosorbent assay was used to detect serum 6-Keto prostaglandin F1α(6-Keto PGF1α)and thromboxane B2(TXB2)level.ResultsInjection of leptin significantly inhibited daily food intake on the next day[H(21.75±2.41)g vs L(23.84±0.74)g vs C(28.54±1.15)g].At the beginning of the fourth days body weight significant lose only in H group[H(259.25±9.31)g vs C(272.75±12.92)g,P<0.05],and last to 7 days[H(257.5±7.96)g vs C(281.25±11.28)g,P<0.01].Comparing with C group,L and H group had no significant increase MAP[H(80.73±5.56)mm Hg vs L(83.45±7.47)mm Hg vs C(84.53±2.17)mm Hg,P>0.05],as well as contraction responsed to vasoconstrictor,such as phenylephrine and arachidonic[10-3M phenylephrine contraction,H(133.64±26.06)%vs L(146.98±20.34)%vs C(140.91± 22.17)%,P>0.05;10-5M arachidonic contraction,H(22.52±1.55)%vs L(23.78±2.43)%vs C(22.76±1.1)%,P>0.05].H group separately improved response to endothelial-dependent vasodilator agents mediated by nitric oxide(NO):acetylcholine(Ach)and bradykinin(BK)and decreased Ach concentration for 50%maximal effect(EC50)[H(-6.33±0.11)vs C(-5.69±0.12),P<0.05].Leptin potentiated vasorelaxation induced by BK,which was inhibited by L-NAME(selective endothelial nitric oxide synthase inhibitor).H group body weight changes was positively correlated with the Ach percentage of maximal relaxation effect(Emax)(r=0.737,P<0.05).Furthermore,H group increased the serum TXB2level[H(60.15±8.84)ng/ml vs C(50.44±6.4)ng/ml,P<0.05].ConclusionLong term injection of leptin although increases vasoconstrictors TXB2expression by platelet,but the final effection of leptin is enhancing arterial endothelial dependent vasorelaxation,which is not related to vasodilatation substance 6-Keto PGF1αbut to increasing endothelial cells expression of NO,decreasing food intake resulting in body weight lose and improving endothelial diastolic function.Current results provide an evidence that body weight lose is benefit to prevention and control of hypertension.
Leptin; Endothelial cell; COX-2; Prostacyclin; Thromboxane; Vascular tone
2010年度广东省自然科学基金面上项目(项目编号:10151009504000007)
510120 广东省广州市,广州医科大学附属第一医院心内科
沈粤春,E-mail:shenyc102806@163.com
10.3969/j.issn.1672-5301.2015.08.021
Q95-33;R54
A
1672-5301(2015)08-0754-06
2015-05-07)
