黄芪含药血清对血管紧张素Ⅱ诱导内皮细胞分泌PAI—1的影响
2015-09-11邱宇安等
邱宇安等
[摘要] 目的 探讨血管紧张素Ⅱ(AngⅡ)对内皮细胞(HUVECs)分泌1型纤溶酶原激活物抑制剂(PAI-1)的影响及黄芪含药血清对AngⅡ此效应的干预作用。 方法 培养脐静脉内皮细胞株,对照组与AngⅡ干预组:内皮细胞与不同浓度AngⅡ共孵育18 h;黄芪含药血清组:内皮细胞在不同浓度黄芪药血清培养基中培育24 h后,加入AngⅡ(×10-4 mol/L)培养18 h,酶联免疫吸附法(ELISA)测定PAI-1浓度。 结果 与对照组比较,不同浓度的AngⅡ均能刺激HUVECs分泌PAI-1;黄芪含药血清可抑制AngⅡ促HUVECs分泌PAI-1的效应。 结论 黄芪含药血清可能通过抑制AngⅡ诱导的HUVECs分泌PAI-1效应,产生抗动脉粥样硬化的作用。
[关键词] 黄芪;血管紧张素Ⅱ;内皮细胞;1型纤溶酶原激活物抑制剂
[中图分类号] R285.5 [文献标识码] A [文章编号] 1674-4721(2015)08(a)-0012-03
血管紧张素Ⅱ(AngⅡ)是由血管紧张素Ⅰ在血管紧张素转化酶的作用下,水解产生的多肽物质,能产生多种生理效应,促进动脉粥样硬化(AS)的发生、发展,其中包括影响凝血和纤溶系统的活性平衡,促进血栓形成[1-3]。黄芪的药用历史悠久,临床上黄芪注射液已用于治疗冠心病、糖尿病肾病等疾病[4-5]。本实验研究AngⅡ对内皮细胞分泌1型纤溶酶原激活物抑制剂(PAI-1)的诱导作用及黄芪含药血清的干预效应,探讨黄芪含药血清的血管保护机制。
1 材料与方法
1.1 仪器与材料
胎牛血清(美国Gibco公司);RPMI-1640培养基(美国Gibco公司);胰蛋白酶(美国Gibco公司);黄芪(江西省中医院中药房);AngⅡ(美国Sigma公司);脐静脉内皮细胞株ECV-304(中国科学院上海细胞生物研究所);Wistar大鼠(南昌大学实验动物科学部);PAI-1ELISA试剂盒(上海太阳生物技术公司);酶标仪(芬兰Thermo bioanalysis公司);超净工作台(苏州安泰空气技术有限公司)。
1.2 不同剂量黄芪含药血清的制备
黄芪用清水冲洗,浸泡2 h后,武火煎至水沸,改用文火继续煎煮20 min,共煎3次,合并3次煎液,3000 r/min离心10 min,取上清液,60℃水浴,浓缩至含生药1 g/ml[6]。20只Wistar大鼠随机分4组(对照组,小剂量黄芪组,中剂量黄芪组,大剂量黄芪组)。以黄芪成人临床日用量的大鼠等效剂量之1、2、4倍分别定义小、中、大剂量组。大鼠灌药液4 ml/d,对照组予等量生理盐水灌胃。连续给药1周,2次/d,于末次给药后2 h从心脏取血,采用一次性非抗凝真空采血管收集全血,无菌操作。4℃静置2 h,上低温离心机,3500 rpm/min,离心15 min,分离血清,分离的血清同组混合,经56℃恒温灭活补体30 min处理后,超净台上用0.22 μm微孔滤膜过滤除菌,-20℃保存备用。
1.3 实验过程
ECV304在37℃、5%CO2条件下培养于含10%胎牛血清的RPMI-1640培养基中,以0.25%胰酶、0.02%EDTA消化、传代。接种于细胞培养板,孵育至亚融合状态,进行分组及实验。
AngⅡ干预实验。①空白对照组:未用AngⅡ,进行正常培养;②不同浓度AngⅡ干预组:内皮细胞与不同浓度AngⅡ(10-6、10-5、10-4 mol/L)共孵育18 h。采用酶联免疫吸附法(ELISA)测定各组培养上清液中PAI-1的含量。
黄芪含药血清干预实验。①空白对照组:培养液中不加诱导物,正常培养细胞。②阴性对照组:细胞在对照组大鼠血清培养液中培养。③黄芪含药血清干预组:细胞分别在小、中、大剂量组大鼠血清培养液中培养。以上各组细胞培育24 h后,加入AngⅡ(10-4 mol/L)培养液培养18 h。
采用ELISA测定各实验组上清液中PAI-1的含量。每组设6个复孔,操作严格按检测试剂盒说明书进行。
1.4 统计学处理
采用SPSS 12.0统计软件对数据进行分析,计量资料以x±s表示,采用方差分析及q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ对内皮细胞分泌PAI-1的影响
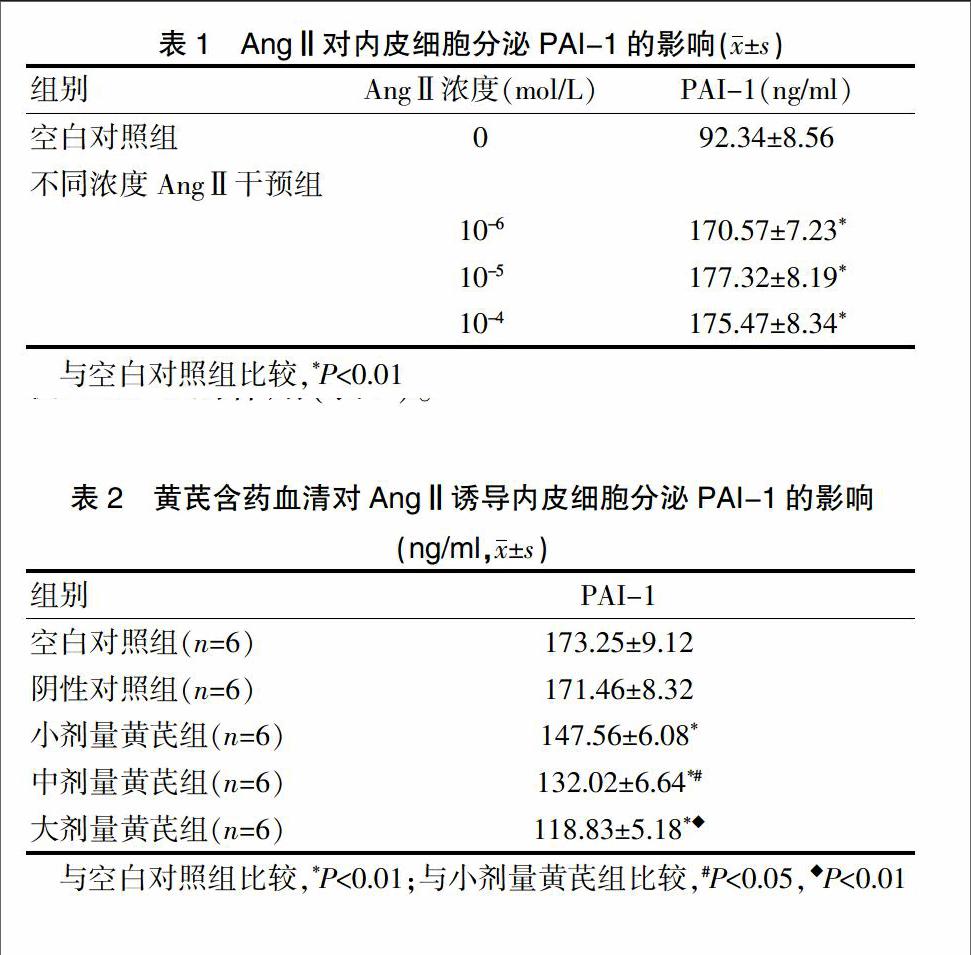
与空白对照组比较,不同浓度的AngⅡ均可促进内皮细胞分泌PAI-1,差异有统计学意义(P<0.01);不同AngⅡ浓度组之间比较,随着AngⅡ浓度增加,促进作用无显著性差异(表1)。
2.2 黄芪含药血清的干预效应
与空白对照组比较,阴性对照组不显著影响上清液中PAI-1的含量;用不同浓度的黄芪含药血清干预后,PAI-1含量明显下降,差异有统计学意义(P<0.05),提示黄芪含药血清有抑制AngⅡ促内皮细胞分泌PAI-1的作用(表2)。
3 讨论
血管内皮细胞不仅是全身血管内膜的屏障结构,而且具有多方面的生理功能,可维持凝血和纤溶系统的活性平衡[7-8]。内皮细胞结构和功能的损害是AS发病过程中重要的环节。
纤溶系统的活性主要取决于组织型纤溶酶原激活物(tPA)及其抑制物PAI-1之间的平衡,两者主要由血管内皮细胞产生,是动脉粥样硬化性疾病的独立预测因子[9]。PAI-1可阻止tPA激活纤溶酶原,促进血栓形成。PAI-1的浓度升高会明显促进AS的进展[10]。研究表明,瘦素可通过上调内皮细胞PAI-1的分泌,产生对心血管系统的影响[11]。本实验证实,AngⅡ可诱导内皮细胞分泌PAI-1,与Brown等[12]研究结果相一致,说明AngⅡ可能通过诱导内皮细胞分泌PAI-1改变凝血和纤溶系统的活性平衡,从而产生促进AS的的效应。
在我国,黄芪有2000多年的药用历史,东汉张仲景所著《金匮要略》上即记载有多个含黄芪的方剂。传统医学认为,黄芪具有补中益气、利水消肿之功效[13]。现代体外实验证实,黄芪注射液可通过加强对氧自由基的清除,维持血管内皮的正常功能[14]。动物体内实验证实,黄芪具有抗动脉粥样硬化的作用[15]。临床试验证实,黄芪可减轻心肌钙超载损伤,改善心脏功能[16]。
本实验旨在观察黄芪对体外血管内皮细胞分泌PAI-1的影响,以进一步阐明黄芪保护血管内皮的机制。若用中药粗制剂直接加入体外的细胞培养反应体系中,中药本身复杂的理化性质与杂质成分等会对细胞的生长造成一定的影响,影响实验结果。因此本实验将中药粗制剂给大鼠灌服后,用含有药物成分的血清代替中药粗制剂进行体外实验,排除上述各种影响因素的干扰,更接近药物在体内环境中产生药理效应的真实过程[17-18],提高了实验结果的可信度。
本实验证实黄芪含药血清能抑制由AngⅡ所诱导的内皮细胞分泌PAI-1,说明黄芪含药血清可改善内皮纤溶活性,有助于动脉粥样硬化血栓性疾病的防治。但其具体作用成分及分子生物学机制,有待于进一步深入研究。
[参考文献]
[1] Schmidt-Ott KM,Kagiyama S,Phillips MI.The multiple actions of angiotensin in atherosclerosis[J].Regul Pept,2000, 93(1-3):65-77.
[2] Takayanagi T,Eguchi A,Takaguri A,et al.A repressor protein,Mnt,is a novel negative regulator of vascular smooth muscle cell hypertrophy by angiotensin Ⅱ and neointimal hyperplasia by arterial injury[J].Atherosclerosis,2013,228(1):90-93.
[3] Wang Y,Tikellis C,Thomas MC,et al.Angiotensin converting enzyme 2 and atherosclerosis[J].Atherosclerosis,2013, 226(1):3-8.
[4] 王光浩,张敬芳,张学福,等.黄芪注射液对冠心病患者胰岛素、血糖和血脂水平的影响[J].中国动脉硬化杂志,2010,19(3):263.
[5] 郑坤.氯沙坦钾联合黄芪注射液治疗早期糖尿病肾病的临床分析[J].重庆医学,2013,42(11):1231-1232.
[6] 杨庆有,冼绍祥,孙慧茹,等.黄芪含药血清诱导骨髓间充质干细胞分化为心肌样细胞的实验研究[J].辽宁中医杂志,2008,35(6):832-834.
[7] Kluge MA,Fetterman JL,Vita JA.Mitochondria and endothelial function[J].Circ Res,2013,112(8):1171-1188.
[8] Ntaios G,Gatselis NK,Makaritsis K,et al.Adipokines as mediators of endothelial function and atherosclerosis[J].Atherosclerosis,2013,227(2):216-221.
[9] Lijnen HR,Collen D.Impaired fibrinolysis and the risk for coronary heart disease[J].Circulation,1996,94(9):2052-2054.
[10] Brown NJ,Kim KS,Chen YQ,et al.Synergistic effect of adrenal steroids and angiotensin Ⅱ on plasminogen activator inhibitor-1 production[J].J Clin Endocrinol Metab,2000,85(1):336-344.
[11] Ploplis VA.Effects of altered plasminogen activator inhibitor-1 expression on cardiovascular disease[J].Curr Drug Targets,2011,12(12):1782-1789.
[12] Singh P,Peterson TE,Barber KR,et al.Leptin upregulates the expression of plasminogen activator inhibitor-1 in human vascular endothelial cells[J].Biochem Biophys Res Commun,2010,392(1):47-52.
[13] 闫凌云.黄芪多糖对糖尿病肾病防治机制的研究进展[J].医学综述,2012,18(11):1727-1729.
[14] 李绚,阎蓉华,罗照田,等.黄芪注射液对人脐静脉血管内皮细胞的增殖作用[J].华西药学杂志,2005,20(1):48.
[15] 张俊峰,高振华,张桂英,等.黄芪、三七有效成分配伍抗动脉粥样硬化作用的实验研究[J].中西医结合心脑血管病杂志,2009,7(2):188-189.
[16] 杨庆有,陆曙,孙慧茹.黄芪对慢性心力衰竭患者心功能与血清肿瘤坏死因子水平的影响[J].中国中西医结合杂志,2010,30(7):699-701.
[17] 王洪武,倪青,林兰.中药含药血清的研究进展及其在中医学中的应用[J].北京中医药,2008,27(9):698-701.
[18] 孙莉娜,孟静岩,孙晓霞.中药血清药理学方法相关问题的思考[J].西部中医药,2012,25(11):36-38.
(收稿日期:2015-03-16 本文编辑:王红双)
