红曲霉和虎杖共发酵体系的初步研究
2015-09-10谢炎福杜苗苗
谢炎福 杜苗苗
摘要: 以红曲霉作为发酵菌种,中药虎杖作为发酵基质进行了双向发酵试验。结果表明,虎杖对于红曲霉的生长和次级代谢产物Monacolin K的积累具有促进作用,发酵后虎杖中白藜芦醇苷、结合大黄素含量降低,而白藜芦醇、大黄素含量升高;经过发酵条件的优化,双向发酵的最佳工艺条件为:虎杖用量4%,发酵温度28 ℃,接种量9%,发酵6 d,发酵后虎杖中白藜芦醇含量达1 29%,大黄素含量0 67%,Monacolin K含量0 48 mg/L,综合得分为0 775。与未发酵组相比,白藜芦醇含量提高了3~4倍,大黄素含量提高了约1倍。
关键词: 红曲霉;虎杖;双向发酵;白藜芦醇;Monacolin K
中图分类号:R282 71;R285 5 文献标志码: A
文章编号:1002-1302(2015)08-0272-04
虎杖是我国的一种传统中药,其主要活性成分为以白藜芦醇为代表的芪类化合物和大黄素为代表的蒽醌类化合物,白藜芦醇具有降压降脂、预防心脑血管疾病、抗癌、增强免疫力、延年益寿等多重功效 [1],在花生、葡萄等70多种植物中广泛存在,但以虎杖中含量较高,一般在0 2%左右,而其糖苷虎杖苷含量则高达2% [2],白藜芦醇的生物活性是虎杖苷的数十倍 [3]。目前,白藜芦醇主要采用有机溶剂萃取 [4],有机溶剂毒性大,在提取物中均有或多或少的残留,若作为药物和保健品来使用,无论从健康角度或消费者心理方面均不太容易接受,且植物药材大部分有效成分包含在植物细胞壁中,一般的有机溶剂不易破坏,提取效率低,所以采用绿色安全的提取方法并将虎杖苷转化为更具活性的白藜芦醇成为现在的研究热点之一。采用酶解法环境友好 [5],常温常压下即可完成,但酶的价格高昂。彭源德等、龚云杰等分别利用黑曲霉、酵母菌对虎杖进行发酵,达到和超过了酶解法的效果 [6-7],显示出生物发酵法在虎杖活性成分转化方面的巨大潜力,但他们仅研究了真菌对虎杖的单向作用,菌种本身没有生物活性成分产生,并且部分菌种不是生物安全菌种。所以,如果能够采用具有生物安全性,且在对虎杖进行发酵的同时产生类似活性物质的菌种进行虎杖、真菌的双向发酵,产品仅需进行简单加工或浓缩即可,将大大减轻后续处理的压力。红曲霉的使用在我国具有悠久的历史,广泛应用于食品、医药等多个领域,红曲霉能产生Monacolin K(莫纳可林K)、γ-氨基丁酸等多种生物活性成分,具有很高的保健及药用价值 [8]。红曲霉和虎杖在药性机理上具有一定的相似性,红曲霉能产生淀粉酶、葡萄糖苷酶、纤维素酶等丰富的酶系,能有效破除植物类中药细胞壁和果胶类物质形成的物理屏障,使有效活性成分溶出,且具有打断β糖苷键,将虎杖苷和结合大黄素转化为白藜芦醇和游离大黄素的潜力 [9]。因此,将红曲霉与虎杖一起共同构建双向发酵体系产生的药性菌质比两者分别入药更能得到优势互补的功效。本次研究在前期中药筛选和红曲霉菌株定向诱变的基础上,利用虎杖作为红曲霉发酵的药性基质,旨在探讨通过红曲霉发酵虎杖达到提高白藜芦醇、大黄素含量和红曲霉中Monacolin K等有效活性成分含量的目的,并进行发酵条件的初步优化,为红曲霉药性基质双向发酵的研究打下基础。
1 材料与方法
1 1 试验材料
1 1 1 红曲霉(Monascus):为本实验室保存菌种,经过紫外、化学诱变获得(见图1)。
1 1 2 虎杖(Polygonum cuspidatum Sieb et Zucc ):购自洛阳医药城,于60 ℃干燥箱中烘干至恒质量,用实验室小型粉碎机粉碎过120目筛备用。
1 1 3 发酵培养基:参照文献[10]的配方进行适当的改动,葡萄糖10 g,虎杖粉30 g,硝酸钠3 g,酵母提取物1 g,磷酸氢二钾1 g,7水合硫酸镁0 5 g,氯化钾0 5 g,7水合硫酸亚铁001 g,pH值5 6,用自来水定容至1 L。
1 2 试验方法
1 2 1 发酵种子液的制备 将经活化的红曲霉斜面孢子用无菌水洗下,倒入含0 05%吐温80生理盐水的三角瓶中,三角瓶中预先装有数十粒玻璃珠,在摇床上振荡,充分打散孢子,制成孢子浓度为1×106个/mL的孢子悬液,即为红曲霉种子液。
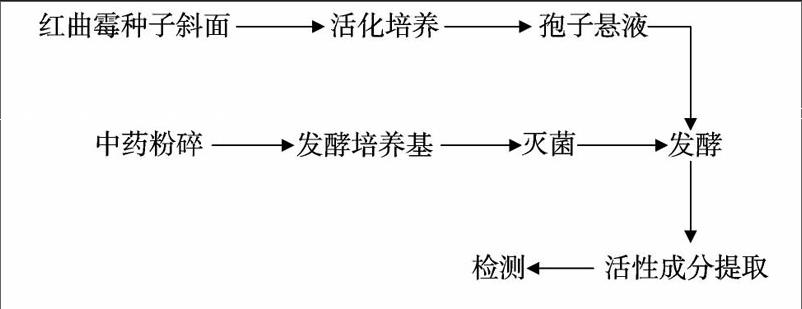
1 2 2 发酵方法和流程 将80 mL发酵培养基装入250 mL三角瓶中,于121 ℃高压灭菌15 min,冷却后按照6%的比例接入预先制好的红曲霉孢子悬液,在摇床上180 r/min、30 ℃培养3 d,降低温度至28 ℃继续培养一定天数,隔天定时带瓶称质量,测量各项指标,发酵结束后,将发酵液过滤,称量红曲干质量。发酵流程如下:
1 2 3 单因素试验 单因素试验设计包括接种量:0%、3%、6%、9%、12%;虎杖添加量:0%、1%、2%、3%、4%、5%;发酵
[ (W7][TPXYF1A TIF]
时间:30 ℃发酵3 d后,28 ℃条件下继续发酵一定天数;每个处理3个重复,分别测定红曲质量、Monacolin K、白藜芦醇等的含量做为评价指标,培养方法同上,每次改变1个条件,测定不同条件下各指标的变化情况,以上次试验确定的最优条件作为下次单因素试验的基础。
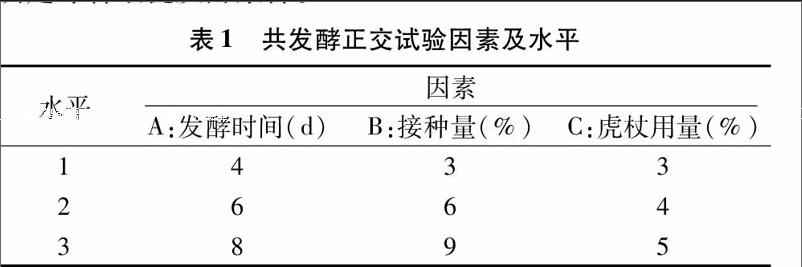
1 2 4 正交试验 选用L9(34)正交表,在单因素试验的基础上,选取接种量、发酵时间、虎杖用量3个培养条件进行优化(表1),并通过测定白藜芦醇、Monacolin K等的含量高低确定综合最优发酵条件。
1 3 测定及分析方法
红曲质量称量:参照陈云的氨基葡糖法 [11]略有改动。
红曲色素的去除:参照张小茜等的方法 [12],将三角瓶中的发酵液连同残渣一起倒入大的培养皿中,60 ℃烘干、研磨,将研磨后的粉末用75%的乙醇回流提取3 h,更换乙醇,再提取2次,合并提取后的乙醇溶液,浓缩,在装有氧化铝的层析柱上层析,除去红色素,收集去除红色素的层析液,浓缩至约 80 mL,于100 mL容量瓶中用75%乙醇定容至刻度,备用。
Monacolin K测定:参照田洁等的方法 [13],将上述得到的层析液进行适当稀释,在236 nm波长处测量吸光度。
总大黄素的测定:参照高言明等 [14]和李卫先等 [15]的方法略有改动,取适量除去红色素的层析液,回收乙醇至无醇味,得醇浸膏,取醇浸膏0 5 g,加入2 5 mol/L的硫酸40 mL,超声振荡10 min至完全溶解,用氯仿回流提取2 h,反复3次,合并氯仿溶液,回收氯仿得红棕色物质,加入适量乙醚溶解,加入5%的碳酸钠溶液萃取3次,合并萃取液,加盐酸调整pH值为2~3,析出沉淀,抽滤,加入含0 5%乙酸镁的甲醇溶液中,用25 mL容量瓶定容至刻度,在510 nm处测定吸光度,计算总大黄素的含量。
游离大黄素含量的测定:除不加硫酸外,其他同总大黄素的测定。
白藜芦醇的测定:参照倪网东等的方法 [16]略有改动,取适量除去红色素的层析液,回收乙醇至无醇味,得醇浸膏,取醇浸膏0 5 g,用乙醚回流提取2 h,反复3次,合并乙醚溶液,回收乙醚,用95%的乙醇溶液溶解残渣并用5 mol/L NaOH滴定至pH值为8,分别测定波长314 nm和波长318 nm时候的吸光度。
白藜芦醇苷的测定:参照李梦青的方法 [17]略有改动,将上述白藜芦醇提取后的残渣,用乙酸乙酯提取3次,合并萃取液,在波长325 nm处测定吸光度。
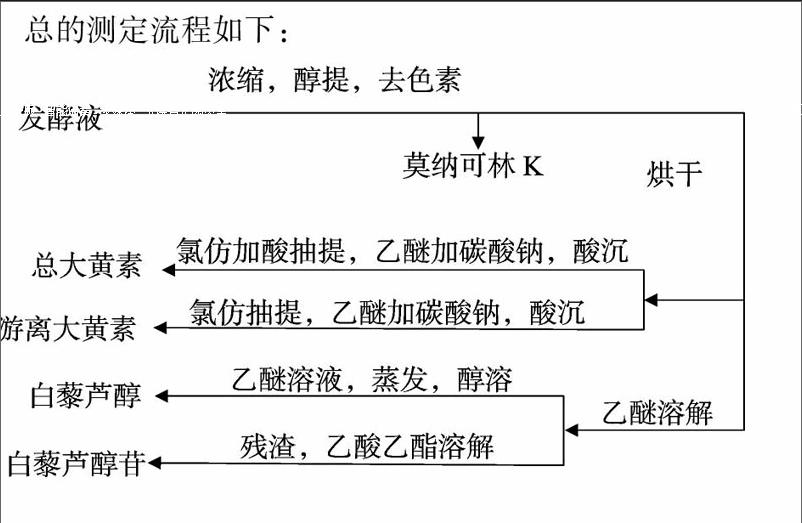
总的测定流程如下:
1 4 数据处理
总大黄素含量=(总大黄素浓度×稀释倍数×提取液体积)/虎杖质量×100%;
游离大黄素含量=(游离大黄素浓度×稀释倍数×提取液体积)/虎杖质量×100%;
结合大黄素含量=总大黄素含量-游离大黄素含量;
白藜芦醇=(白藜芦醇浓度×稀释倍数×提取液体积)/虎杖质量×100%;
白藜芦醇苷=(白藜芦醇苷浓度×稀释倍数×提取液体积)/虎杖质量×100%。
所有数据采用SPSS软件进行方差分析,多重比较采用LSD法。
1 5 综合指标评分的计算
中药成分复杂,临床上往往多种成分同时发挥作用,仅以1、2种成分来评价往往不能反映实际的发酵效果,且各项指标的重要性也有所不同,所以需要对各个指标进行权衡考虑,设计一个综合的评分标准进行直观分析和方差分析,参考胡容峰等 [18]、田源红等 [19]的方法,设计评分指标(表2)。
分数=[(指标值-指标最小值)/(指标最大值-指标最小值)]×权重。
2 结果与分析
2 1 发酵前后成分的变化
发酵过后,发酵液的颜色转为红紫色(图1)。对比发酵前后的全波长扫描图(图2)可以看出,发酵后物质的成分有了较大的变化,特别吸收峰在约220 nm至600 nm之间物质变化较大,在 250~280 nm 和350~600 nm间吸收量上升,产生了新的吸收峰,280~350 nm间吸收量下降,说明在发酵过程中,红曲和中药虎杖存在着复杂的双向作用,有些物质含量下降,被红曲霉分解利用为自身代谢需要,有些被转化生成新的物质或成为新的活性成分。
2 2 发酵时间对发酵结果的影响
从图3可以看出,随着发酵的进行,Monacolin[KG 3]K呈现增加的趋势,红曲霉生物量、游离大黄素、白藜芦醇先增长后降低,而结合大黄素和虎杖苷呈现降低的趋势,说明大黄素、白藜芦醇的增加分别来自于结合大黄素和虎杖苷的转化。白藜芦醇含量的增减和红曲霉生物量的变化呈现高度的一致,而大黄素的增减变化滞后于红曲霉生物量的变化,大致在白藜芦醇苷绝大部分降解为白藜芦醇后才开始大幅度增加,似乎显示红曲霉首先分解虎杖甘,在虎杖苷分解殆尽后才分解结合大黄素,这和田天丽等的试验结果 [20]类似,但是发酵时间延长至6 d左右,这一方面是因为为了获得较高的莫纳可林K产量,采用了变温发酵的方法,另一方面和红曲霉生长较为缓慢和其β葡萄糖苷酶活性较低有直接关系。在发酵的后期,虽然虎杖苷和结合大黄素的量仍在降低,但大黄素和白藜芦醇的量不升反降,可能在发酵后期,其他营养物质消耗殆尽,两者被红曲霉利用或转化为其他物质的结果。在发酵6 d后,白藜芦醇的含量达到最大值,所以确定发酵的最终时间为6 d。试验中也注意到,经过灭菌后,大黄素的量稍有增加,而白藜芦醇的量则稍有减少,可能和白藜芦醇在高温下不稳定有关。Monacolin K总体上呈现增加的趋势,发酵初期几乎测不到Monacolin K的含量,Monacolin K的产量高峰出现时间延后于红曲霉生物量的产量高峰,说明Monacolin K是红曲霉的次生代谢产物,只有在红曲霉菌丝量有了一定程度的增加,至平稳期后Monacolin K才大量合成。
2 3 不同虎杖浓度对发酵结果的影响
从图4可以看出,随着虎杖添加量的增大,红曲生物量、莫纳可林K、白藜芦醇和大黄素含量均呈现先增加后降低的趋势,虎杖中虎杖苷、结合大黄素则呈现增加的趋势。说明一定量的虎杖对于红曲的生长和其有效活性成分Monacolin K的产生具有促进作用,而过高的添加量则会抑制红曲霉的生长,这可能与虎杖含有多糖、黄酮类化合物、脂肪等多种有效成分,刺激了红曲霉的代谢活动,而同时又含有多酚等抑制红曲生长的因子有关。白藜芦醇和大黄素在虎杖添加量为1%时低于未发酵对照组,虽然红曲的分解会引起二者含量的增加,但是在6 d的发酵过程中,增加量在后期随着培养基中营养成分的减少被红曲霉过度分解,最终导致含量减少。在虎杖添加量为4%时,白藜芦醇得率最大,故选择虎杖4%作为双向发酵的添加量。在试验中也注意到,虽然最终添加了虎杖的发酵组红曲霉生物量及主要活性物质莫纳可林K的含量高于未加虎杖的对照组,但对照组更早地产生了菌丝球和肉眼可察觉的颜色变化,这可能由于对照组葡萄糖消耗完后又没有补充,而红曲色素是次级代谢产物,往往在红曲霉即将停止生长时才大量产生,也有可能是红曲霉对中药虎杖的添加有一个逐渐适应的过程,具体生理过程还需要进行深入研究。
2 4 接种量对发酵结果的影响
由图5可见,随着红曲霉接种量的增加,虎杖苷和结合大黄素含量降低,莫纳科林K、白藜芦醇、游离大黄素和红曲霉生物量则先升高后降低,并不完全随着接种量增加而增大,接种量增大,菌体代谢旺盛,分泌大量胞外酶类,有利于发酵基质的利用和菌体生长,但是接种量过大,会导致发酵液过于黏稠,影响溶氧含量,最终影响产物的合成。试验中也注意到,不加红曲的对照组在水溶液中浸泡后也会导致白藜芦醇和大黄素含量的少量增加,这可能是由于水的浸泡作用,使植物组织纤维素、木质素变疏松,更有利于活性成分溶出。综合各项因素,在接种量为6%时,各项指标均较为理想,所以确定红曲霉6%添加量作为最终双向发酵的接种比例。
2 5 正交试验结果
对正交试验结果(表3)进行方差分析可知, 仅以白藜芦醇作为考察指标,各因素对试验结果均有显著(P<0 05)或极显著(P<0 01)影响,各因素之间除了接种量2、3水平间无显著差异外,其他各因素水平间均差异显著,影响大小依次为接种量>发酵时间>虎杖用量,最佳发酵条件组合为A2B2C2。对于游离大黄素来说,各因素对试验结果均有显著影响,各因素之间除了接种量2、3水平和虎杖用量1、2水平间无显著差异外,其他各因素水平间均差异显著,影响大小依次为发酵时间>接种量>虎杖用量,最佳的发酵条件组合为A3B3C2。对于莫纳可林K来说,各因素对试验结果除发酵时间有显著影响外,其他均没有显著影响,影响大小依次为发酵时间>接种量>虎杖用量,最佳的发酵条件组合为A2B3C2,显示以不同的指标来考察,结果差异很大。对各项指标进行综合考虑的结果为,各因素对实验结果均有显著影响,各因素之间除了接种量2、3水平之间无显著差异外,其他各因素水平间均差异显著,影响大小依次为接种量>虎杖用量>发酵时间,最佳的发酵条件组合为A2B3C2。即发酵时间6 d、接种量9%、虎杖用量4%,在此条件下,白藜芦醇含量达1 29%,大黄素含量067%,莫纳可林K含量0 48 mg/L。
3 结论
(1)虎杖的适量添加对于红曲霉的生长和次级代谢产物Monacolin K的积累具有促进作用。(2)红曲霉以虎杖作为药性基质显著降低了虎杖中虎杖苷和结合大黄素的含量,同时白藜芦醇和游离大黄素的含量有了明显的提高;(3)经过发酵条件的优化,最佳工艺条件为:虎杖用量4%,发酵温度 28 ℃,接种量9%,发酵6 d,发酵后虎杖中白藜芦醇含量达1 29%,大黄素0 67%,莫纳可林K含量0 48 mg/L,综合得分为0 775;(4)红曲和虎杖双向发酵相互影响,有可能对现有成分进行了生物转化或产生了新的活性成分,有待继续在这一方面进行深入研究。
参考文献:
[1] 潘明新,王晓阳 虎杖的化学成分及其药理作用[J] 中药材,2000,23(1):56-58
[2]江兰英,谢细平,陈华龙,等 不同生长期和不同产地虎杖总蒽醌比较[J] 中草药,2005,36(8):1244-1246
[3]史 丽,刘 燕,许现辉 白藜芦醇的生物活性研究进展[J] 食品与药品,2006,8(11):5-8
[4]任红涛,崔慧霞,赵秋艳 白藜芦醇提取工艺的优化与除杂方法的选择[J] 食品工业科技,2005,26(7):99-101
[5]黄志芳,易进海,刘倩伶,等 酶解法提取纯化虎杖提取物中白藜芦醇的工艺研究[J] 天然产物研究与开发,2009,21(6):1061-1064
[6]彭源德,朱作华,刘正初,等 酵母发酵虎杖提取白藜芦醇技术初步研究[J] 湖北农业科学,2011,50(23):4929-4931
[7]龚云杰,王 卫,曾柏全,等 产纤维素酶微生物发酵转化虎杖提高白藜芦醇收率的研究[J] 中南林业科技大学学报,2010,30(9):190-193,201
[8]马立安,江 涛 红曲的功能及其应用[J] 中国酿造,2001(4):14-15
[9]李金红 红曲的生产及其功能和应用[J] 江苏调味副食品,2005,22(2):29-31
[10] 吴根福 发酵工程实验指导[M] 北京:高等教育出版社,2006:168
[11]陈 云 红曲霉固态发酵及形态解析[D] 天津:天津科技大学,2003
[12]张小茜,周富荣,石济民 高效液相色谱法测血脂康胶囊及红曲中洛伐他汀的含量[J] 中华医学信息导报,1997,22(16):23-24
[13]田 洁,乔明武,左秀凤,等 红曲发酵谷物麸糠提取Lovastatin的研究[J] 现代食品科技,2006,22(3):112-114
[14]高言明,陈海云,吴小宇 醋酸镁-甲醇分光光度法测定何首乌中蒽醌类化合物的含量[J] 微量元素与健康研究,2004,21(2):41-42
[15]李卫先,张 琦,王国仁,等 炮制时间对何首乌中有效成分的影响[J] 中国中医药咨讯,2011,3(23):48-49
[16]倪网东,满瑞林,李志明,等 紫外分光光度法同时测定虎杖中芪类和蒽醌类化合物[J] 化学工程师,2006,20(2):35-36,39
[17]李梦青,聂 媛,张 洁,等 酶解法提取虎杖中白藜芦醇、白藜芦醇苷、大黄素[J] 精细化工,2008,25(5):467-470
[18]胡容峰,朱家壁,彭代银,等 综合评分法优化复方丹参口腔速溶片制剂处方[J] 中国中药杂志,2006,31(5):380-382
[19]田源红,张丽艳,杨玉琴,等 综合评分法优化黑豆汁炖何首乌炮制工艺[J] 时珍国医国药,2007,18(3):549-551
[20]田天丽,王 嫱,王永宏,等 虎杖的微生物发酵转化及其发酵产物提取分离的研究[J] 天然产物分离,2006(4):1-5
