多酶法提取榛蘑多糖及光谱研究
2015-09-10邹东恢郭宏文
邹东恢 郭宏文
摘要: 研究了多酶法提取榛蘑多糖的最佳条件并进行光谱研究,通过单因素和正交试验确定了酶法提取榛蘑多糖的最佳工艺,即:粒度80目,料水比1 ∶ 20,酶作用温度40 ℃,加酶(加酶总量为底物的1%)质量比(木瓜蛋白酶 ∶ 纤维素酶)3 ∶ 1,pH值6 5,酶作用时间2 0 h;在此条件下多糖的提取率可达16 85%。红外光谱分析表明榛蘑多糖为含有葡萄糖醛酸的β-吡喃多糖。
关键词: 榛蘑多糖;多酶法提取;正交试验;光谱分析
中图分类号: R284 2 文献标志码:A
文章编号:1002-1302(2015)08-0276-03
榛蘑多糖(AMP)是从榛蘑菌丝体、子实体和发酵产物中分离而来的,是一种能够控制细胞的分裂分化和调节细胞生长衰老的活性多糖,同时它还具有抗辐射、促进造血、抑制肿瘤生长、调节免疫等药理作用 [1-2]。此外,榛蘑多糖也具有一定的抗氧化能力,可以用于制备具有抗氧化活性的天然活性物质。榛蘑多糖提取可以采用热水、稀酸、稀碱作为浸提剂,也可采用微波法、超声波法辅助提取,浸提法是提取榛蘑多糖的传统方法,但时间长、效率低、能耗大 [3],多糖的提取率普遍不高。酶法提取多糖简单快捷、省时低耗,对榛蘑多糖的工业化提取及生产具有非常重要的现实意义。
1 材料与方法
1 1 原料处理
将市场上购买的榛蘑根部去除后,用清水清洗干净,用剪刀将菌伞剪成适当的小块,放入真空干燥箱中干燥,用粉碎机粉碎,将粉碎后的榛蘑干粉依次通过20、40、60、80目的筛子,之后将各级的榛蘑粉放入洁净干燥的烧杯中,并将其置于干燥箱中待用。
1 2 试剂与仪器
SHZ-D(Ⅲ)循环水式真空泵:河南省巩义市予华仪器有限责任公司;离心机:上海跃进医疗器械厂;RH-Q型全温振荡器:江苏省全坛市荣华仪器制造有限公司;722紫外分光光度计:北京赛多利斯仪器系统有限公司;Lambda-35紫外可见分光光度计:美国PE公司;木瓜蛋白酶:北京世纪时尚科贸有限公司;纤维素酶:国药集团化学试剂有限公司;所使用的试剂均为分析纯。
1 3 葡萄糖标准曲线的制作
以测定的吸光度D作为纵坐标,葡萄糖的质量浓度C作为横坐标,用苯酚-硫酸法测定多糖含量,绘制出葡萄糖标准曲线为y=12 313 0x-0 029 1,相关系数为r=0 999 1。
1 4 酶法提取榛蘑多糖的方法
精确称取80目的榛蘑粉2 g于锥形瓶中,按照一定的料水质量比加入蒸馏水,用pH计调节pH值,按照一定加酶比加入木瓜蛋白酶和纤维素酶(加酶总量为底物的1%),在恒温振荡器上振荡一定时间,用100 ℃沸水锅水浴10 min,灭酶,在冷却至室温之后,用 8 000 r/min 离心机离心10 min,取上清液,即得到酶提取多糖清液。
1 5 多糖总量的测定
采用苯酚-硫酸比色法 [4]。硫酸-苯酚法是以硫酸、苯酚作为显色剂,与榛蘑多糖发生显色反应,在490 nm波长处测定吸光度,再通过已经测定的葡萄糖标准曲线计算求得榛蘑中的多糖含量。
1 6 蛋白质去除方法
本试验采用Sevage法 [5]来去除榛蘑多糖溶液中的杂蛋白质。配制氯仿-正丁醇溶液,两者的体积比为4 ∶ 1,在榛蘑多糖溶液中加入其1/4体积的氯仿-正丁醇溶液,将其置于大锥形瓶中,充分摇匀30 min之后,静置,去除溶液下面的白色混浊物;取上清液于另一锥形瓶中,重复操作3~4次后,即可除去榛蘑多糖溶液中的蛋白质。
2 结果与分析
2 1 单因素试验条件确定
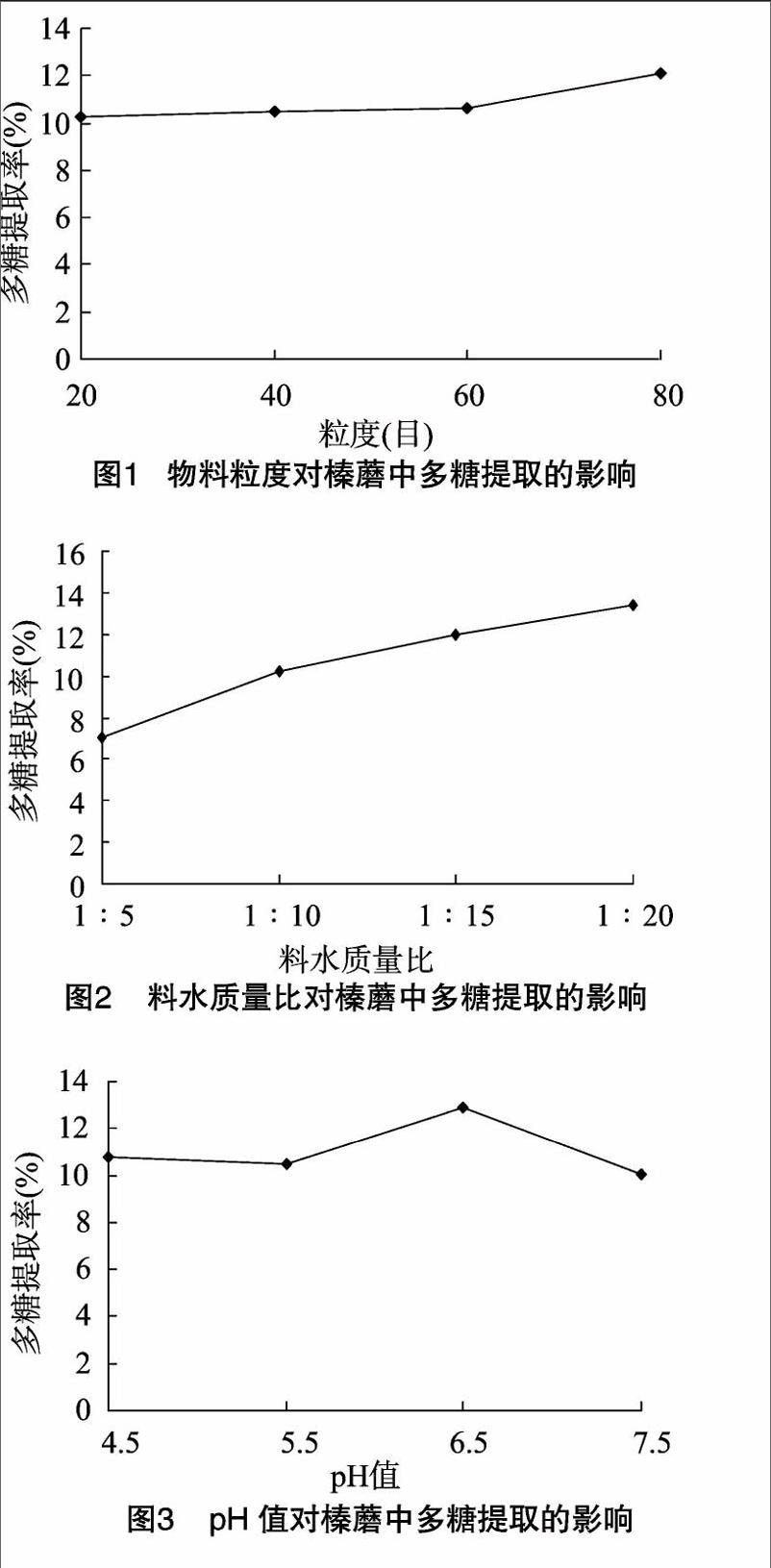
2 1 1 物料粒度对榛蘑多糖提取的影响 从图1可知,20、40、60、80目的榛蘑粉提取的多糖分别为10 26%、1048%、10 65%和12 08%,由此可知80目的榛蘑粉提取的多糖最高,因此试验选定物料粒度为80目。
2 1 2 料水质量比对榛蘑多糖提取的影响 从图2可知,料水质量比为1 ∶ 5、1 ∶ 10、1 ∶ 15、1 ∶ 20的条件下榛蘑粉提取的多糖分别为7 02%、10 24%、11 97%和12 37%,因此试验确定料水质量比为1 ∶ 20。
2 1 3 pH值对榛蘑多糖提取的影响 从图3可知,pH值为4 5、5 5、6 5、7 5的条件下榛蘑粉提取的多糖为1081%、10 47%、12 93%和10 04%,由此可知pH值为6 5时的榛蘑粉提取的多糖最高(图3),因此试验选定pH值为6 5。
2 1 4 温度对榛蘑多糖提取的影响 从图4可知,温度为30、40、50、60 ℃的条件下榛蘑提取的多糖分别为11 63%、12 88%、13 69%和12 59%,当温度在30~50 ℃之间时,随着温度的升高,多糖提取率较快地增长,继续升高温度提取的多糖便有了下降的趋势,因此试验确定温度为50 ℃。
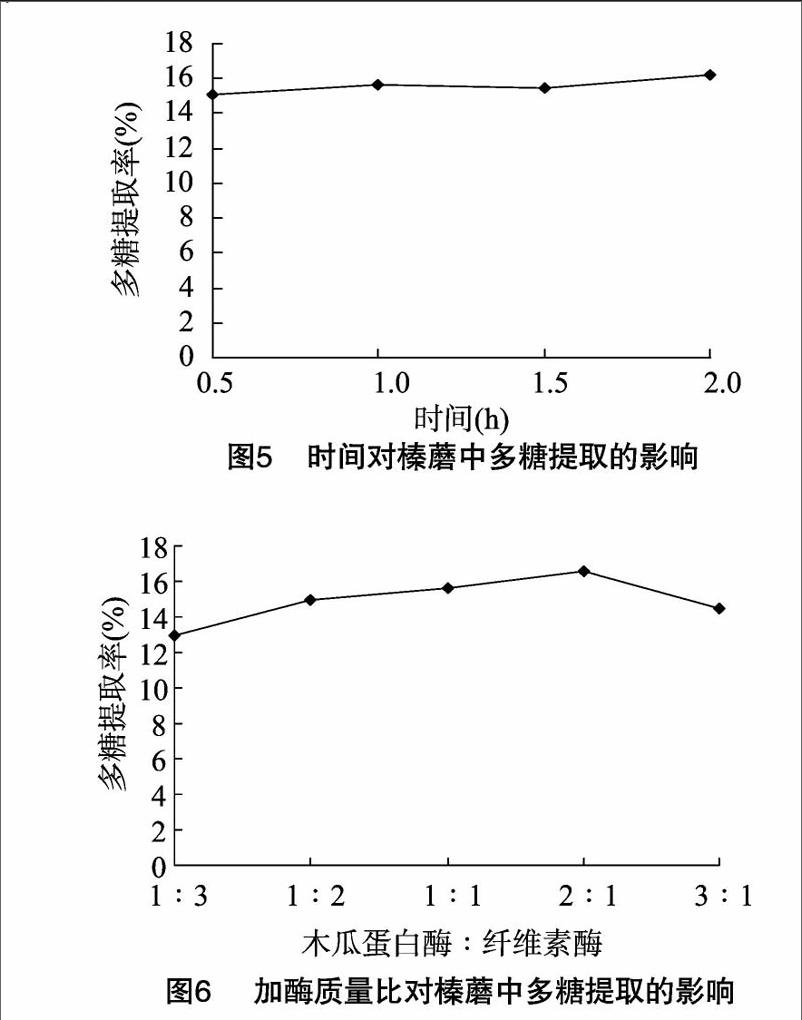
2 1 5 时间对榛蘑多糖提取的影响 从图5可知,时间为0 5、1 0、1 5、2 0 h的条件下测定榛蘑粉的多糖提取率,以2 0 h的条件下最高,因此试验选定时间为2 0 h。
2 1 6 加酶质量比对榛蘑多糖提取的影响 从图6可以看出,当加酶总量为底物的1%时,随着加酶质量比(木瓜蛋白酶:纤维素酶)的增大提取的多糖也逐渐增加,当酶比为3 ∶ 1时,提取率开始下降,考虑到酶的成本及效果,加酶质量比应为2 ∶ 1。
2 2 榛蘑多糖提取的正交试验结果分析
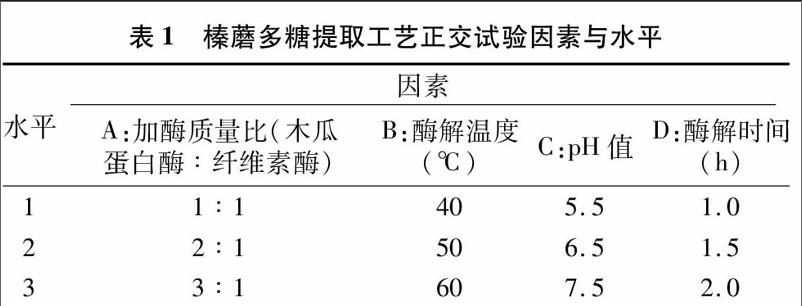
2 2 1 因素与水平 在单因素试验的基础上,选择影响榛蘑多糖提取的主要因素加酶(加酶总量为底物的1%)质量比(木瓜蛋白酶 ∶ 纤维素酶)、酶解温度、pH值、酶解时间进行四因素三水平正交试验(表1),确定提取榛蘑多糖的最佳条件。
2 2 2 正交试验结果 由表2中4个因素的极差值可知,影响榛蘑多糖提取率的4个因素的主次顺序是A>B>D>C。通过正交试验可知复合酶法提取榛蘑多糖的最佳工艺条件为A3B1C2D3,即加酶质量比(木瓜蛋白酶 ∶ 纤维素酶)为 3 ∶ 1,酶解温度为40 ℃,pH值6 5,酶解时间2 0 h,此时榛蘑多糖的提取率为16 85%。
2 3 榛蘑粗多糖的脱色与醇沉提取
将除净蛋白质的多糖溶液用20 g/L的活性炭脱色1 h,抽滤后再10 000 r/min离心10 min。将离心后的上清液放入锥形瓶中,加入大于溶液体积75%的乙醇,然后置于4 ℃冰箱中醇沉24 h。取出后用离心机8 000 r/min离心15 min,取出沉淀物放入表面皿中,在真空干燥箱中干燥,得到榛蘑粗多糖。
2 4 色谱分离纯化
取粗多糖10 mL上柱。用恒流泵控制流速(20 mL/h),自[CM(25]动部分收集器收集,每管收集2 0 mL,用苯酚-硫酸法测定各洗脱液于490 nm处的吸光度,收集其流出液,冷冻干燥得到纯化样品。
2 5 榛蘑多糖结构红外吸收光谱分析结果
红外光谱和分子结构有着极其密切的关系,已成为测定分子结构的一种重要方法。由于红外光谱仪的广泛应用,现在已成为一种常规的分析测试手段。由图7可知,由多糖中O—H、N—H伸缩振动引起3 418 17 cm -1处的峰值;在2 929 88 cm -1处吸收峰是由多糖中C—H的伸缩振动引起的,是糖类的特征吸收;在1 641 61 cm -1处吸收峰是—CHO的C[FY=,1]O的非对称伸缩振动引起的,为肽链上酰胺碳基的吸收峰;在1 402 05 cm -1处吸收峰是由多糖中C—O—C和C—O—H的伸缩振动引起的;在1 247 92 cm -1处的吸收峰是由多糖中C[FY=,1]O的对称性伸缩振动引起的,说明有羧酸的存在;在1 137 32 cm -1处吸收峰是由多糖中D-吡喃葡萄糖伸缩振动引起的;在1 073 57 cm -1处吸收峰是由多糖中β-D-吡喃葡萄糖苷伸缩振动引起的;在871 88 cm -1为β-吡喃环中C1—H的变角振动吸收峰;在805 52 cm -1处是由吡喃环中C1—H的变角振动引起的。由此可知,榛蘑多糖为含有葡萄糖醛酸的β-吡喃多糖。
2 6 榛蘑多糖结构紫外吸收光谱分析结果
紫外吸收光谱应用广泛,可用于有机化合物的结构表征和有机化合物的定量分析 [6]。由图8可知,得到的紫外吸收光谱显示核酸和蛋白质的含量较小,因为在核酸(吸收峰260 nm)和蛋白质(吸收峰280 nm)吸收波长处未出现峰值。
3 结果与讨论
本试验中,首先采用单因素试验确定优化条件,即:物料粒度为80目,料液质量比为1 ∶ 20,然后采用正交试验的方法来进一步优化榛蘑多糖的提取条件,得到提取榛蘑多糖的最佳优化条件,即为提取温度40 ℃,pH值6 5,酶解时间2 0 h, 加酶(加酶总量为底物的1%)质量比(木瓜蛋白酶 ∶ 纤维素酶) 3 ∶ 1,最佳优化条件的榛蘑多糖提取率达到16 85%。
采用Spectum one傅里叶变换红外光谱仪对干燥后的榛蘑多糖进行结构分析,由多糖中O—H、N—H伸缩振动引起 3 418 17 cm -1处的峰值;在2 929 88 cm -1处吸收峰是由多糖中C—H的伸缩振动引起的,是糖类的特征吸收;在1 641 61 cm -1处吸收峰是—CHO的C[FY=,1]O的非对称伸缩振动引起的,为肽链上酰胺碳基的吸收峰;在1 402 05 cm -1处吸收峰是由多糖中C—O—C和C—O—H的伸缩振动引起的;在1 247 92 cm -1处的吸收峰是由多糖中C[FY=,1]O的对称性伸缩振动引起的,说明有羧酸的存在;在1 137 32 cm -1处吸收峰是由多糖中D-吡喃葡萄糖伸缩振动引起的;在1 073 57 cm -1 处吸收峰是由多糖中β-D-吡喃葡萄糖苷伸缩振动引起的;在871 88 cm -1为β-吡喃环中C1—H的变角振动吸收峰;在805 52 cm -1处是由吡喃环中C1—H的变角振动引起的。由此可知,榛蘑多糖为含有葡萄糖醛酸的β-吡喃多糖。
采用Lambda-35型紫外可见光分光光度计对榛蘑多糖进行紫外光谱扫描,得到一条较为光滑的曲线,在260 nm和280 nm处都没有出现峰值,由此可知榛蘑多糖中核酸和蛋白质的含量较少。
参考文献:
[1] 秦俊哲,吕嘉枥 食用菌栽培学[M] 杨凌:西北农林科技大学出版社,2002:213
[2]Franz G Polysaccharides in pharmacy:current applications and future concepts[J] Planta Medica,1989,55(6):493-497
[3]邵信儒,孙海涛,赵晓春 山榛蘑多糖提取工艺研究[J] 食品工业科技,2010,31(2):224-225,228
[4]王小东,慧 玲,王顺启 真菌多糖的研究进展[J] 江西科学,2005,23(3):43-46
[5]Sham P Y,Scaman C H,Durance T D Texture of vacuum microwave dehydrated apple chips as affected by calcium pretreatment,vacuum level and apple variety[J] Journal of Food Science,2001,66(9):1341-1347
[6]叶姜瑜,谈 锋 紫芝多糖的纯化及组分分析[J] 西南师范大学学报:自然科学版,2002,27(6):945-949
