核桃内生放线菌的分离、鉴定及抗菌活性
2015-09-10李雪玲陈华红崔文艳等
李雪玲 陈华红 崔文艳等
摘要: 分别从生长于云南楚雄的核桃根、茎、叶中分离内生放线菌,并对分离菌株进行纯化、保存。通过对分离菌株生长特性、形态观察、分子分类等研究,对菌株进行初步鉴定与抗菌活性研究。结果表明,共分离得到42株内生放线菌,其中从根中分离11株、从茎中分离12株、从叶中分离19株,分离菌株均属于链霉菌属。试验内生放线菌菌株SA8对拟盘多毛孢、链格孢、德氏孺孢、灰葡萄孢、疫霉这5种病原菌均有抑菌作用。
关键词: 核桃;内生放线菌;分离;鉴定;抗菌活性
中图分类号:S664.101 文献标志码:A
文章编号:1002-1302(2015)08-0106-04
放线菌(actinomycete)是抗生素的主要产生菌,目前从微生物中发现的8 000多种活性物质中,有近70%是放线菌产生的,目前放线菌已被广泛用于工业、农业和医学领域 [1-2]。如我国研制开发的井冈霉素、多效霉素农用链霉素等生物农药已经大量使用,产生了较大的社会、经济和生态效益 [3]。植物内生菌(plant endophyte)作为一类重要的微生物资源具有重要的理论研究价值和开发潜力,其中植物内生放线菌具有独特的代谢和遗传机制,在植物病害生物防治中有广阔的应用开发前景,现已成为国内外学者研究的热点 [4-5]。内生放线菌可用于控制植物病害,已分离得到的一些内生放线菌菌株,多数对引起植物病害的真菌具有抗菌作用。从小麦中分离到的38株内生放线菌,大部分对小麦病原菌Gaeumannomyces graminis var. tritici表现出抑制活性 [6]。从1株野生的烈香杜鹃中分离到的Streptomyces sp. R-5,对杜鹃花属植物的2种主要的病原真菌Phytophthora cinnamomi、Pestalotiopsis sydowiana具有拮抗活性,对革兰氏阳性细菌、酵母菌和丝状真菌也具有广泛的抗菌性,可产生actinomycin X2和fungichromin [7-8]。从香蕉中分离得到的Streptomyces sp. S96可增强植物对香蕉镰刀菌萎蔫病的抗性,促进植物的生长 [9]。此外,从植物内生放线菌中筛选的生防菌及其分泌的抗菌素在植物各种病害中均取得了良好的防治效果 [10]。地球上植物种类繁多,从丰富的植物宿主中寻找新内生菌菌种资源的机率较高 [11]。而植物内生放线菌可作为进一步筛选生物活性物质的种质资源,因此,植物内生放线菌研究有着广阔的发展前景和重要的研究意义。
核桃(Juglans regia)是我国栽培历史悠久的经济树种之一,在全国20多个省(市、区)均有栽培。在云南省楚雄,核桃是极为重要的经济作物,2001年大姚被国家林业局授予“中国核桃之乡”。但随着核桃的大面积种植,核桃病害的危害日趋严重,如由真菌引起的枝枯病、腐烂病、溃疡病等对核桃品质和产量产生了较大影响。因此,通过对生长于云南楚雄的核桃内生放线菌进行研究,旨在为核桃内放线菌资源分析、防治核桃病害提供一定的理论依据,有助于核桃产业健康发展。
1 材料与方法
1.1 试验材料
试验材料为取自楚雄不同地区无病斑、无虫害的健康核桃树的根、茎、叶。
1.2 分离培养基
内生菌分离培养基:TWYE培养基(0.25 g yeast extract,0.5 g KH2PO4,1 L蒸馏水,15 g 琼脂),琥珀酸钠培养基(2 g琥珀酸钠,0.3 g KH2PO4,0.1 g MgSO4·7H2O,1 g CaCO3,001 g FeSO4·7H2O,15 g 琼脂,1 L ddH2O,pH值7.2),苹果酸钠培养基(0.6 g苹果酸钠,0.2 g MgSO4·7H2O,0.01 g FeSO4·7H2O,0.6 g CaCO3,0.3 g KH2PO4,0.5 g KNO3,15 g 琼脂,1 L ddH2O,pH值7.2),纤维素培养基(0.5 g纤维素,0.5 g Na2HPO4,3 g yeast tract,0.05 g MgSO4·7H2O,0.01 g FeSO4·7H2O,3 g KNO3,2 g CaCO3,15 g琼脂,1 L ddH2O),ISP5培养基[1 g L-天门冬氨酸,10 g甘油,1 g K2HPO4,1 mL 微量盐(0.1 g FeSO4·7H2O,0.12 g MnSO4,0.1 g ZnSO4,100 mL 蒸馏水),pH值7.0~7.4,20 g琼脂,1 L蒸馏水]。
使用高氏Ⅰ号培养基(20 g可溶性淀粉,1 g KNO3,0.5 g NaCl,0.5 g K2HPO4,0.5 g MgSO4,0.01 g FeSO4,pH值7.0~7.4,20.0 g琼脂,1 L蒸馏水)富集培养。
1.3 指示菌
拟盘多毛孢(Pestalotiopsis spp.)、链格孢(Alternaria spp.)、德氏孺孢(Drechslera spp.)、灰葡萄孢(Botrytis cinerea)、疫霉(Phytophthora spp.)。
1.4 菌种分离
分别选取不同核桃组织,冲洗干净后,将根、茎、叶分别进行表面消毒(0.01% Tween 20 浸泡1 min→ 70%乙醇溶液处理2 min→无菌去离子水洗4~5次→有效氯含量为5%的次氯酸钠浸泡5 min→硫代硫酸钠溶液浸泡10 min→无菌去离子水洗4~5次)。取0.5 mL最后一遍清洗植物样品的水涂布于TSA 固体培养基(15 g酪蛋白胨,5 g大豆蛋白胨,5 g NaCl,15 g琼脂,pH值7.2)上,28 ℃条件下培养1周,检测表面消毒效果。将表面消毒的植物组织打碎,均匀接种于分离培养基,置于28 ℃恒温培养箱中培养1~3周,至组织块上出现内生放线菌菌丝后,挑取菌丝用TWYE培养基进行划线纯化,纯化的菌株移入高氏Ⅰ号 [12]斜面中培养后保存。
1.5 DNA提取和16S rRNA 基因扩增
组DNA采用螯合树脂法(chelex)提取分离放线菌菌株DNA [13-15]。扩增引物由上海生工生物工程技术服务有限公司合成。 PA:5′-AGAGTTTGATCCTGGCTCAG-3′;PB:5′-TTAAGGTGATCCAGCCGCA-3′。PCR扩增条件:95 ℃预变性5 min;95 ℃变性1 min,54 ℃ 退火1 min,72 ℃延伸3 min,30个循环;72 ℃延伸10 min。
1.6 扩增产物测序
16S rRNA基因扩增产物经纯化后,送往上海生工生物工程技术服务有限公司,用ABI 3730 DNA Sequencer (applied biosystems)测序。测序引物:P1:5′-CGGAATTATTGGGCGTA-3′; P2:5′-CCTTACCTGGGCTTGACAT-3′;P3:5′-CCTTACCTGGGCTTGACAT-3′。
1.7 16S rRNA系统发育分析
将测得的序列利用Eztaxon Server 2.1 在GenBank数据库中进行相似性搜索,选取同源性高的典型菌株的16S rRNA基因序列作为参比对象。采用MEGA 4软件进行多序列比对及系统发育分析。采用邻接法和最大似然法构建系统进化树。
1.8 内生放线菌的形态特征
采用搭片法观察分离菌株显微形态特征 [14],根据菌株菌落和菌丝形态特征排除重复菌株。
1.9 分离菌株生长特性试验
1.9.1 生长温度
使用高氏Ⅰ号平板,接种后分别在4 ℃、10 ℃、15 ℃、室温(约22 ℃)、28 ℃、37 ℃、45 ℃、55 ℃条件下培养,每2 d观察记录1次,连续培养1周,重复1次。
1.9.2 生长盐浓度
别配制含0、3%、5%、7%、10%、15%NaCl的高氏Ⅰ号固体培养基,接种后在28 ℃条件下培养,每2 d观察记录1次,连续培养1周,重复1次。
1.9.3 生长pH值
使用高氏Ⅰ号培养基加入相应缓冲剂,分别配制pH值4.0~5.0、6.0~8.0、9.0~10.0、11的液体培养基,接种后于28 ℃条件下培养,每2 d观察记录1次,连续 培养10 d,重复1次。缓冲液配方:pH值4.0~5.0,0.1 mol/L 柠檬酸- 0.1 mol/L 柠檬酸钠;pH值6.0~8.0,0.1 mol/L KH2PO4+0.1 mol/L NaOH;pH值9.0~10.0,0.1 mol/L NaHCO3+0.1 mol/L Na2CO3;pH值11,0.05 mol/L Na2HPO4+0.1 mol/L NaOH。
1.10 分离菌株的抗菌活性筛选
1.10.1 分离菌株发酵
选取18个放线菌菌株接种于高氏液体培养基中,在28 ℃、200 r/min摇床中培养10 d,发酵液用乙酸乙酯浸提48 h,高速离心,取上清液用旋转蒸发仪蒸干,加入无菌水制成发酵样品。
1.10.2 指示菌的活化及培养 将拟盘多毛孢、链格孢、德氏孺孢、灰葡萄孢和疫霉5种指示菌菌株接种于PDA固体培养基上恒温培养4~6 d,活化,用于抑菌试验。活化好的病原菌接种于PDA 液体培养基,在28 ℃、120 r/min 摇床中培养至对数生长期。
1.10.3 抑菌试验
取200 μL菌液加入PDA培养基制成含菌平板,采用滤纸片法进行抑菌试验,28 ℃恒温培养48 h,测量抑菌圈的直径,以两性霉素溶液40 g/mL为阳性对照。
2 结果与分析
2.1 不同培养基的分离效果
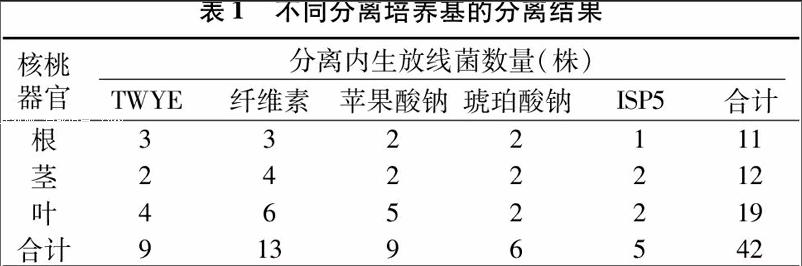
核桃根、茎、叶组织接入5种不同培养基中,共得到42株内生放线菌,其中从叶中分离得到的内生放线菌数量最多,共19株,占分离菌株总数的45.2%;其次为茎,分离到12株,占28.7%;根部分离到的菌株最少,仅为11株,占26.1%(表1)。对核桃不同器官进行内生放线菌分离的结果为:从叶中分离的最多,其次为茎,根中分离的最少。
植物根、茎、叶组织块分别接入5种不同培养基中,在纤维素培养基中分离得到的内生放线菌数量最多,分离到13株;其次是TWYE培养基和苹果酸钠培养基,ISP5培养基分离效果较差。由试验结果可得,5种培养基中,纤维素培养基最适合分离植物内生放线菌,TWYE培养基和苹果酸钠培养基次之,最不适宜分离植物内生放线菌的是ISP5培养基。
2.2 生长温度
在不同温度下,核桃内生放线菌生长的情况不同,所有分离菌株在28 ℃下均可观察到生长现象,而在4 ℃、10 ℃、15 ℃、室温、37 ℃、 45 ℃下仅有部分菌株生长,而在55 ℃条件下分离的菌株均不生长。因此,在28 ℃最适宜下菌株生长,这可能与核桃生长的环境温度为28 ℃左右有关。
2.3 生长盐浓度
核桃内生放线菌分离株在不同NaCl浓度下,生长的情况不同。核桃内生放线菌在含3%、5%、7%NaCl的高氏Ⅰ号培养基上均可观察到生长现象,在含10%、15%NaCl的培养基中则不能观察到生长现象;在不含NaCl的培养基中,所有放线菌分离菌株均生长最为旺盛,所有分离菌株在含3%NaCl的培养基上生长也较好。42个分离菌株中,有2个分离菌株不能在含5%NaCl的培养基上生长,有4个分离菌株不能在含7%NaCl的培养基上生长。菌株RA7和L8号菌耐受的NaCl浓度范围较狭窄,仅可以在3%及以下的NaCl浓度下生长。其次是菌株SA8和菌株R9,仅能在3%、5%NaCl浓度下生长。以上结果表明,核桃内生放线菌生长NaCl浓度范围是3%~7%,在不含NaCl条件下最适合核桃内生放线菌的生长。在一定生长盐浓度范围内,其生长随NaCl浓度升高而受抑制,高盐环境可抑制核桃内生放线菌的生长。
2.4 生长pH值范围
本试验结果表明,在不同pH值条件下,核桃内生放线菌生长情况各不相同。在pH值6.0~8.0条件范围内,所有试验菌株都生长旺盛,在pH值9.0~10.0时,有28株生长,占66%;在pH值4.0~5.0时,大部分试验菌株未观察到生长现象,仅有4株菌生长,占所有菌株的9.5%;在pH值11.0时,无菌株生长。因此,pH值6.0~8.0为核桃所有内生放线菌分离株的最适生长pH值范围,过高pH值环境和过低pH值环境均抑制其生长。
2.5 16S rRNA系统分析
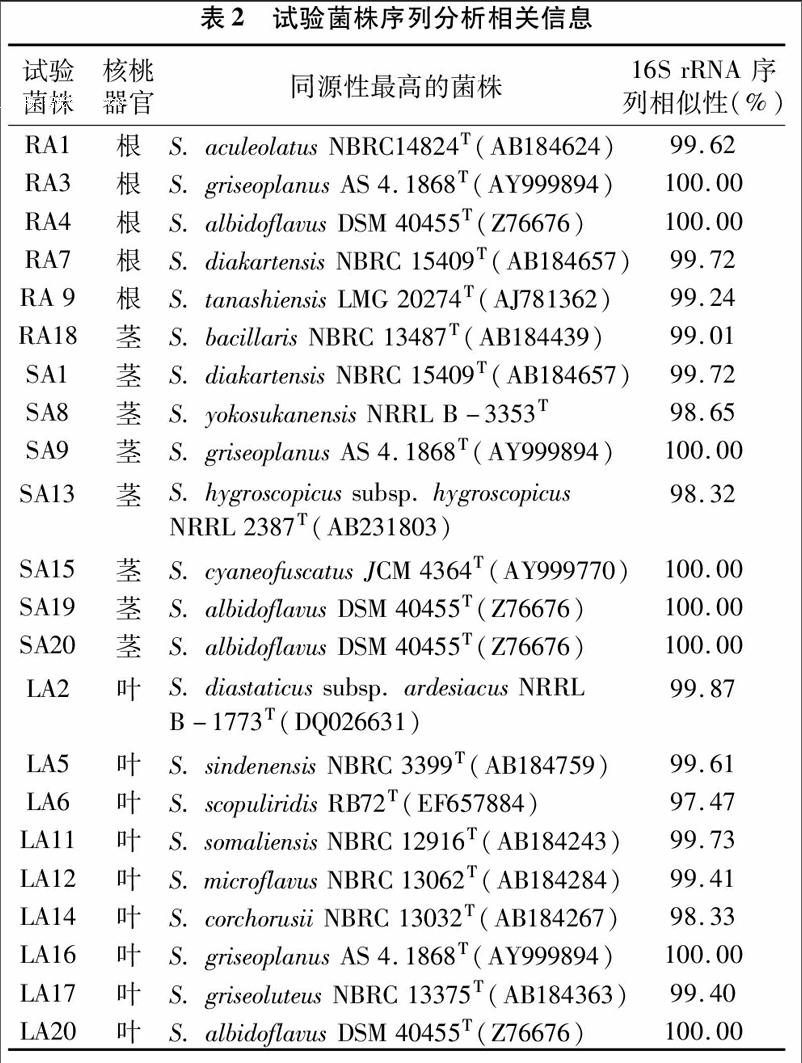
根据菌株形态特征,选取22个菌株提取组DNA,进行16S rRNA PCR扩增,扩展产物送上海生工生物工程技术服务有限公司测序,将测出有效序列用Blast程序与GenBank 中相关属种的16S rRNA序列比对,初步判定菌株的类群,结果显示22个测序放线菌菌株均属于链霉菌属,分别与链霉菌属16个有效发表种的序列同源性最高(表2),这说明链霉菌属是核桃内生放线菌中的优势菌群。
2.6 核桃内生放线菌抑菌效果
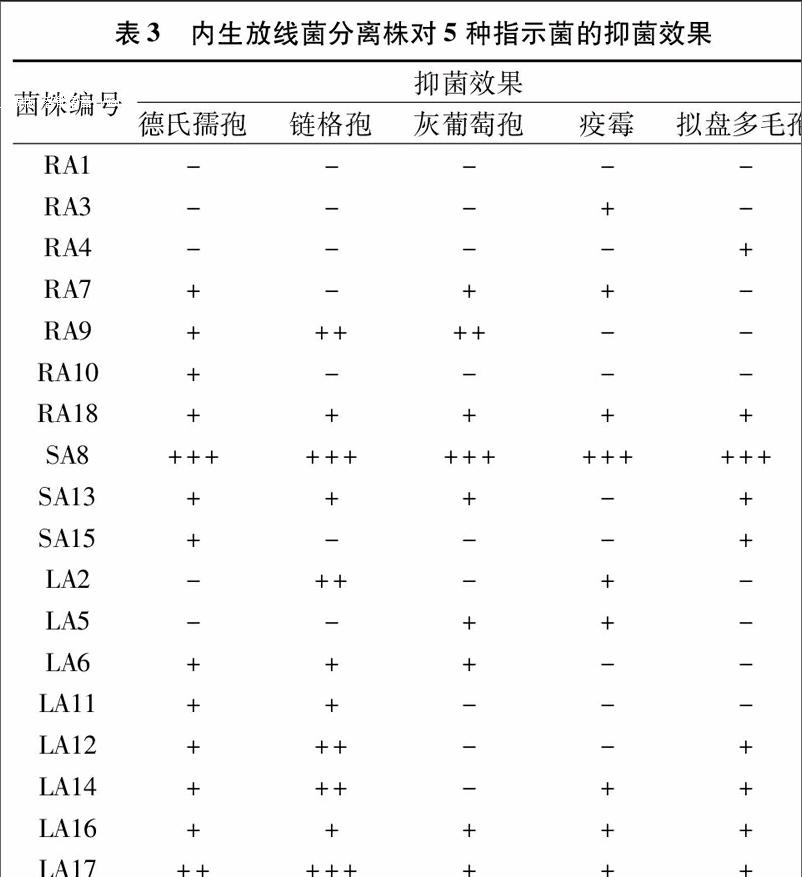
由表3可知,18株分离自核桃的内生放线菌中,有13株菌株对德氏孺孢的生长有抑制作用,所占百分比为72.2%;其中,有2株菌株对德氏孺孢的生长有较强抑制作用,占检测菌株的11.1%;分离自核桃茎的菌株SA8对德氏孺孢的生长有明显抑制效果,因此菌株SA8可进一步研究,应用于防治德氏孺孢引起的植物病害。18株内生放线菌菌株中,有11株菌对链格孢生长有抑制作用,占检测菌株的61.1%;其中,有6株菌株对链格孢的生长有较为明显的抑制效果,占检测菌株的33.3%;菌株SA8和LA17对链格孢生长的抑制作用最为明显。有9株菌株对灰葡萄孢的生长有抑制作用,占检测菌株的50%;其中,有2株菌株对灰葡萄孢生长的抑制效果较为明显,占检测菌株的11.1%;有9株试验菌株对拟盘多毛孢的生长有抑制作用,占检测菌株的50%;其中,菌株SA8对拟盘多毛孢生长有较强的抑菌效果。有9株试验菌株对疫霉的生长有抑制作用,占检测菌株的50%;其中,菌株SA8对疫霉生长有较强的抑菌效果。
检测的内生放线菌中,有4株菌株对德氏孺孢、链格孢、灰葡萄孢、疫霉、拟盘多毛孢这5种病原菌均有抑制作用,占检测菌株的22.2%;有2株菌株对4种病原菌有抑制作用,占检测菌株的11.1%;有4株菌株对3种病原菌有抑制作用,占检测菌株的22.2%;有4株菌株对2种病原菌有抑制作用,占检测菌株的22.2%;有3株菌株对1种病原菌有抑制作用,占检测菌株的16.7%;有1株菌株对所有病原菌均无抑制作用。试验菌株SA8对5种病原菌均有明显抑制作用。
比较从核桃不同器官中分离到的内生放线菌发现,植物不同部位分离得到的内生放线菌数量、种类均差异较大。从 核桃不同器官中分离到的内生放线菌数量从多到少依次为叶> 茎>根。这表明植株叶内的内生放线菌数量最多,而从根部获得的内生放线菌数量最少。这可能是由于根部分布细菌较多,影响了内生放线菌的分离,内生放线菌的分布规律还须要进一步结合免培养法进行研究。
从不同分离培养基对核桃内生放线菌的分离效果看,不同培养基分离得到的内生放线菌数量和类群各不相同。在5种分离培养基中,纤维素培养基的分离效果最好,分离得到的内生放线菌数量最多,种类也最丰富;ISP5培养基的分离效果最差,苹果酸钠培养基与TWYE培养基分离效果相近。这可能是由于纤维素在植物体内的含量丰富,对核桃内生放线菌的生长有一定的促进作用。苹果酸钠培养基和TWYE培养基的有机物含量均较少,营养较为贫瘠,可在一定程度抑制细菌的生长,有利于分离内生放线菌,因此分离效果尚可。而ISP5培养基营养较为丰富,细菌生长迅速,因此不利于分离内生放线菌。在本研究中所用的琥珀酸钠培养基有机物含量也较少,但分离效果不理想,不适合核桃内生菌的分离。
生长特性试验结果表明,多数分离菌株的生长温度范围是15~45 ℃,最适生长温度是28 ℃;生长NaCl浓度范围是 0~7%,在不含NaCl时生长最好;生长pH值范围是6.0~100,最适范围是pH值6.0~8.0,因而核桃内生放线菌的生长特性与多数土壤放线菌类似。
对试验菌株的16S rRNA 基因进行PCR扩增、测序,序列分析结果表明,分离菌株与链霉菌属多个有效发表种序列相似性较高,因此,从核桃分离到的内生放线菌均为链霉菌属的菌株,链霉菌是核桃的优势放线菌类群。
灰葡萄孢菌能引起蔬菜、瓜果、花卉等作物的灰霉病、腐烂病和霉烂病。20世纪70年代以来人们相继采用多种杀菌剂控制此病菌的危害,但由于该病菌的遗传变异大、适应性强,已经产生了抗药性 [16-17],因此该病害的防治没有得到彻底的根治,筛选生防菌进行生物防治的研究日趋必要。本研究的抑菌试验结果表明,RA9和SA8菌株对灰葡萄孢的生长有较强的抑菌效果,可作为灰葡萄孢引起的植物病害的生防菌,但其抑菌成分及机制还应进一步研究,以便为研发安全高效的微生物农药和菌肥的开发提供优质的菌种资源。
拟盘多毛孢属在云南大理州对核桃的叶、花、枝和果产生严重危害,影响核桃生长和产量 [18]。目前,对拟盘多毛孢引起的植物病害的防治仍主要采用传统的化学农药防治。疫霉属可诱发许多植物病害,但该病菌生理分化明显、遗传变异迅速,现有措施难以完全有效控制该病。本研究结果表明,分离菌株SA8对拟盘多毛孢和疫霉的生长具有明显的抑制作用,因此可作为研发安全高效的微生物农药的菌种资源。
链格孢属主要引起核桃的顶端坏死病、褐斑病和黑斑病等 [19]。针对这些病害采取多种防治方法,德氏孺孢能引起许多植物病害如离孺孢叶枯病、弯孢霉叶枯病、德氏霉叶枯病、叶斑病等 [20]。本研究从核桃内生组织中分离出的SA8和YA17菌株对链格孢和德氏孺孢的生长具有明显的抑制作用,可为核桃病害的生物防治研究提供菌种资源。
本研究结果表明,核桃内生放线菌数量丰富;核桃不同部位的内生放线菌在数量、类群分布和优势类群方面存在较大差异,这可能与核桃不同部位组织不同,微生态环境不同有密切关系。同时用不同分离培养基分离得到的核桃内生放线菌类群、数量及其优势类群都具有较为明显的差异。这说明不同分离培养基可选择性分离不同的内生放线菌,同时也说明通过进一步改进分离技术有可能获得更多的可培养内生放线菌。部分分离菌株对多种常见植物病原真菌具有拮抗活性,分离自核桃茎的内生放线菌菌株SA8对本研究中检测的5种指示菌均具有明显的拮抗活性,在植物病害的生物防治方面具有较大的开发潜力。菌株SA8的16S rRNA基因序列分析结果表明,其与有效发表种Streptomyces yokosukanensis NRRL B-3353T的关系最近,序列同源性为98.65%,其具体分类地位还须要进一步研究。
[JP3]植物内生放线菌在新型农用抗生素的研究方面具有较大开发潜力,本研究结果表明,从核桃内生放线菌分离株中筛选到具有开发潜力的活性菌株的概率较高。因此,内生放线菌资源可作为生防菌株筛选和新生物活性物质研究的重要微生物资源。
[HS2*3][HT8.5H]参考文献:
[1] 黄晓辉,李 珊,谭周进,等. 植物内生放线菌研究进展[J]. 生物技术通报,2008(1):42-46.
[2]Lazzarini A,Cavaletti L,Toppo G,et al. Rare genera of actinomycetes as potential producers of new antibiotics[J]. Antonie van Leeuwenhoek,2000,78(3/4):399-405.
[3]王 燕,宗兆锋,程联社. 放线菌在植物病害生物防治中的应用[J]. 杨凌职业技术学院学报,2005,4(3):21-23.
[4]张 丽,孙书娥. 利用微生物防治植物病害研究进展[J]. 农药研究与应用,2010,4(6):10-13,24.
[5]Benson D R,Silvester W B. Biology of frankia strains,actinomycete symbionts of actinorhizai plants[J]. Microbiological Reviews,1993,57:293-319.
[6]Coombs J M P,Franco C. Evaluation of endophytic actinobacteria as antagonists of Gaeumannomyces graminis var. tritici in wheat[J]. Biological Control,2004,29:359-366.
[7]Shimizu M,Igarashi Y,Furumai T,et al. Identification of endophytic Streptomyces sp. R-5 and analysis of its antimicrobial metabolites[J]. Journal of General Plant Pathology,2004,70(1):66-68.
[8]Shimizu M,Nakagawa Y,Sato Y,et al. Studies on endophytic actinomycetes (Ⅰ) Streptomyces sp. isolated from rhododendron and its antifungal activity[J]. Journal of General Plant Pathology,2000,66(4):360-366.
[9]Cao L X,Qiu Z Q,You J L,et al. Isolation and characterization of endophytic streptomycete antagonists of Fusarium wilt pathogen from surface-sterilized banana roots[J]. FEMS Microbiology Letters,2005,247(2):147-152.
[10] 曾 莉,朱孟沼,刘树芳,等. 筛选放线菌活性产物防治烟草黑胫病的初步研究[J]. 西南农业学报,2006,33(6):1074-1077.
[11]陈华红,杨 颖,姜 怡,等. 植物内生放线菌的分离方法[J]. 微生物学通报,2006,33(4):182-185.
[12][JP3]周德庆. 微生物学实验教程[M]. 北京:高等教育出版社,2006:372.
[13]周双清,黄小龙,黄东益,等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报,2010(2):123-125.
[14][JP3]周德庆. 微生物学实验教程[M]. 北京:高等教育出版社,2006:57.
[15]阎逊初. 放线菌的分类和鉴定[M]. 北京:科学出版社,1992:296-298.
[16]沈卫锋,翁宏飚,牛宝龙,等. 根癌农杆菌介导的灰葡萄孢菌遗传转化研究[J]. 遗传,2008,30(4):515-520.
[17]关丽杰,杨 迪,邵 双,等. 灰葡萄孢菌拮抗放线菌的筛选[C]//中国植物病理学会2009年学术年会论文集,2009:554-557.
[18]马建鹏,涂国信,孔 暄,等. 核桃病害病原菌Pestalotiopsis sp.的防治研究[J]. 林业调查规划,2010,35(6):93-95.
[19]曲文文,刘 霞,杨克强,等. 山东省危害核桃的链格孢属真菌鉴定及其系统发育[J]. 植物保护学报,2012,39(2):121-128.
[20]张成霞,南志标,李春杰,等. 杀菌剂拌种防治草坪草病害的研究进展[J]. 草业学报,2005,14(6):14-22.
