异养硝化-好氧反硝化菌脱氮同时降解苯酚特性
2015-08-30王国英岳秀萍李亚男贾子龙太原理工大学环境科学与工程学院山西太原030024
王国英,崔 杰,岳秀萍,李亚男,贾子龙 (太原理工大学环境科学与工程学院,山西 太原 030024)
异养硝化-好氧反硝化菌脱氮同时降解苯酚特性
王国英,崔 杰,岳秀萍*,李亚男,贾子龙 (太原理工大学环境科学与工程学院,山西 太原 030024)
研究了异养硝化-好氧反硝化菌Diaphorobacter sp. PDB3去除氨氮同时降解苯酚的特性.在最佳碳氮比7和摇床转速160r/min下,该菌在21h内对初始浓度365mg/L苯酚的降解率达94.9%,总有机碳去除率达90.8%,同时40mg N/L氨氮被完全去除,中间代谢物硝态氮和亚硝态氮逐渐积累并在后期降低.氮平衡分析表明,52.3%的氨氮转化为胞内氮,37.2%转化为氮气,菌株主要通过细胞同化作用和异养硝化-好氧反硝化作用去除氨氮.检测到羟胺氧化酶、硝酸还原酶及亚硝酸还原酶活性,表明菌株PDB3具有完整的异养硝化-好氧反硝化偶联途径.随着苯酚浓度升高,抑制作用增强,脱氮效率降低.
异养硝化;好氧反硝化;苯酚;氨氮
苯酚是焦化、石油化工等工业排放废水中主要污染物之一[1-2].酚类废水往往同时含有氨氮,是水体中的主要耗氧污染物[3].因此同时去除苯酚和氨氮对于含氨氮酚类废水的高效处理十分必要.一些研究者[4-7]发现,苯酚和氨氮的去除可通过自养硝化菌和异养菌在好氧条件下配合完成,但是苯酚对自养硝化产生强抑制作用,降低硝化速率,如 Amor等[4]发现,苯酚完全降解后硝化反应才开始,Liu等[7]发现,15mg/L苯酚存在时硝化产物硝态氮的产生速率为没有苯酚时的 77%.此外,氨氮仅被氧化为硝态氮或亚硝态氮,其仍需在厌氧或缺氧条件下还原为氮气,造成系统复杂、过程耗时.
传统脱氮理论认为硝化和反硝化是两个独立的过程[8-9].然而近些年来,一些异养硝化-好氧反硝化菌被分离出来[10-14],这些细菌进行异养硝化同时进行好氧反硝化反应,将氨氮最终转化为氮气.与自养硝化菌比,这些菌具有生长速度快,环境适应能力强,去除氨氮同时降解有机物等优点.但是此类研究多以乙酸、琥珀酸和柠檬酸等有机酸为碳源,对以毒害物质如苯酚、甲酚等为底物的研究鲜有报道.
本实验室前期分离得到一株异养硝化-好氧反硝化苯酚降解菌Diaphorobacter sp. PDB3[15],对其降解苯酚和反硝化特征进行了研究,但是其异养硝化特性和脱氮途径还未明了.本研究考察菌种的氨氮去除和苯酚降解特征,对脱氮产物及脱氮途径进行分析,为异养硝化-好氧反硝化苯酚降解菌的实际应用提供理论依据.
1 材料与方法
1.1材料
1.1.1菌株 异养硝化-好氧反硝化苯酚降解菌Diaphorobacter sp. PDB3由本实验室筛选保藏[15].
1.1.2培养基 LB培养基(g/L):胰蛋白胨10,酵母浸出粉 5,NaCl 10.pH 7.2.
无机盐培养基(g/L):NH4Cl 0.153,K2HPO40.5, KH2PO40.5, CaCl20.1, MgSO4∙7H2O 0.2, NaMoO4∙2H2O 0.01, MnSO4∙H2O 0.01, Fe2(SO4)3∙H2O 0.01, ZnSO4∙7H2O 0.01, CuSO4∙5H2O 0.01, CoCl2∙6H2O 0.01.pH 7.2.
以上培养基用高压蒸汽灭菌器在 121℃灭菌20min,苯酚按需要量加入.
1.2实验方法
1.2.1摇床实验 将菌株接种至含有 100mg/L苯酚的LB培养液中,在摇床中连续活化2代,将细胞清洗后接种至含有苯酚的100mL无机盐培养基中,30℃下摇瓶振荡培养,每隔适宜时间取样检测细胞浓度,在4℃及8000r/min下离心15min,取上清液测量苯酚、总有机碳(TOC)、总氮(TN)、NH4+-N、NH2OH-N、NO3--N及NO2--N含量.
1.2.2氮平衡分析实验 将100mL含有苯酚的无机盐培养基装入250mL厌氧瓶,接种后向厌氧瓶中充入纯氧气,用瓶塞塞紧瓶口,在 30℃下振荡培养27h.用注射器取瓶中气体测量O2、N2和N2O含量.取培养液离心后取上清液测量苯酚、TN、NH4+-N、NH2OH-N、NO3--N及NO2--N,取沉淀测量胞内氮.
1.2.3细胞粗酶液的提取 将菌株接种至无机盐培养基中,培养至对数生长期后期,将菌液在4℃,12000r/min下离心,收集菌体,用磷酸盐缓冲液清洗2次后重悬细胞,置于冰水混合物中,用超声破碎仪破碎细胞,再次12000r/min离心,收集上清液,即为粗酶液.以上实验均重复3次.
1.3分析方法
细胞浓度的测定采用可见分光光度法,在600nm波长下测定培养液的吸光度(OD600),根据细胞干重标准曲线将其转换为细胞干重;溶解氧采用溶解氧分析仪(HQ30d,美国哈希)测量;TOC 和TN用TOC/TN分析仪 (TOC-VCPH/TNM-1,日本岛津)测量; NH4+-N、NO2--N和NO3--N的测定分别采用纳氏试剂分光光度法、N-(1-萘基)-乙二胺分光光度法和酚二磺酸分光光度法;NH2OH-N测定参照文献[16];有机氮为TN减去NH4+-N、NO2--N及NO3--N之和;胞内氮含量用元素分析仪(EA3000,意大利欧维特)测量;苯酚用高效液相色谱仪(P1201,大连依力特)测量;O2和 N2用配有热导检测器的气相色谱仪(456GC,美国布鲁克)测量;N2O用配有电子捕获器的气相色谱仪(6890,美国安捷伦)测量.
酶活分析参照 Zhao等[17]的方法:羟胺氧化酶测定体系10mL,内含10mmol/L Tris-HCl缓冲液(pH7.1),0.11mmol/L细胞色素c和粗酶液;硝酸还原酶和亚硝酸还原酶测定体系各 10mL,内含10mmol/L 磷酸盐缓冲液(pH7.4),0.2mmol/L NADH和粗酶液.分别向反应体系中加入羟胺、NaNO3及 NaNO2,并测定羟胺消耗速率、NO2-生成速率及 NO2-消耗速率.总蛋白含量用Bradford法测定[18].活力单位(U)为每分钟转化1µmol 底物所需酶量.酶的比活力以每毫克的蛋白质中所含酶的活力单位数计算.
2 结果与讨论
2.1碳氮比对苯酚降解和氨氮去除的影响
如图 1所示,随着碳氮比升高,Diaphorobacter sp. PDB3对氨氮的去除率升高,苯酚降解率降低,当碳氮比升高至13时,苯酚降解率下降至61.2%.苯酚为菌体生长代谢提供能源和碳源,低碳氮比时碳源不足,细胞代谢能力不足,导致氨氮去除率较低;高碳氮比时,碳源的供给高于菌体所需,碳源浓度不再是限制性因素,氨氮去除率不再增加.当碳氮比为7时,苯酚降解率和氨氮去除率都处于较高的水平,因此最佳碳氮比为7.
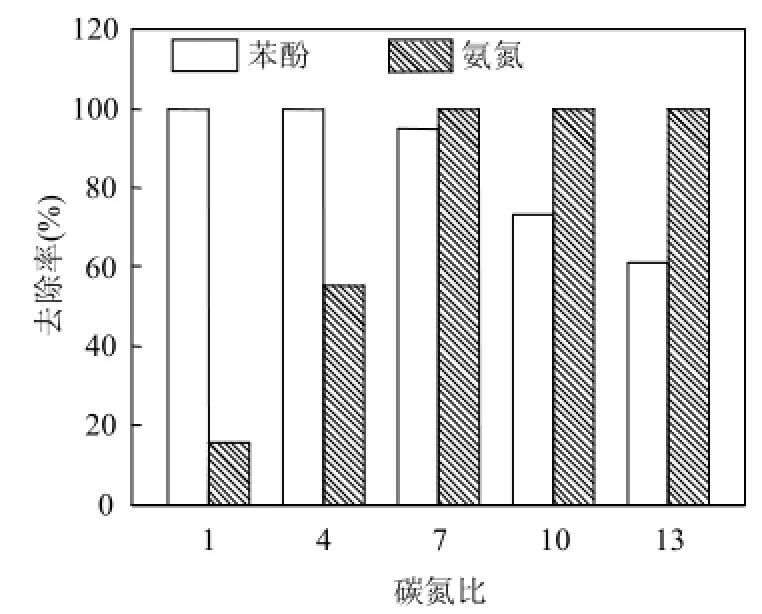
图1 碳氮比对苯酚降解和氨氮去除的影响Fig.4 Effect of C/N ratio on phenol degradation and ammonium removal
2.2摇床转速对苯酚降解和氨氮去除的影响
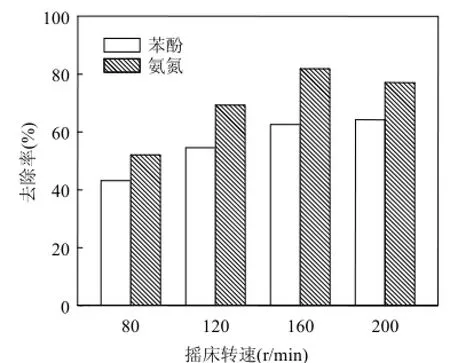
图2 摇床转速对菌株培养15h后苯酚降解和氨氮去除的影响Fig.4 Effect of shaking speed on phenol degradation and ammonium removal after strain incubation for 15h
苯酚好氧降解的第一步是苯酚被苯酚羟化酶催化为邻苯二酚,异养硝化的第一步是氨被氨单加氧酶催化为羟胺,这2个反应都需要氧分子的参与,因此溶氧可影响 Diaphorobacter sp. PDB3的苯酚降解和氨氮去除能力.在摇床转速80,120,160,200r/min下实验初期(1h)培养液的溶氧 分 别 为 (5.43±0.02),(6.11±0.03),(6.62±0.04),(6.80±0.04)mg/L,因此提高摇床转速可以提高培养液中溶氧水平.如图2所示,随着摇床转速提高,苯酚降解率和氨氮去除率均提高;摇床转速达到160r/min时,苯酚降解率渐趋稳定,氨氮去除率达到最大;当摇床转速为200r/min时,苯酚降解率没有明显变化,表明溶氧不再是苯酚降解的限制因素,而氨氮去除率降低,说明溶氧过低或过高均不利于氨氮去除,与 Acinetobacter sp. Y16[19]和Bacillus methylotrophicus strain L7[11]的特性一致.选择160r/min为最佳摇床转速.
2.3菌体生长及异养硝化-好氧反硝化特性
如图3a所示,菌体经历3h的延滞期后,进入对数生长期,细胞浓度快速增长,最大比生长速率为0.14/h,高于自养硝化菌Nitrosomonas europaea的0.03~0.05/h[20].苯酚在细胞对数生长期被大量降解,于21h降解率达到94.9%.细胞生长与苯酚降解是同步的,证明了菌株的异养代谢能力.总有机碳与苯酚的降解趋势相似,21h去除率为 90.8%,表明培养液中剩余有机物含量较低,苯酚主要转化为无机碳和胞内碳.
氨氮浓度在细胞对数生长期内显著降低(图3b),最终于 21h被完全去除,最大去除速率为3.2mg NH4+-N/(L∙h).Alcaligenes faecalis no.4[21]和Acinetobacter junii YB[10]的最大去除速率分别为24,10.09mg NH4+-N/(L∙h),均高于本研究.这些报道中所用碳源为柠檬酸盐和琥珀酸盐,比苯酚更容易被细胞利用,且没有毒性,细胞生长速度快,因此有更高的氨氮去除速率.
随着氨氮的消耗,中间代谢物 NO2-和 NO3-逐渐积累,最大浓度分别于12h和9h达到1.07, 1.92mg N/L,随后逐渐降低,没有检测到NH2OH-N,可能被迅速转化为下游代谢物.其它异养硝化-好氧反硝化菌的研究[10-12]中同样发现了硝化产物的积累和消耗.原因可能是实验前期氨氮充足,异养硝化作用强于好氧反硝化作用,硝化产物累积;后期氨氮浓度降低,好氧反硝化作用强于异养硝化作用,硝化产物被还原. Acinetobacter calcoaceticus HNR[17]和Alcaligenes faecalis NR[22]表现出不同的变化特征,这2株菌无法利用硝态氮进行反硝化反应,在脱氮过程后期硝态氮浓度没有降低,而是逐渐积累.本文中硝态氮后期的变化情况及前期研究[15]均表明,菌株PDB3能够以硝态氮为底物进行反硝化反应.总氮与氨氮的去除趋势相似,最终去除率为 96.3%,没有完全去除的主要原因是代谢中间物和细胞裂解物的积累.
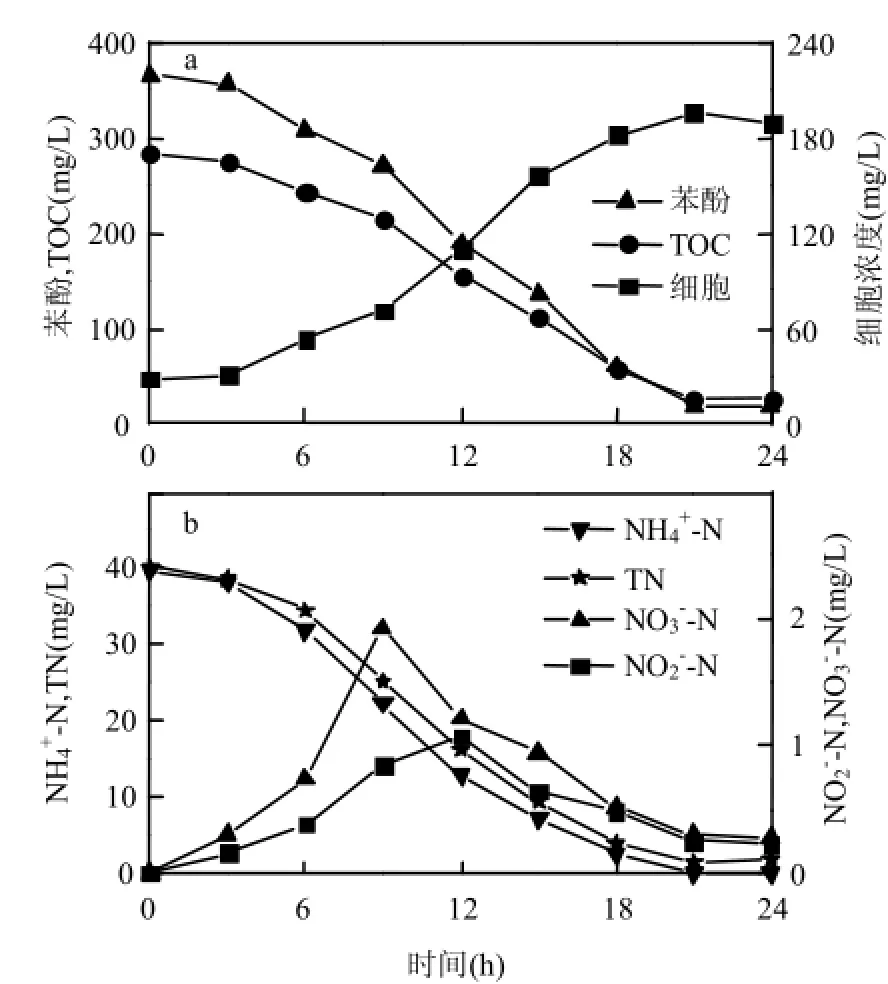
图3 菌株在苯酚初始浓度为365mg/L的无机盐培养基中苯酚降解,菌体生长及氨氮去除曲线Fig.4 Characteristics of phenol degradation, ammonium removal and cell growth in the mineral salt medium with initial phenol concentration of 365mg/L
Wehrfritz等[23]提出的异养硝化代谢理论认为,氨单加氧酶催化NH3生成NH2OH,这个过程由还原型辅酶Q提供电子;NH2OH转化NO2--N过程产生的电子通过细胞色素复合物传递给反硝化还原酶系,不像自养硝化菌中电子传递给辅酶Q.因此辅酶Q是通过有机碳源的代谢得到电子,从而给氨单加氧酶提供电子.可见异养硝化菌对氨氮的去除和有机碳源的利用是偶联的.从图3可见,苯酚降解趋势和氨氮去除趋势相似,苯酚降解产生的电子传递给氨单加氧酶,使氨氮同步去除.Amor等[4]和Kim等[5]在污泥降解实验中发现苯酚的存在抑制了硝化反应,苯酚完全降解后硝化反应才开始,可见自养硝化与苯酚降解不是偶联的.
2.4氮平衡分析
密封瓶实验中各物质的氮含量如表1所示.在实验末期,氨氮全部去除,只有少量的硝化产物积累,胞内氮由0.35mg增长到2.43mg,增长量占氨氮去除量的52.3%,氮气产量为1.48mg,占氨氮去除量的37.2%,没有检测到N2O. N2O是好氧反硝化过程的中间代谢物,具有温室效应. Schalk-Otte等[24]认为,反硝化过程释放N2O的主要原因是碳源不足,当碳源充足时,电子供应充足,各还原酶之间没有竞争性抑制,一氧化二氮还原酶的活性可以正常发挥,使N2O及时转化为N2,避免N2O逸出.本文中苯酚在实验末期仍有剩余,碳源充足,是N2O没有逸出的主要原因.胞内氮和氮气合计占氨氮去除量的89.5%,可见菌株PDB3主要通过细胞同化作用和异养硝化-好氧反硝化作用脱氮,与其他异养硝化-好氧反硝化菌[10,12,19]的研究结果一致.在实验末期溶液中含有少量的有机氮,可能来自于细胞裂解物.

表1 菌株PDB3脱氮过程中氮平衡分析Table 1 Nitrogen balance analysis in nitrogen removal by strain PDB3
2.5脱氮途径分析
异养硝化菌有2种脱氮途径,常见的是异养硝化-好氧反硝化偶联途径:首先 NH3转化为NH2OH,羟胺氧化酶催化NH2OH生成NO2-,NO2-可转化为 NO3-,NO2-和 NO3-分别被亚硝酸还原酶和硝酸还原酶还原为NO和NO2--N,最终被还原为含氮气体 N2O/N2.和偶联途径不同,Acinetobacter calcoaceticus HNR[17]和Alcaligenes faecalis NR[22]是通过 NH2OH 而非NO2-或NO3-生成含氮气体,并且没有亚硝酸还原酶和硝酸还原酶活性.通过测量脱氮途径中酶的活性,可以明确Diaphorobacter sp. PDB3的脱氮途径.结果表明羟胺氧化酶、亚硝酸还原酶和硝酸还原酶活性分别为(0.016 ± 0.003),(0.029 ± 0.005), (0.012 ± 0.002)U/mg蛋白质,表明菌株PDB3脱氮途径是异养硝化-好氧反硝化偶联途径(图4).
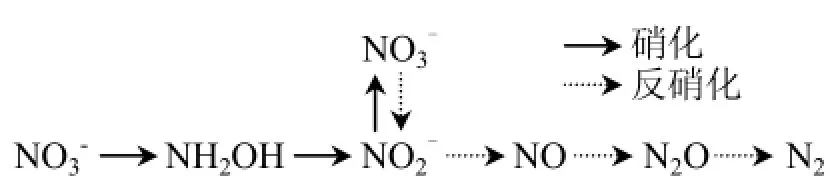
图4 Diaphorobacter sp. PDB3的脱氮途径Fig.4 Nitrogen removal pathway of Diaphorobacter sp. PDB3
2.6苯酚浓度对脱氮作用的影响
如图5所示,随着苯酚浓度升高,细胞延滞期增长,最终细胞浓度逐渐升高,同时氨氮去除耗时增长.初始苯酚浓度522,679mg/L下,胞内氮增长量占氨氮去除量的比率分别为 56.2%和 61.1%,说明随着苯酚浓度的升高,更多的氨氮用于合成细胞而不是进入异养硝化途径.
异养硝化-好氧反硝化菌可以同时通过异养硝化-好氧反硝化途径和以氧为电子受体的呼吸链产能[13,23],然而前者低于后者的产能效率[23],在氮源相对较少和溶氧充足时,菌体优先利用产能效率高的途径即氧化呼吸链产能,而不是异养硝化-好氧反硝化途径.同时碳源充足时可以产生更多的碳骨架,有利于细胞生长.因此在更高的苯酚浓度下,更少的氨氮进入异养硝化途径.
苯酚不仅可以改变细胞膜通透性[25],而且能够使酶蛋白变性[26],其毒害作用随着浓度增高而加强,也是异养硝化作用减弱的原因之一.自养硝化作用通常对苯酚敏感,例如 Stafford[6]发现5.6mg/L苯酚对自养硝化作用产生了 75%的抑制,Liu等[7]发现20mg/L苯酚存在时氨氮去除耗时约为没有苯酚时的2倍.菌株PDB3在较高的苯酚浓度下仍然发生异养硝化作用,说明其对苯酚的耐受度比自养硝化菌强. Diaphorobacter sp. PDB3能利用苯酚为碳源去除氨氮,具有一定的处理含氨氮苯酚废水应用前景;今后将研究相关功能基因的表达,进一步揭示脱氮机理,并研究反应器水平的工艺条件,为其实际应用提供支持.
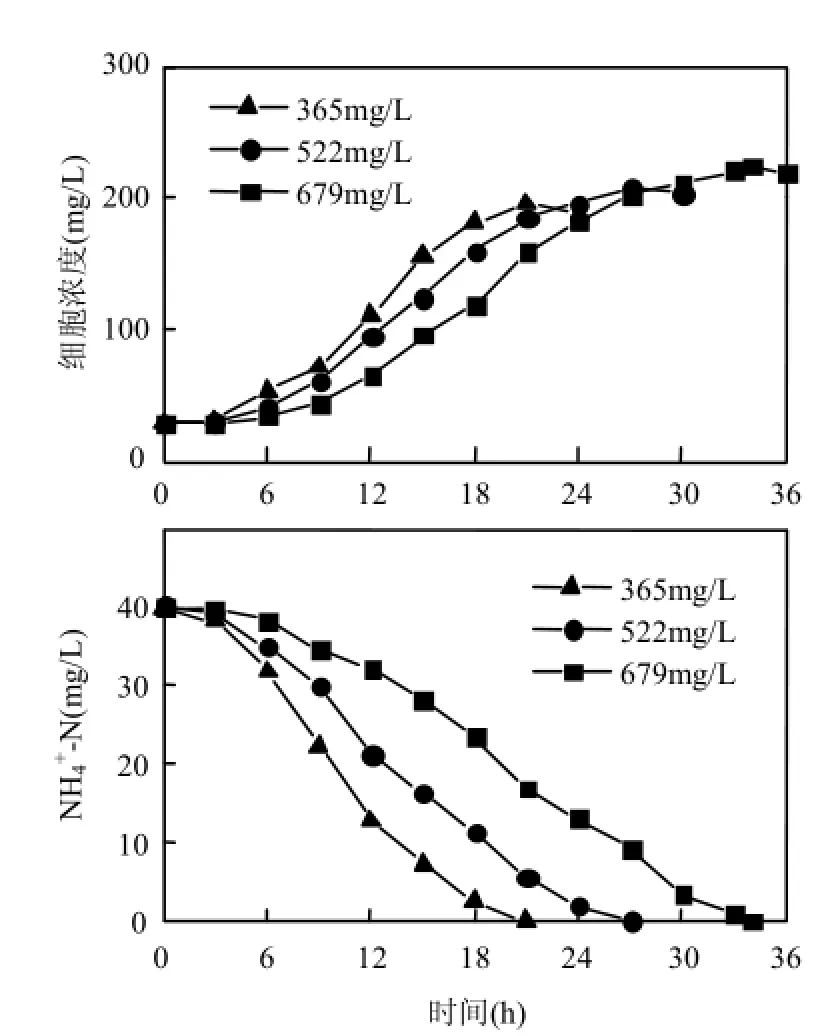
图5 苯酚初始浓度365,522,679mg/L对细胞生长和氨氮去除的影响Fig.4 Effect of phenol at initial concentrations of 365, 522 and 679mg/L on cell growth and ammonium removal
3 结论
3.1Diaphorobacter sp. PDB3的最佳苯酚降解和氨氮去除条件为碳氮比 7,摇床转速160r/min.在此条件下,菌株 21h内对初始浓度365mg/L苯酚的降解率为94.9%,总有机碳去除率为90.8%,同时初始浓度40mg N/L氨氮被完全去除,中间代谢物硝态氮和亚硝态氮逐渐积累并在后期降低.
3.2氮平衡分析表明,氨氮去除量的52.3%转化为胞内氮,37.2%转化为氮气,没有检测到N2O,菌株主要通过细胞同化作用和异养硝化-好氧反硝化作用去除氨氮.
3.3酶活分析检测到羟胺氧化酶、硝酸还原酶及亚硝酸还原酶活性,表明菌株 PDB3具有完整的异养硝化-好氧反硝化偶联途径.
3.4随着苯酚浓度升高,脱氮效率降低,原因一是菌体优先利用氧化呼吸链而非异养硝化-好氧反硝化途径产能,原因二是苯酚的抑制作用增强.
[1] 詹德利,卢晗锋,周 瑛,等. DVB-MMA共聚物树脂吸附水相苯酚的研究 [J]. 中国环境科学,2013,33(8):1386-1391.
[2] 蒙小俊,张玉秀.焦化废水中Rhodococcus P1菌株降酚特性研究[J]. 环境工程, 2014,32(189):53-56.
[3] 刘常敬,李泽兵,郑照明,等.苯酚对厌氧氨氧化工艺耦合反硝化的启动及脱氮性能的影响 [J]. 中国环境科学, 2014,34(5):1145-1151.
[4] Amor L, Eiroa M, Kennes C, et al. Phenol biodegradation and its effect on the nitrification process [J]. Water Research, 2005, 39(13):2915-2920.
[5] Kim Y M, Park D, Lee D S, et al. Inhibitory effects of toxic compounds on nitrification process for cokes wastewater treatment [J]. Journal of Hazardous Materials, 2008,152(3):915-921.
[6] Stafford D A. The effect of phenols and heterocyclic bases on nitrification in activated sludge [J]. Journal of Applied Bacteriology, 1974,37(1):75-82.
[7] Liu Y Q, Tay J H, Ivanov V, et al. Influence of phenol on nitrification by microbial granules [J]. Process Biochemistry, 2005,40(10):3285-3289.
[8] 张 楠,初里冰,丁鹏元,等.A/O生物膜法强化处理石化废水及生物膜种群结构研究 [J]. 中国环境科学, 2015,35(1):80-86.
[9] 郑林雪,李 军,胡家玮,等.同步硝化反硝化系统中反硝化细菌多样性研究 [J]. 中国环境科学, 2015,35(1):116-121.
[10] Ren Y X, Yang L, Liang X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB [J]. Bioresource Technology, 2014,171:1-9.
[11] Zhang Q L, Liu Y A, Miao G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7 [J]. Bioresource Technology, 2012,108:35-44.
[12] Shi Z, Zhang Y, Zhou J, et al. Biological removal of nitrate and ammonium under aerobic atmosphere by Paracoccus versutus LYM[J]. Bioresource Technology, 2013,148:144-148.
[13] Chen F, Xia Q, Ju L K. Competition between oxygen and nitrate respirations in continuous culture of Pseudomonas aeruginosa performing aerobic denitrification [J]. Biotechnology and Bioengineering, 2006,93(6):1069-1078.
[14] 吴建江,王兆阳,许培雅.一株高效异养硝化菌的分离、鉴定及其氨氮去除特性 [J]. 中国环境科学, 2013,33(7):1309-1315.
[15] 葛启隆,岳秀萍,王国英,等.好氧反硝化苯酚降解菌的分离鉴定及动力学 [J]. 环境工程学报, 2014,8(6):2605-2610.
[16] Frear D S, Burrell R C. Spectrophotometric method for determining hydroxylamine reductase activity in higher plants [J]. Analytical Chemistry, 1955,27(10):1664-1665.
[17] Zhao B, He Y L, Hughes J, et al. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR [J]. Bioresource Technology, 2010,101(14):5194-5200.
[18] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding [J]. Analytical Biochemistry, 1976,72(1):248-254.
[19] Huang X F, Li W G, Zhang D Y, et al. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16capable of heterotrophic nitrification-aerobic denitrification at low temperature [J]. Bioresource Technology, 2013,146:44-50.
[20] Gupta A B, Gupta S K. Simultaneous carbon and nitrogen removal from high strength domestic wastewater in an aerobic RBC biofilm [J]. Water Research, 2001,35(7):1714-1722.
[21] Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No.4 [J]. Journal of Bioscience and Bioengineering, 2005,100(2):184-191.
[22] Zhao B, An Q, He Y L, et al. N2O and N2production during heterotrophic nitrification by Alcaligenes faecalis strain NR [J]. Bioresource Technology, 2012,116:379-385.
[23] Wehrfritz J M, Reilly A, Spiro S, et al. Purification of hydroxylamine oxidase from Thiosphaera pantotropha, identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification [J]. FEBS Letters, 1993, 335(2):246-250.
[24] Schalk-Otte S, Seviour R J, Kuenen J G, et al. Nitrous oxide (N2O) production by Alcaligenes faecalis during feast and famine regimes [J]. Water Research, 2000,34(7):2080-2088.
[25] Heipeiper H J, Keweloh H, Rehm H J. Influence of phenols on growth and membrane permeability of free and immobilized Escherichia coli [J]. Applied and Environmental Microbiology, 1991,57(4):1213-1217.
[26] 刘小林,伍志权,黄 磊,等.蛋白变性剂对多聚半乳糖醛酸酶及其化学修饰酶催化活性的影响 [J]. 高校化学工程学报, 2012,26(6):1009-1013.
Simultaneous removal of phenol and ammonium by a heterotrophic nitrifiying-aerobic denitrifying bacterium.
WANG Guo-ying, CUI Jie, YUE Xiu-ping*, LI Ya-nan, JIA Zi-long (College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China).
China Environmental Science, 2015,35(9):2644~2649
The simultaneous removal of phenol and ammonium by a heterotrophic nitrifying-aerobic denitrifying bacterium Diaphorobacter sp. PDB3 was investigated. The optimal C/N ratio was 7and the optimal shaking speed was 160r/min. The strain degraded 94.9% of 365mg/L phenol in 21h, and 90.8% of total organic carbon was removed. Simultaneously, ammonium at an initial concentration of 40mg N/L was completely removed. The intermediates nitrate and nitrite accumulated in the early phase and declined in the later phase. The nitrogen balance analysis showed that 52.3% of removed nitrogen was finally transformed to intracellular nitrogen and 37.2% was converted to nitrogen gas. Ammonium was removed mainly through cellular assimilation and heterotrophic nitrification-aerobic denitrification. The detection of hydroxylamine oxidase, nitrate reductase and nitrite reductase activities demonstrated a coupled heterotrophic nitrifying-aerobic denitrifying pathway of strain PDB3. With the increase of phenol concentration, the inhibitory effect increased, leading to lower efficiency of ammonium removal.
heterotrophic nitrification;aerobic denitrification;phenol;ammonium
X703.1
A
1000-6923(2015)09-2644-06
2015-02-10
国家自然科学基金资助项目(51408396,51378330);山西省青年科技研究基金(2013021023-3)
*责任作者, 教授, yuexiuping@tyut.edu.cn
王国英(1984-),男,山西太原人,讲师,博士,主要从事环境微生物及水污染控制研究.发表论文10余篇.
