狗枣猕猴桃多酚的纯化工艺研究
2015-07-22左丽丽王振宇富校轶王舒然孙茂成高永欣吉林医药学院公共卫生学院吉林吉林303哈尔滨工业大学食品科学与工程学院黑龙江哈尔滨50090
左丽丽,王振宇,富校轶,王舒然,*,孙茂成,高永欣(.吉林医药学院公共卫生学院,吉林吉林303;.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨50090)
狗枣猕猴桃多酚的纯化工艺研究
左丽丽1,王振宇2,富校轶1,王舒然1,*,孙茂成1,高永欣1
(1.吉林医药学院公共卫生学院,吉林吉林132013;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
摘要:以狗枣猕猴桃粗多酚为原料,使用多通道二维色谱分离技术,在单因素的基础上采用响应面法对狗枣猕猴桃粗多酚的纯化条件进行优化并建立回归模型,得到最佳的纯化条件:上样量为57.27 mL,洗脱液浓度71.71%,洗脱柱体积2.85个。经回归分析表明:回归方程的R2=0.987 1,预测得到的多酚为11.99 mg/mL。通过验证在最佳的纯化条件下,得到的多酚为11.84 mg/mL,回归模型的预测值与实测值的相对误差为1.22%。
关键词:狗枣猕猴桃多酚;响应面;纯化
狗枣猕猴桃为猕猴桃属猕猴桃科植物,富含多酚、多糖、氨基酸、维生素C等活性成分,具有很高的营养价值[1]。猕猴桃多酚能够清除大量的活性氧自由基,预防组织器官老化,是一种高效的自由基清除剂,具有很好的抗氧化、抗癌、抑制动脉粥样硬化、预防衰老、提高机体的免疫力等多种功能[2-4]。通过对狗枣猕猴桃、软枣猕猴桃和中华猕猴桃成分分析发现狗枣猕猴桃中多酚含量最高,且具有最高的抗氧化活性[5],因此开发猕猴桃多酚具有广阔的应用前景。但是大量生产高纯度的猕猴桃多酚成为制约其市场化的瓶颈。
大孔吸附树脂是一种高分子聚合物,由于其特殊的空间结构以及稳定的理化性质,使其对多酚等活性物质表现出非常好的吸附特性,广泛应用于植物活性物质的分离和纯化[6-7]。但是,传统的分离技术具有分离效率低、速度慢、周期时间长等缺点。以狗枣猕猴桃多酚为研究对象,以大孔吸附树脂为固相介质,采用实验室自主研发的多通道二维色谱分离设备[8]对其进行纯化,在单因素试验的基础上采用响应面法优化狗枣猕猴桃多酚纯化工艺,为狗枣猕猴桃多酚的开发提供试验参考。
1 材料与方法
1.1材料与仪器
1.1.1材料
狗枣猕猴桃野生品种:采自大兴安岭地区。
1.1.2主要试剂
95%乙醇、没食子酸标准品、碳酸钠、福林酚试剂,浓盐酸、AB-8大孔吸附树脂。
1.1.3试验仪器
KQ5200DB型超声波:昆山市超声仪器有限公司;H2050R型离心机:湖南湘仪实验室仪器开发有限工公司;RE-3000型旋转蒸发仪:上海亚荣生化仪器厂;721紫外可见分光光度计:天津市普瑞斯仪器有限公司;多通道二维色谱分离设备(哈尔滨工业大学食品科学与工程学院生物化工实验室自制,1个上样柱,5个色谱柱)。
1.2试验方法
1.2.1狗枣猕猴桃多酚的提取及含量测定
准确称取大小均一、成熟度一致的狗枣猕猴桃5 kg,使用60%的乙醇按照参考文献[9]的方法提取狗枣猕猴桃粗多酚,将提取液通过旋转蒸发仪进行浓缩至一定的体积,分装后于-20℃保存,并采用Folinciocalteu方法[10]测定其中的多酚含量。
1.2.2AB-8大孔吸附树脂的预处理
新购买的AB-8大孔吸附树脂首先使用95%乙醇浸泡24 h,然后使用无水乙醇充分洗涤至加水无白色浑浊出现,之后用蒸馏水反复冲洗直至没有醇味。用2倍~3倍柱体积的2%~5%的HCl溶液浸泡树脂4 h~6 h,再次使用蒸馏水反复冲洗直至pH为中性,最后用2倍~3倍柱体积的2%~5%的NaOH溶液浸泡树脂4 h~6 h,使用蒸馏水反复冲洗直至pH变为中性后备用[11]。
1.2.3单因素试验
根据预试验,以上样量、洗脱液浓度、洗脱柱体积为单因素,进行最佳的单因素范围选择。
1.2.4狗枣猕猴桃多酚纯化工艺响应面试验
通过单因素试验结果,确定纯化狗枣猕猴桃粗多酚最适宜的上样量、洗脱液浓度和洗脱柱体积的范围。根据单因素的试验结果,选取上样量、洗脱液浓度、洗脱柱体积三个因素三个水平设计响应面[12-13],获得多通道二维色谱纯化狗枣猕猴桃多酚最佳的洗脱条件。
2 结果与分析
2.1狗枣猕猴桃多酚含量
以没食子酸为标准品,绘制标准曲线测定狗枣猕猴桃果实中多酚含量为430.03 mgGAE/100 g鲜果。2.2狗枣猕猴桃多酚纯化单因素试验
2.2.1上样量对狗枣猕猴桃多酚得率的影响
分别量取浓度为4.3 mg/mL的狗枣猕猴桃粗多酚提取液30、40、50、60 mL进行上样,吸附2 h后用蒸馏水冲洗上样柱,以除去其中的杂质,再用一定体积的60%乙醇将猕猴桃粗多酚进行分配,直到串联的最后一根色谱柱流出液出现颜色变化时立即停止分配。然后启动并联模式,使用60%的乙醇进行洗脱,每个色谱分别收集两个柱体积的洗脱液,通过旋转蒸发仪将其浓缩到一定体积,使用Folin-ciocalteu方法测定其中的多酚含量,计算多酚得率来筛选最佳上样量。
上样量与洗脱液中相对多酚含量的相关性如图1所示。

图1 上样量与洗脱液中相对多酚含量的相关性Fig.1 Effect of loading volume on polyphenol content in eluant
不同体积的上样量所获得的洗脱液中多酚得率随着上样体积的增加而逐渐增加,尤其是A、B、C柱洗脱液中多酚含量相对较高,而D、E柱分配的多酚含量较少,因而洗脱液中也显著的低于A、B、C三柱。上样量在30 mL~40 mL的范围内随着体积的增加洗脱液中多酚得率增加较快,继续增加上样量获得的洗脱液中多酚得率增加相对缓慢,当上样体积达到50 mL后上样柱中大孔吸附树脂对狗枣猕猴桃多酚的吸附能力几乎达到最大值,表明吸附已经达到饱和,此时,A、B、C、D、E柱的洗脱液中多酚得率也达到最大值,继续增加上样量对5个色谱柱洗脱液中多酚得率影响不大,因此选择50 mL的提取液作为最佳上样量用于后续响应面试验。
2.2.2洗脱液浓度对狗枣猕猴桃多酚得率的影响
在预试验上样量对多酚得率影响的基础上,选定50 mL的狗枣猕猴桃粗多酚提取液进行上样,通过多通道二维色谱设备进行分离,使用不同浓度的乙醇(20%、40%、60%、80%)进行梯度洗脱,每个色谱柱收集两个柱体积,通过旋转蒸发仪分别浓缩到一定体积,使用Folin-ciocalteu方法测定洗脱液中多酚含量,筛选最佳的洗脱液浓度。
洗脱液乙醇浓度与洗脱液中相对多酚含量的相关性如图2所示。

图2 乙醇浓度与洗脱液中相对多酚含量的相关性Fig.2 Effect of concentration of ethanol on polyphenol content in eluant
随着乙醇浓度的不断增加每个柱子洗脱液中的相对多酚含量也逐渐增加,当洗脱液乙醇浓度在20%~60%范围时,A、B柱获得的多酚含量呈线性增加,而C、D、E柱中吸附的多酚含量较少,且得率增加不显著,当洗脱液乙醇浓度达到60%时5个洗脱柱获得的多酚含量达到最大值,继续提高洗脱液的乙醇浓度对每个洗脱柱的多酚得率没有显著增加,可见最佳的洗脱液浓度为60%,用于后续响应面试验。
2.2.3洗脱柱体积对狗枣猕猴桃多酚得率的影响
在预试验上样量和洗脱液浓度对多酚得率影响的基础上,选定50 mL的上样量进行上样,通过多通道二维色谱进行分离,使用60%的乙醇浓度进行洗脱,每个色谱柱分别收集1、2、3、4个柱体积的洗脱液,通过旋转蒸发仪将其浓缩到一定体积,使用Folinciocalteu方法测定多酚含量,获得最佳的洗脱柱体积。
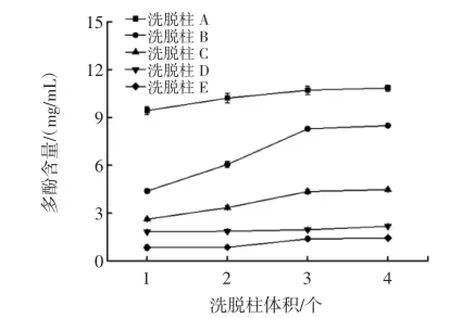
图3 洗脱柱体积与洗脱液中多酚含量的相关性Fig.3 Effect of eluant volume on polyphenol content in eluant
如图3所示,随着洗脱柱体积的增加,收集的洗脱液中多酚得率也逐渐增加,当洗脱一个柱体积时A中获得最高的总酚含量,显著高于其他B、C、D、E四个柱体积获得的多酚,且B、C、D、E的多酚得率差异不显著。随着洗脱体积的增加B柱的多酚得率显著增加,而其他四个柱的多酚得率也有所提高,但提高不显著。当洗脱3倍柱体积时每个柱子中的多酚得率达到最大值,洗脱4倍柱体积时5个洗脱柱的洗脱液中多酚含量不再增加,因此,选择洗脱3倍的柱体积用于后续响应面试验。
2.3响应面法(RSM)优化洗脱条件
以上述单因素获得的最佳洗脱条件为基础,选择上样量、洗脱液浓度、洗脱柱体积三个因素,各取三个水平,通过试验发现色谱柱A中多酚吸附率较高,因此以色谱柱A的洗脱液中获得的多酚含量为评价指标进行响应面优化试验。
2.3.1自变量水平的建立
采用BBD响应面试验为模型,分别采用上样量(X1/mL)、洗脱液浓度(X2/%)、洗脱柱体积(X3/个)三因素进行响应面实验,表1显示了试验因素及编码值。

表1 BBD试验设计中试验因素水平及编码值Table 1 Experimental range and coded level of variables tested with BBD
2.3.2响应面分析试验方案及结果
利用试验设计统计分析软件Design-Expert进行试验设计与数据分析,通过此软件设计了17组试验,然后分别进行试验,结果如表2所示,根据试验数据求得方程的各项系数。

表2 BBD响应面优化洗脱多酚含量的试验值试验设计与结果Table 2 Box-Behnken design matrix for the experimental values for polyphenol content
将试验结果使用Design-Expert 7.0数理统计软件进行回归拟合,可得到响应值Y和各个因子(X1,X2,X3)之间的二次多元回归方程模型为:

对此回归模型进行方差分析,结果如表3所示。

表3 回归模型方差分析表Table 3 Analysis of variance(ANOVA)for regression equation
由表3方差分析可以看出,Fmodel=15.14,它的值远远大于F0.05(9,3)=8.81,而响应面模型的P<0.001,这表明试验设计模型设计合理,不同因素对洗脱液总酚含量的影响差异显著;本试验中失拟项P值0.115 3> 0.05,表明模型的失拟项不显著,即模型建立成功。
由表3中回归方程系数的显著性结果表明:RSM模型的一次项X1(P=0.000 1)、X2(P=0.000 1)、X3(P= 0.000 1)和二次项X12(P=0.000 1)、X22(P=0.000 1)、X32(P=0.000 3)以及交互项X1X2(P=0.000 9)系数达到了极显著的水平,交互项X1X3(P=0.016 8)的系数显著,而交互项X2X3(P=0.138 5)的系数不显著。
2.3.3响应面法分析与优化
根据回归分析结果做出相应的曲面图,观察上样量、洗脱液浓度和洗脱柱体积对获得多酚含量的影响,结果如图4(a,b,c)所示。
由图4可以看出,X1和X2之间交互作用显著,X2和X3之间交互作用不显著,X1和X3交互作用显著。
优化后最佳纯化狗枣猕猴桃多酚的工艺条件为上样量57.27 mL,洗脱液浓度71.71%,洗脱柱体积2.85个,在此条件下,响应面预测结果获得的总酚含量为11.99 mg/mL。

图4 RSM模型自变量X1,X2,X3的响应面图Fig.4 Response surface of X1,X2,X3in RSM model
3 结论
采用多通道二维色谱技术,在单因素的基础上,采用响应面法研究了上样量、洗脱液浓度、洗脱柱体积对纯化后狗枣猕猴桃多酚浓度的影响。结果表明:各因素对纯化后狗枣猕猴桃多酚浓度的影响大小顺序为:洗脱柱体积>上样量>洗脱液浓度。多通道二维色谱纯化狗枣猕猴桃多酚的最佳工艺条件为上样量57.27 mL,洗脱液浓度71.71%,洗脱柱体积2.85个,在此条件下,响应面预测结果获得的总酚含量为11.99 mg/mL,在响应面分析方法优化的最佳条件下进行3次平行试验,得到色谱柱A的洗脱液中总酚含量
为11.84 mg/mL,响应面模型的理论预测值与实际测定值非常接近,相对误差在1.22%左右,这表明响应面的实际值与回归方程预测值吻合性良好。与常规大孔吸附树脂柱层析相比较,此分离设备具有分离效果好、速度快、操作简单、处理量大等优点[14],对于纯化多酚等活性物质的工业化以及大批量生产具有重要的价值。
参考文献:
[1]Du G R,Li M J,Ma F W,et al.Antioxidant capacity and the relationship with polyphenol and Vitamin C in Actinidia fruits[J].Food Chemistry,2009,113(2):557-562
[2]Fiorentino A,D'Abrosca B,Pacifico S,et al.Identification and Assessment of Antioxidant Capacity of Phytochemicals from Kiwi Fruits[J].Journal of Agricultural and Food Chemistry,2009,57(10): 4148-4155
[3]IWasawa H,Morita E,Ueda H,et al.Influence of Kiwi Fruit on Immunity and Its Anti-oxidant Effects in Mice[J].Food Science and Technology Research,2010,16(2):135-142
[4]Haminiuk C W I,Maciel G M,Plata-Oviedo M S V,et al.Phenolic compounds in fruits-an overview[J].International Journal of Food Science&Technology,2012,47(10):2023-2044
[5]Zuo L-L,Wang Z-Y,Fan Z-L,et al.Evaluation of Antioxidant and Antiproliferative Properties of Three Actinidia(Actinidia kolomikta, Actinidia arguta,Actinidia chinensis)Extracts in Vitro[J].International Journal of Molecular Sciences,2012,13(5):5506-5518
[6]Franquin-Trinquier S,Maury C,Baron A,et al.Optimization of the extraction of apple monomeric phenolics based on response surface methodology:Comparison of pressurized liquid-solid extraction and manual-liquid extraction[J].Journal of Food Composition and Analysis,2014,34(1):56-67
[7]şahin S,şamll R.Optimization of olive leaf extract obtained by ultrasound-assisted extraction with response surface methodology[J]. Ultrasonics Sonochemistry,2013,20(1):595-602
[8]曾祥宏,王振宇,李辉,等.二维多通道色谱法分离松多酚的条件优化[J].食品科学,2014,35(10):185-191
[9]左丽丽,王振宇,樊梓鸾,等.三种猕猴桃多酚粗提物对A549和Hela细胞的抑制作用[J].食品工业科技,2013,34(15):358-361
[10]Bursal E,G L In I..Polyphenol contents and in vitro antioxidant activities of lyophilised aqueous extract of kiwifruit(Actinidia deliciosa)[J].Food Research International,2011,44(5):1482-1489
[11]李紫薇,欧阳艳,腊萍,等.大孔吸附树脂分离纯化薰衣草总黄酮[J].食品工业科技,2012,33(17):245-247
[12]郭庆启,毛佳,王萍,等.响应面法优化红松松籽壳色素提取工艺的研究[J].食品工业科技,2010,31(11):262-264
[13]Liu T X,Cao Y N,Zhao M M.Extraction optimization,purification and antioxidant activity of procyanidins from hawthorn(C.pinnatifida Bge.var.major)fruits[J].Food Chemistry,2010,119(4):1656-1662
[14]Ghafoor K,Choi Y H,Jeon J Y,et al.Optimization of Ultrasound-Assisted Extraction of Phenolic Compounds,Antioxidants,and Anthocyanins from Grape(Vitis vinifera)Seeds[J].Journal of Agricultural and Food Chemistry,2009,57(11):4988-4994
DOI:10.3969/j.issn.1005-6521.2015.24.019
收稿日期:2014-09-05
作者简介:左丽丽(1982—),女(汉),讲师,博士,研究方向:天然产物提取与功能分析,食品质量与安全。
*通信作者:王舒然(1968—),男(汉),教授,博士生导师。
Optimization of Purification Techniques of the Polyphenol from Actinidia Kolomikta
ZUO Li-li1,WANG Zhen-yu2,FU Xiao-yi1,WANG Shu-ran1,*,SUN Mao-cheng1,GAO Yong-xin1
(1.School of Public Health,Jilin Medical College,Jilin 132013,Jilin,China;2.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,Heilongjiang,China)
Abstract:Purification the Actinidia kolomikta crude polyphenol as raw materials by the two-dimensional multichannel chromatographic separation equipment,with the response surface analytical method(RSM),the regressive model through the optimization of main technical parameters of purification Actinidia kolomikta polyphenol by ethanol solution was obtained.The best conditions were as follow:loading quantity of sample 57.27 mL,eluent concentration 71.71%,volume of elution column 2.85.The regressive analysis indicated R2= 0.987 1,the estimating purified polyphenols was 11.99 mg/mL.Through the validating test,under the best purified conditions,the polyphenol was 11.84 mg/mL.The relative error between the estimating data of regressive model and actual data was less than 1.22%.
Key words:Actinidia kolomikta polyphenol;RSM;purification
