RAGE对糖尿病大鼠骨代谢紊乱的影响
2015-07-02李健刘亚平郭洪敏聂志奎
李健,刘亚平,郭洪敏,聂志奎
(1.济宁市第一人民医院骨关节科,山东 济宁 272100;2.济宁市第一人民医院内分泌二科,山东 济宁 272100)
RAGE对糖尿病大鼠骨代谢紊乱的影响
李健1,刘亚平2,郭洪敏1,聂志奎1
(1.济宁市第一人民医院骨关节科,山东 济宁 272100;2.济宁市第一人民医院内分泌二科,山东 济宁 272100)
目的 观察糖尿病大鼠的骨代谢特点及骨组织糖基化终产物变体的表达。方法 采用高糖高脂饮食加腹腔注射小剂量链脲佐菌素诱导建立糖尿病大鼠模型,20周后处死大鼠,测定骨生物力学以及糖化血红蛋白A1c、血清晚期糖基化终产物、空腹血糖、血清胰岛素,紫外荧光分光光度计测定大鼠血清糖基化终产物含量。实时聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)检测大鼠骨组织糖基化终产物变体表达。结果 与正常对照组相比,糖尿病组大鼠和Goto-kakizaki组大鼠的糖化血红蛋白A1c、血清糖基化终产物、空腹血糖、胰岛素均显著升高,而骨生物力学指标均显著降低,糖尿病组大鼠和Goto-kakizaki组大鼠骨组织均检测到糖基化终产物变体表达。结论 糖尿病大鼠和Goto-kakizaki大鼠的骨量和骨强度下降,骨折危险性增加,糖基化终产物及变体相互作用参与糖尿病骨代谢紊乱的发生发展。
糖尿病;大鼠;骨生物力学;晚期糖基化终产物受体
近来有研究指出骨组织中晚期糖基化终产物(Advanced glycation end-products,AGEs)的积累可能是骨细胞功能受损和骨重建障碍的原因之一。糖尿病患者体内AGEs变体(receptors of AGEs,RAGE)高水平表达,AGEs-RAGE轴是否干扰糖尿病骨代谢及机制目前尚不明确。本研究采用高脂高糖饲养联合小剂量链脲佐菌素的方法制备糖尿病雄性大鼠模型,结合骨生物力学等指标,观察糖尿病大鼠骨代谢的特点及骨组织RAGE的表达。
1 资料与方法
1.1 材料 山东大学实验动物中心提供3个月龄健康雄性Wistar大鼠30只,平均体重(282.94±13.22)g,并提供普通饲料和高糖高脂饲料[1]。用0.1 mmol/L柠檬酸盐缓冲液(pH4.2)配成2%链脲佐菌素(streptozotocin,STZ)溶液,经滤菌器除菌。
1.2 方法
1.2.1 造模 大鼠按体重号随机分为两组,取6只作正常对照组喂普通饲料。余24只大鼠作糖尿病造模组,高糖高脂饲料喂养8周(不限每日热量),禁食12 h后左下腹腔一次性注射STZ(30 mg/kg),正常对照组注射等量柠檬酸盐缓冲液。STZ注射1周后造模组尾静脉行腹腔内葡萄糖耐量试验(Intraperitoneal glucose tolerance test,IPGTT)[2],以空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L,或糖负荷后2 h血糖≥11.1 mmol/L者为糖尿病造模成功鼠[3]。实验结束时,纳入7只6个月龄糖尿病Goto-kakizaki(GK)大鼠作阳性对照组。
1.2.2 观察指标 成模后所有大鼠每周测随机血糖,共观察20周。实验结束时,大鼠空腹8 h后颈动脉穿刺取血处死,分离血清以检测FPG(比色法,日立7 180全自动生化分析仪),血清胰岛素(放免法,天津九鼎),抗凝血糖化血红蛋白(glycosylated hemoglobin,GHb)A1c(比色法,南京建成生物工程研究所),完整离断左侧股骨,仔细剥离软组织,做腰椎压缩和股骨三点弯曲试验(日本岛津AG-1S万能材料试验仪)。血液离心,取血浆0.2 mL,蒸馏水稀释至2 mL,测定荧光值(日本岛津RF5301PC型紫外荧光分光光度计),考马斯亮蓝法测定稀释液的蛋白质浓度,用U/mg prot表示血浆AGEs水平[4],以此间接反映骨组织AGEs含量。实时聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)检测骨组织RAGE的表达。
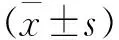
2 结 果
2.1 大鼠血清AGEs、GHbA1c、胰岛素的变化 剔除因感染死亡和造模未成功的大鼠,入选糖尿病组大鼠为10只。高糖高脂饮食联合STZ注射后造模组大鼠血糖明显升高并且高血糖症持续存在。与正常组比较,糖尿病组大鼠和Goto-kakizaki组大鼠AGEs、GHbA1c、空腹血糖、胰岛素及稳态模式评分法测定胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)均显著升高(P<0.01),而糖尿病组和Goto-kakizaki组大鼠各指标无显著差异(见表1)。
2.2 大鼠骨生物力学指标的变化糖尿病组大鼠和Goto-kakizaki大鼠股骨三点弯曲试验和腰椎压缩试验各观察指标均显著低于正常对照组(P<0.05或P<0.01,见表2)。
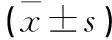
表1 三组大鼠AGEs、HbA1c、空腹血糖、胰岛素和HOMA-IR的比较
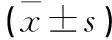
表2 三组大鼠股骨三点弯曲试验和腰椎(L5)压缩试验的变化
2.3 相关分析 糖尿病组大鼠血清AGEs与股骨最大载荷、弹性模量、最大弯曲应力及腰椎最大载荷、弹性模量均呈显著负相关(r=-0.413,-0.511,-0.503,-0.442,-0.427,P<0.05),Goto-kakizaki大鼠组血清AGEs与与股骨最大载荷、弹性模量、最大弯曲应力及腰椎最大载荷、弹性模量均呈显著负相关(r=-0.401,-0.483,-0.517,-0.482,-0.502,P<0.05)。
2.4 RT-PCR检测大鼠骨组织RAGE的表达 糖尿病组和Goto-kakizaki大鼠组均检测到骨组织RAGE的表达,正常对照组未检测到RAGE表达(见图1)。
3 讨 论
传统利用高糖高脂制备的特殊膳食或多次小剂量STZ腹腔注射诱导建立的2型糖尿病大鼠模型均存在造价高、建模周期长的缺点[5,6],目前多采用上述两种方法结合诱导2型糖尿病大鼠模型的建立。该模型具有血糖、GHbA1c升高,胰岛素抵抗,脂代谢紊乱的特点[7],比较接近人类2型糖尿病的病理过程,并且价格低、易操作、造模时间短、成功率高及相对稳定,为研究糖尿病急慢性并发症的良好模型。Goto-kakizaki大鼠是未经人为干预的2型糖尿病动物模型,具有自发性高血糖、胰岛素抵抗,本实验以Goto-kakizaki大鼠作为阳性对照,观察两种糖尿病模型鼠骨代谢特点。
本实验前期结果发现糖尿病组和Goto-kakizaki大鼠组的股骨和腰椎BMD均显著下降,但是BMD不能反映骨质量[7],骨的力学特征是反映骨质量的重要指标[8,9],力学性能下降可导致骨折发生率增高。近来诸多横断面流行病学报道BMD正常或增高的2型糖尿病患者,其脆性骨折发生率增高[10,11],究其原因可能与糖尿病患者骨量减少导致骨质量下降有关[12]。Burghardt等[13]采用高分辨率外周定量计算机断层成像技术(HR-pQCT)扫描19 例绝经后2型糖尿病患者桡骨远端和胫骨,评估BMD、骨小梁微结构、机械性能等指标,发现与对照组比较,10%糖尿病患者BMD增高,但最大载荷、弯曲应力、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)显著下降,既往有骨折史的患者,其皮质骨及骨小梁较无骨折史的显著减少。本实验观察到,糖尿病组和Goto-kakizaki大鼠组的股骨三点弯曲实验和腰椎压缩实验指标均显著下降,骨组织形态计量学指标中的骨小梁相对体积、骨小梁厚度、骨小梁数量明显下降,骨小梁分离度明显增加,反映骨形成活力的指标(骨形成率、骨矿化沉积率)显著降低,而反映骨吸收活跃程度的指标(内陷表面)显著升高[7],提示两组大鼠的骨量和骨强度下降,骨折风险增加。
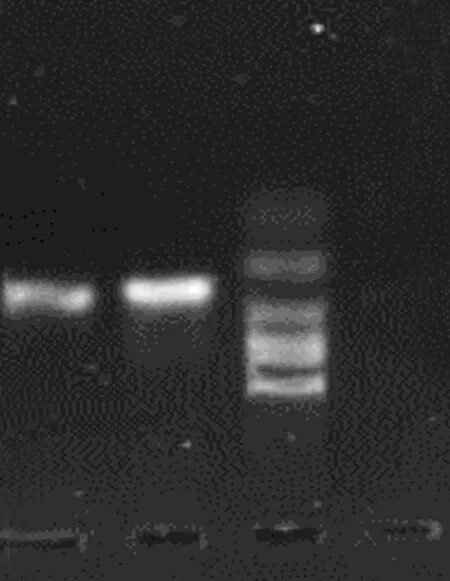
1 2 M 3
1—Goto-kakizaki大鼠组;2—糖尿病组;3—正常对照组
图1 RT-PCR检测大鼠骨组织RAGE的表达
蛋白质的非酶糖基化参与糖尿病的发病过程。AGEs是不同种类的复杂大分子物质,包括羧甲基赖氨酸(carboxymethyl-lysine,CML)、戊糖素、咪唑酮等,氧化应激产物也加剧体内AGEs生成。在小鼠未分化骨细胞体外培养物中,AGEs增强破骨细胞介导的骨吸收[14],体内注射CML修饰后的胶原可刺激颅骨骨膜细胞凋亡[15],此外在骨质疏松患者血清及尿标本中检测AGEs水平明显升高[16],与Hein等[17]研究结果一致,提示骨质疏松本身与体内AGEs积累有关。Hein同时发现骨质疏松患者血清戊糖素与侵蚀面、矿化表面、矿化沉积率之间存在显著正相关,说明AGEs先促使破骨细胞的激活,进而促使成骨细胞活化。本研究通过检测血清AGEs含量,以此间接反映骨组织AGEs含量,结果显示糖尿病大鼠和Goto-kakizaki大鼠的AGEs和GHbA1c水平明显升高,证实两组大鼠体内非酶糖基化作用增强,并且两组大鼠的血清AGEs与骨生物力学指标均呈显著负相关,以上提示AGEs的增多可能是骨细胞功能损伤、骨重建障碍的原因之一。
体内AGEs受体众多,目前研究较为明确与糖尿病密切相关的是RAGE,大量证据显示AGEs-RAGE相互作用参与动脉粥样硬化及糖尿病微血管病的发生。RAGE在体内多种细胞中表达,比如内皮细胞、平滑肌细胞、成纤维细胞、成骨细胞、破骨细胞等,并且在健康动物体内较低水平表达,而糖尿病者显著高水平表达。Santana等[18]发现1型糖尿病大鼠缺损颅骨的愈合程度较非糖尿病鼠下降了40%,并且骨愈合部位RAGE表达显著上调,与Chang等[19]研究结果相似。另外,在非糖尿病鼠骨缺损部位分别加入CML鼠血清白蛋白(MSA)后,其骨愈合延迟,提示炎症和氧化应激上调成骨和破骨细胞NF-κB途径,激活AGEs-RAGE轴,延缓骨缺损的愈合[20]。Ding等[21]发现,与野生鼠相比,RAGE敲除鼠的骨强度和骨量增加,破骨细胞数量减少。国内有报道糖尿病状态下过多的AGEs通过与RAGE结合干扰骨细胞IGF-1表达,后者作用于偶联骨重建的OPG/RANKL/RANK轴,从而干扰糖尿病骨代谢。本实验RT-PCR检测到糖尿病组和Goto-kakizaki大鼠组骨RAGE的表达,与国内外研究结果一致。
Yasuhiro Hamada[22]等选用RAGE敲除鼠(RAGE-KO)、野生鼠(WT),利用STZ造模并将大鼠分为四组,分别为WT非糖尿病组(N-WT)、RAGE-KO非糖尿病组(N-RAGE)、WT糖尿病组(D-WT)、RAGE-KO糖尿病组(D-RAGE),研究各组大鼠股骨生物力学特性及胫骨组织形态计量学指标,观察到与N-WT组相比,由于生理状态下无AGEs积聚,N-RAGE组的体重、GHbA1c水平、骨形成参数(类骨质表面、骨形成率、矿化沉积率)无差异,但BMD升高、骨吸收参数(破骨细胞表面、破骨细胞数/骨周长)显著下降,提示RAGE缺陷鼠的破骨细胞功能下降,导致BMD升高,与Ding研究结果一致。相反,给予D-RAGE组和D-WT组大鼠行股骨X线拍片,发现严重骨质减少,并且BMD、骨形成及吸收参数均下降,似乎预示糖尿病状态下RAGE缺陷不参与骨重建紊乱的过程。但RAGE在体内有多个剪接变体,比如去掉N末端的RAGE变异体无法与AGEs结合,因为该片段包含的V型区是RAGE与配体结合介导细胞信号转导的关键结构,再者循环中存在的可溶型RAGE(the soluble form of RAGE,sRAGE)是去掉C末端的RAGE变异体,可与AGEs竞争性与RAGE结合,在糖尿病血管并发症和动脉粥样硬化中有保护性作用。Lalla[23]利用sRAGE与RAGE结合后,报道AGEs阻断剂可显著减少糖尿病大鼠牙槽骨的骨丢失。上述这些RAGE形式是独立于经典RAGE信号传导途径发挥生物学作用,因此只有RAGE敲除鼠模型的设计能仅针对敲除细胞表面的RAGE或者成骨细胞、破骨细胞表达的RAGE,那么AGEs-RAGE轴在糖尿病骨代谢过程中的详细机制才能明确。
[1]李爱卿,王志慧,赵跃斌.高糖高脂饲料诱导2型糖尿病大鼠模型[J].临床医药实践杂志,2005,14(2):130-131.
[2]Vital P,Larrieta E,Hiriart M.Sexual dimorphism in insulin sensitivity and susceptibility to develop diabetes in rats[J].Journal of Endocrinology,2006,190(2):425-432.
[3]司晓晨,尚文斌,卞慧敏,等.链脲佐菌素加高脂膳食诱导2型糖尿病大鼠模型[J].安徽中医临床杂志,2003,15(5):383-385.
[4]张效云,李永民,宋桂芹.糖平煎复方对实验性糖尿病大鼠血糖、血脂和蛋白质糖化终末产物的影响[J].中国中医基础学杂质,2003,9(12):39-40.
[5]曹石金,何朝辉,李逊.糖尿病大鼠模型的制备[J].解剖学研究,2012,34(4):295-298.
[6]赵保胜,董淑云,霍海如.2型糖尿病动物模型的研究进展[J].中国实验方剂学杂志,2005,11(5):62-66.
[7]李健,郭洪敏,刘亚平.糖尿病雄性大鼠骨代谢特点的观察[J].实用骨科杂志,2009,15(5):355-357.
[8]Lill CA,Hesseln J,Schlegel U,etal.Biomechanical evaluation of healing in a noncritical defect in a large animal model of osteoporosis[J].Orthop Res,2003,21(5):836-842.
[9]Erdal N,Gurgul S,Demirel C,etal.The effect of insulin therapy on biomechanical deterioration of bone in streptozotocin(stz)-induced type 1 diabetes mellitus in rats[J].Diabetes Res Clin Pract,2012,97(3):461-467.
[10]Janghorbani M,Van Dam RM,Willett WC,etal.Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J].Am J Epidemiol,2007,166(5):495-505.
[11]Yamamoto M,Yamaguchi T,Yamauchi M,etal.Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications[J].J Bone Miner Res,2009,24(4):702-709.
[12]Strotmeyer ES,Cauley JA,Schwartz AV,etal.Nontraumatic fracture risk with diabetes mellitus and impaired fasting glucose in older white and black adults[J].Arch Intern Med,2005,165(6):1612-1617.
[13]Burghardt AJ,Issever AS,Schwartz AV,etal.High-resolution peripheral quantitative computed tomographic imaging of cortical and trabecular bone microarchitecture in patients with type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2010,95(11):5045-5055.
[14]Miyata T,Notoya K,Yoshida K,etal.Advanced glycation end products enhance osteoclast-induced bone resorption in cultured mouse unfractionated bone cells and in rats implanted subcutaneously with devitalized bone particles[J].J Am Soc Nephrol,1997,8(2):260-270.
[15]Alikhani M,Alikhani Z,Boyd C,etal.Advanced glycation end products stimulate osteoblast apoptosis via the MAP kinase and cytosolic apoptotic pathways[J].Bone,2007,40(2):345-353.
[16]Shiraki M,Kuroda T,Tanaka S,etal.Nonenzymatic collagen cross-links induced by glycoxidation(pentosidine)predicts vertebral fractures[J].J Bone Miner Metab,2008,26(1):93-100.
[17]Hein G,Weiss C,Lehmann G,etal.Advanced glycation end product modification of bone proteins and bone remodeling:hypothesis and preliminary immunohistochemical findings[J].Ann Rheum Dis,2006,65(1):101-104.
[18]Santana RB,Xu L,Chase HB,etal.A role for advanced glycation end products in diminished bone healing in type 1 diabetes[J].Diabetes,2003,52(6):1502-1510.
[19]Chang PC,Chung MC,Wang YP.Patterns of diabetic periodontal wound repair:a study using micro-computed tomography and immunohistochemistry[J].J Periodontol,2012,83(5):644-652.
[20]Retzepi M,Donos N.The effect of diabetes mellitus on osseous healing[J].Clin Oral Implants Res,2010,21(7):673-681.
[21]Ding KH,Wang ZZ,Hamrick MW,etal.Disordered osteoclast formation in RAGE-deficient mouse establishes an essential role for RAGE in diabetes related bone loss[J].Biochem Biophys Res Commun,2006,340(4):1091-1097.
[22]Yasuhiro Hamada,Sohei Kitazawa,Riko Kitazawa,etal.The effects of the receptor for advanced glycation end products(RAGE)on bone metabolism under physiological and diabetic conditions[J].Endocr,2010,38(3):369-376.
[23]Lalla E,Lamster IB,Feit M,etal.Blockade of RAGE suppresses periodontitis-associated bone loss in diabetic mice[J].J Clin Invest,2000,105(8):1117-1124.
Effect of RAGE on Bone Metabolic Disorders in Diabetic Model of Rats
Li Jian1,Liu Yaping2,Guo Hongmin1,etal
(1.Department of Orthopaedics,Jining the First People′s Hospital,Jining 272100,China;2.2nd Department of Endocrinology,the First People′s Hospital,Jining 272100,China)
Objective To observe the bone metabolic characters in diabetic model of rats and bone expressions of RAGE.Methods Diabetic model of male rats was set up by feeding high-glucose and high-fat diet and injecting intraperitoneally with a low-dose streptozotocin(STZ).All rats were sacrificed after 20 weeks.The biomechanical indexes,glycosylated hemoglobin(GHb)A1c,serum advanced glycation end-products,fasting plasma glucose,fasting serum insulin were measured.Serum AGEs were measured with fluorospectrophotometer.RAGE was measured with RT-PCR.Results Compared with normal control group,the level of GHbA1c、serum AGEs、FPG、FINS of male diabetic model of rats and Goto-kakizaki rats markedly increased,and the biomechanical indexes markedly decreased.RAGE was detected by RT-PCR in diabetic male rats and Goto-kakizaki rats.Conclusion Bone mineral density and bone strength decreased,and risk of fracture increased in diabetic male rats and Goto-kakizaki rats.AGEs-RAGE interaction contribute to disturbed bone remodeling.
diabetes mellitus;rats;bone biomechanics;advanced glycation end-products
1008-5572(2015)07-0618-04
R587.1
A
2015-01-15
李健(1979- ),男,医师,济宁市第一人民医院骨关节科,272100。
