高温胁迫下菜心SSH cDNA文库的建立
2015-06-23郭培国王直亮夏岩石许兰桂李荣华黄红弟郑岩松
郭培国,王直亮,夏岩石,许兰桂,李荣华,黄红弟,张 华,郑岩松
(1.广州大学生命科学学院,广东广州 510006;2.广州市农业科学研究院,广东广州 510308)
高温胁迫下菜心SSH cDNA文库的建立
郭培国1,王直亮1,夏岩石1,许兰桂1,李荣华1,黄红弟2,张 华2,郑岩松2
(1.广州大学生命科学学院,广东广州 510006;2.广州市农业科学研究院,广东广州 510308)
为发现与菜心耐热性相关的差异表达基因,该研究以耐热性强的“四九19号菜心”和耐热性弱的“3T6”作实验材料,采用抑制差减杂交(SSH)技术,构建了一个高温胁迫下在“四九19号菜心”中特异表达的SSH cDNA基因文库.该文库共有154个contigs,经测序和拼接获得99条unique ESTs.这些EST序列长度在122~819 bp之间,平均344 bp.BLAST分析发现99条ESTs代表81个基因,其中68个基因有功能注释、9个无功能注释和4个未匹配的新基因.这些基因可能与菜心的耐热性相关.
菜心;耐热;SSH cDNA文库;基因
菜心(Brassica campestris L.ssp.chinensis var. utilis Tsen et Lee)又称菜薹,是华南地区栽培面积最大、具有优势和标志性的蔬菜种类之一[1],为十字花科芸薹属(Brassica)白菜亚种的一个变种,喜冷凉,属耐寒和半耐寒性蔬菜[2].但在盛夏秋初,菜心的生长常常遭遇到不同程度的高温胁迫,严重影响了菜心的正常生长和发育,导致产量和品质下降[3].因此高温季节菜心的生产成为难题,形成供应的淡季.认识菜心耐热性的生理特性和耐热性的分子机理,可为采用适宜的措施提高菜心的耐热性、辅助选育出耐热性强的菜心品种提供理论基础.近年来,已有研究发现一些菜心的形态性状和生理特性与菜心的耐热性相关[3-4],这对认识和了解菜心的耐热性起到积极作用,但未见开展探讨与菜心耐热性相关基因等从事分子机理研究的报道.
就发现与某一性状相关基因的方法来讲,抑制差减杂交(Suppression subtractive hybridization,SSH)被认为是一种较为适合的技术,可在转录水平上发现两材料间差异表达的基因[5-6].该技术利用mRNA逆转录后的cDNA作材料,通过两次差减杂交消除两材料共同cDNA、两次PCR扩增富集低丰度差异表达的cDNA,从而达到分离差异表达基因的cDNA的目的[5,7].自1996年报道SSH的方法以来,已成功应用在多种动植物上,发现了多个与表型性状相关的功能基因,并成功揭示了动植物中一些生命活动的分子机理[6-9].
本研究选用在耐热性上具显著差异的2个菜心品种(系)作材料,提取高温胁迫处理后的mRNA,以耐热性强的菜心材料的cDNA作检测样品(Tester)、耐热性弱的菜心材料的cDNA作为参照样品(Driver),采用SSH方法建立cDNA基因文库,测定和分析文库中的cDNA序列从而发现与菜心耐热相关的基因,并从整体上对所发现耐热相关基因进行初步的基因功能分析.研究结果可为菜心耐热相关基因的确定、从分子水平上探究菜心耐热性机理以及功能基因辅助菜心耐热品种的选育提供理论和应用基础.
1 材料与方法
1.1 实验材料
供试的2份菜心材料“四九19号菜心”和“3T6”的种子由广州市农业科学院提供.其中“四九19号菜心”为耐热性强的菜心品种,“3T6”为耐热性弱的菜心品系[4].
1.2 高温胁迫处理
2份菜心材料的种子播种于盛有培养基质分格的育苗盘中(每格的长宽深分别为6 cm×6 cm×7cm),置于人工气候箱中萌发和生长.人工气候箱光温条件:白天25℃、12 h 400 μmol·m-2·s-1的光照,晚上20℃;人工气候箱内的相对湿度控制在70%~80%.出苗后及时疏苗,保留每格1株,待幼苗长到3叶1心期,选取生长一致的幼苗移栽至直径为16 cm、高为20 cm的种植盆中,每盆1株.
待菜心长到现蕾初期,将两菜心材料移至温度为38℃、光强为400 μmol·m-2·s-1、相对湿度为70%~80%的人工气候箱中进行高温胁迫处理,胁迫处理6 h后,收获薹茎上第3片完全展开叶的叶片,置于液氮中速冻,之后保存在-80℃冰箱中备用.
1.3 总RNA和mRNA的提取
选用Invitrogen公司的Trizol试剂(Catalog No:15596-026)及其操作说明提取高温胁迫后“四九19号菜心”和“3T6”叶片中的总RNA;使用Promega公司的PolyATract®mRNA Isolation system III试剂盒及操作说明书从提取的总RNA中纯化出mRNA.利用Thermo Scientific NanoDrop超微量紫外分光光度计检测提取的总RNA和mRNA的浓度,保存在-80℃冰箱中备用.
1.4 SSH cDNA文库的构建
选用Clontech的PCR-SelectTM cDNA subtraction Kit,以耐热性强的菜心品种“四九19号菜心”作为测试样品(Tester),以耐热性弱的菜心品系“3T6”作为参照样品(Driver),按照使用说明书的操作步骤开展2个样品间的抑制差减杂交.其操作流程简述如下:取Tester和Driver的mRNA各2 μg,经逆转录和聚合反应生成双链cDNA,使用RsaI核酸内切酶切割双链cDNA并利用2个接头连接切割后的产物,经过两轮杂交以除去共同cDNA片段,再经两轮PCR扩增(其中第2次为巢式PCR)富集出差异性表达基因片段;巢式PCR的产物与Promega公司的pGEM-T Easy载体连接形成重组载体,用热激法将重组载体转化到大肠杆菌DH5α的感受态细胞中;运用Ampicillin培养基除去未转化成功的大肠杆菌,采用蓝/白斑筛选方法鉴别出具有重组载体的白色菌落,用牙签挑取白色菌落并振荡培养12 h,取部分菌液加入适量甘油贮存于-80℃冰箱备用,获得SSH cDNA文库.
1.5 SSH cDNA文库的cDNA片段大小与DNA序列分析
为检测SSH cDNA文库中各个cDNA片段的大小,利用pGEM-T Easy载体的操作说明中提供的T7启动子检测引物(5′-TAATACGACTCACTATAGGG-3′)和SP6启动子检测引物(5′-TATTTAGGTGACACTATAG-3′)对各个克隆进行菌液PCR,使用2%琼脂糖凝胶检测PCR扩增产物的大小.
将菌落PCR扩增产物为唯一条带的克隆送至生物工程有限公司进行测序,测序后的序列数据应用DNAStar 7.0软件去除接头序列和载体序列,并进行拼接聚类,获得拼接后unique ESTs序列.利用GenBank(http://www.ncbi.nih.gov/genbank)和KEGG(http://www.genome.jp/kegg/)对所有ESTs进行同源匹配检索的Blast分析[10-11].
2 结果与分析
2.1 总RNA及mRNA的质量分析
总RNA的完整性和纯度是构建SSH文库的关键步骤之一[10].本研究提取到的2个菜心材料的总RNA经琼脂糖电泳,可以清楚地观察到总RNA中3条边缘清晰无弥散的28S、18S和5S的RNA条带,且28S RNA条带亮度明显高于18S RNA(图1);使用紫外分光光度计检测2样品总RNA的A260/A280的比值均在2.0左右.表明提取出的高温胁迫下“四九19号菜心”和“3T6”菜心材料的总RNA未出现降解,RNA的完整性高、质量好.
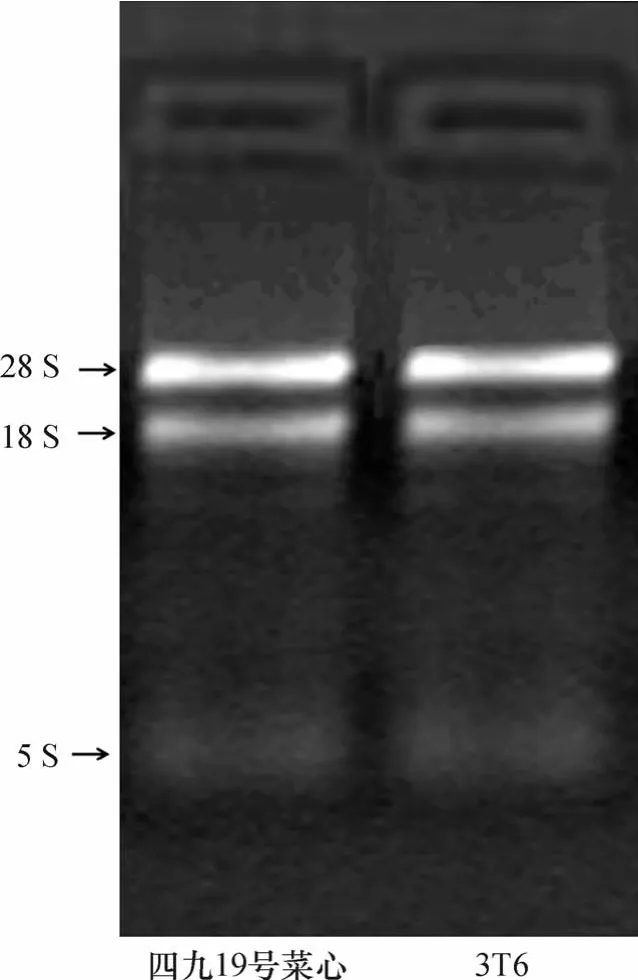
图1 “四九19号菜心”和“3T6”菜心材料总RNA的琼脂糖凝胶电泳图Fig.1 Image of agarose gel electrophoresis for the total RNAs of“Sijiu 19 caixin”and“3T6”
在此基础上,利用提取的总RNA,采用mRNA纯化试剂盒纯化各材料的mRNA,纯化后的mRNA经NanoDrop超微量紫外分光光度计分析,其A260/A280比值在2.0左右,表明mRNA纯度较好,符合构建SSH cDNA基因文库的要求.
2.2 抑制差减杂交效果分析
抑制差减杂交效果是建立高质量SSH cDNA文库的核心[6].从图2的琼脂糖凝胶电泳图可见,第一次PCR中未差减样品cDNA片段扩增产物的大小主要集中在300~700 bp,而差减样品的扩增产物主要集中在320~600 bp,表明差减过程有效地除去了非差异表达片段,而富集了低丰度差异表达的片段.第二次PCR是根据接头序列设计引物进行的巢式PCR,差减和未差减样品扩增产物片段的大小基本一致;因第二次PCR扩增产物不含部分载体序列,与第一次PCR相比其扩增产物大小稍微减少,主要集中在200~480 bp,这与预期结果一致;另外,从图2中还可观察到未差减样品扩增产物的荧光强度明显高于差减样品,表明未差减样品扩增产物的量高于未差减样品,进一步说明了差减样品中主要为差异表达的片段.为了检测差减效率,利用差减和未差减样品的第二次PCR产物作为模板,分析不同PCR循环次数下持家基因RPS6(核糖体蛋白S6,引物1:5′-TCTCTCTTGTGGCTGTAGTC-3′,引物2:5′-CCTGACATCATCCTCCTTAA-3′)的扩增产物;电泳检测结果表明,差减样品为模板经33次循环的扩增产物量与未差减样品为模板经23次循环的扩增产物的量相当(图3).这一结果表明SSH方法的差减效果好、差减效率高,同时也表明了本研究开展的抑制差减杂交实验获得成功.
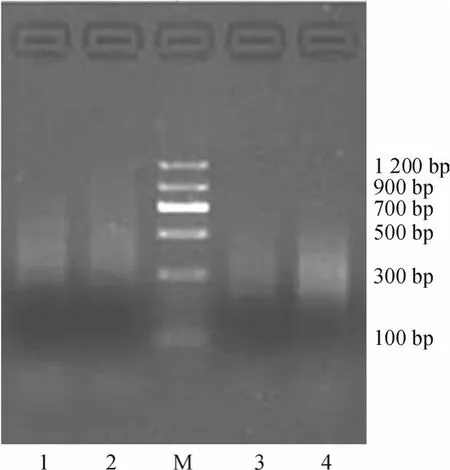
图2 抑制差减杂交的第一次和第二次PCR扩增产物的凝胶电泳图Fig.2 Gel electrophoresis image of PCR products at the first and second rounds of SSH
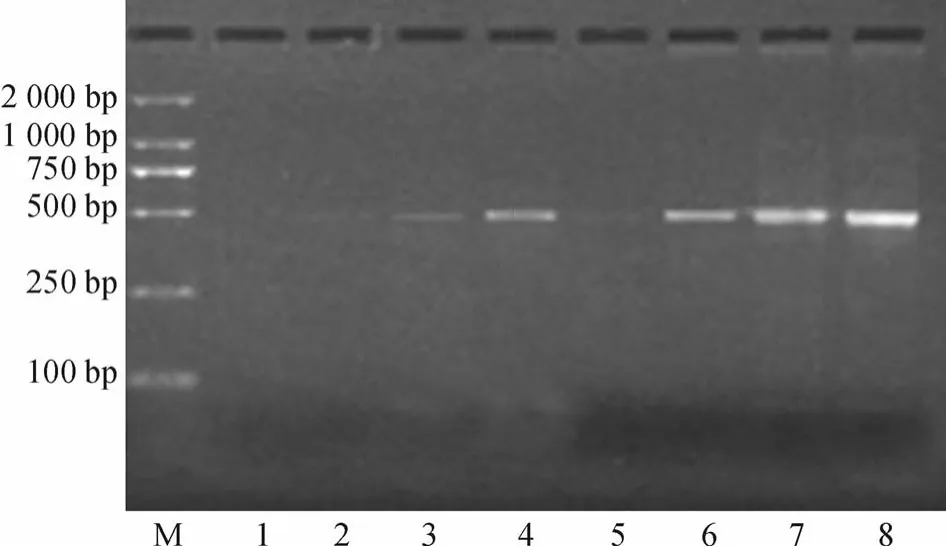
图3 差减效率的PCR评价Fig.3 Evaluation of subtraction efficiency by PCR
2.3 SSH cDNA文库的建立
将第二次PCR扩增产物与载体连接,经转化、铺平板和过夜培养后,依据蓝白斑筛选的原理,对在含有氨苄青霉素平板上白色的阳性克隆进行筛选、确认和编号,共发现有161个白色克隆.这些克隆经菌落PCR扩增后,扩增产物用2%琼脂糖凝胶电泳检测.结果见图4,所得克隆扩增产物主要集中在300~900 bp之间.由于Promega T Easy载体空载体中T7引物到SP6引物之间有179 bp,因此插入到载体中的cDNA片段的大小还要扣除179 bp.有少数克隆无扩增条带或扩增出多个条带,无扩增条带的克隆将再次采用PCR扩增核实,具多个条带的克隆将再次铺平板分离和PCR核实.最后,确定出具有1个扩增条带的克隆154个,这些克隆所携带的cDNA信息即为本研究所得的cDNA基因文库.
2.4 SSH cDNA文库的测序与分析
选取文库中154个具有唯一扩增条带克隆的菌液PCR扩增产物,送样给生工生物工程(上海)有限公司进行DNA序列分析.根据154个克隆样本的测序结果,除去接头和载体序列,分析发现154个ESTs中,最短的EST序列长度为122 bp,最长的EST为785 bp,平均325 bp.
进一步利用DNAStar软件对所有EST序列进行拼接聚类,共获得99个unique ESTs.这些EST序列长度在122~819 bp之间,平均344 bp.运用Genbank(http://www.ncbi.nlm.nih.gov/genbank/)和KEGG(http://www.genome.jp/kegg/)的芸薹属植物油菜基因组及EST数据库,对99个EST序列进行BLAST相似性比较,发现只有4个ESTs在数据库中未发现类似的序列,它们可能属于新的基因序列;其余95个ESTs序列与Genbank和KEGG中公布的数据序列具有相似性.分析发现95个 ESTs序列中有18个ESTs是一些全长基因的部分序列可进一步拼接,拼接后代表77个基因.这77个基因中有9个无功能注释,其余68个基因有功能注释(表1).有功能注释的基因主要与光合作用、信号传导、活性氧清除、细胞生长与分化、植物抗逆反应等相关.这些有功能注释的68个基因、无功能注释的9个基因及4个未发现相似序列的基因可能与菜心的耐热性相关.
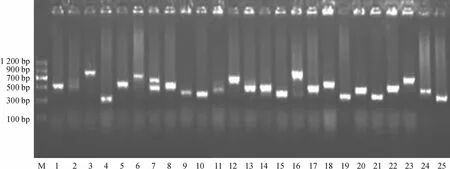
图4 筛选出白色克隆的PCR扩增产物的琼脂糖凝胶电泳图Fig.4 Image of agarose gel electrophoresis for the PCR products of the partially screened white clones
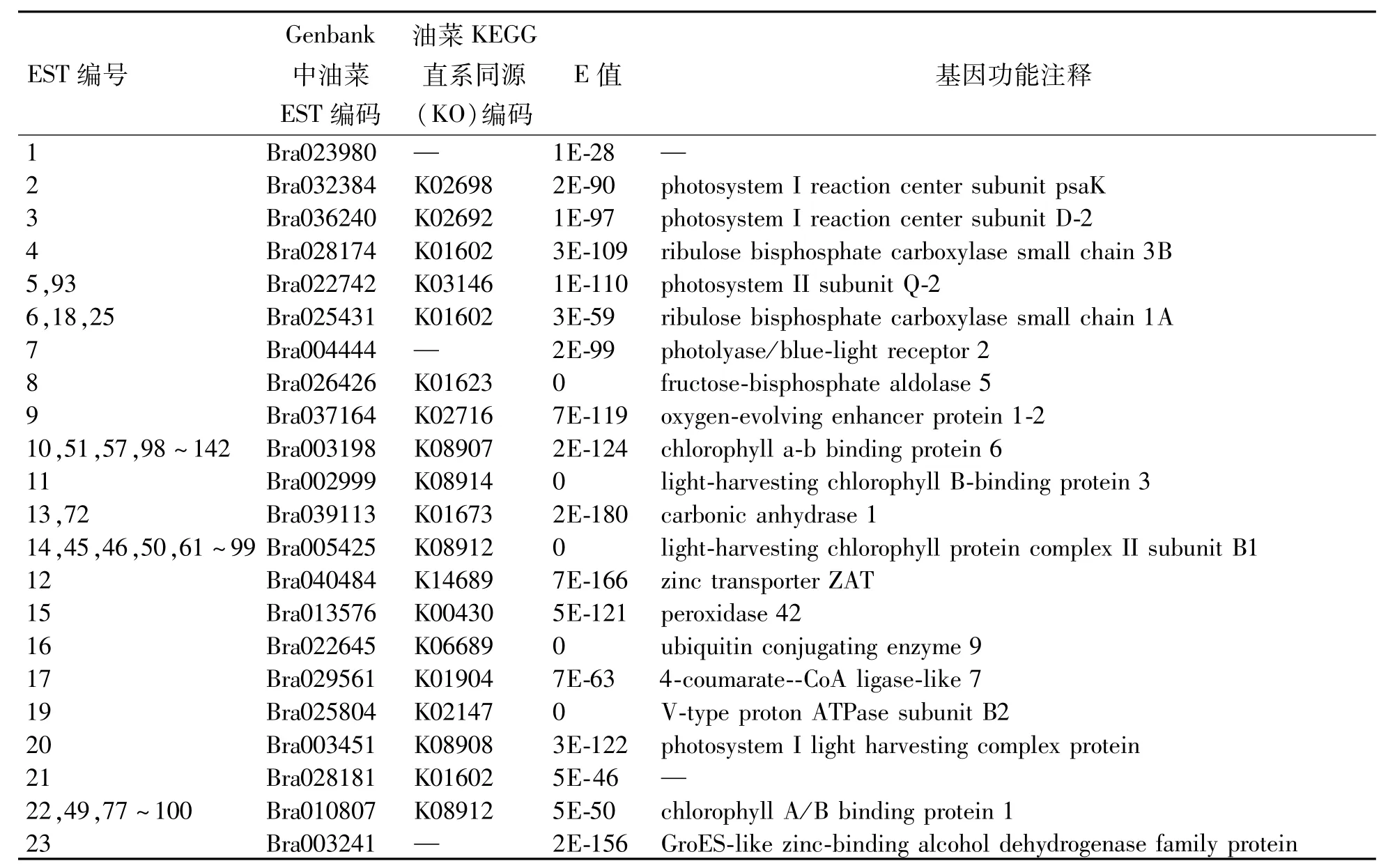
表1 SSH cDNA文库中unique EST Blast分析结果Table 1 Result of Blast analysis for unique ESTs at the SSH cDNA library

续表1
3 讨 论
SSH技术被认为是一种能较好发现差异表达基因的方法[6,8,12],总RNA质量、酶切割、低拷贝cDNA片段的富集、阳性克隆筛选等操作该技术的关键步骤[6].从本研究实验结果来看,2菜心材料总RNA电泳图显示上样孔干净、3个RNA(28S、18S和5S)条带清晰、OD260/280比值在2.0左右,表明总RNA质量好.抑制差减杂交和稀有表达片段的富集效果经电泳检测的结果显示,非差异表达的cDNA片段被有效的除去,低丰度差异表达的cDNA片段得到富集,表明抑制差减杂交获得成功.所建立的具有154个阳性克隆(代表99个unique ESTs)的文库,测序分析表明阳性克隆插入的cDNA片段大小在122~785 bp之间,平均325 bp.因为理论上四碱基核酸识别酶RsaI每256 bp会有1个酶切位点,且RsaI酶切片段一般小于600 bp[13].因此,文库中cDNA片段的大小符合RsaI切割片段长度大小的范围,表明切割效果较好.就文库的大小和文库中EST片段长度来讲,与他人在其他植物如油菜[14]、甘蓝[15]、辣椒[16]、小麦[6]和角蒿[12]等建立的SSH文库基本一致.上述表明,本研究成功建立了一个在菜心耐热材料中差异表达的SSH cDNA基因文库,能较好地发现热胁迫下耐热菜心材料中差异表达基因.
Blast分析99个unique ESTs,发现4个未匹配、9个无功能注释和68个有功能注释的基因.有功能注释基因中有相当部分基因编码与光合作用相关的蛋白,如oxygen-evolving enhancer protein、chlorophyll a-b binding protein、photosystem I reaction center subunit和ribulose bisphosphate carboxylase等,这表明高温胁迫后耐热性强的“四九19号菜心”光合相关的基因表达量高于耐热性弱的“3T6”,这与Crafts-Brandner和Salvucci[17]研究得出高温胁迫首先伤害植物光合器官的结果一致.另外,这些有功能注释基因的产物还与保护细胞免受伤害的抗逆反应(如HSP90-like protein GRP94、Metallothionein和peroxidase等)、决定细胞生死的代谢(如ubiquitin conjugating enzyme)、调控细胞生长和分化(如Rho GTPase activation protein)及信号传导(如CIPK1 interacting protein)等有关,无功能注释和未匹配的基因可能属于新的功能基因,需进一步研究了解其可能的功能.所有这些基因可能与菜心的耐热性相关.
[1] 张华,刘自珠.菜薹(菜心)的市场需求与育种现状[J].中国蔬菜,2010(3):10-12. ZHANG H,LIU Z Z.Marketing requirements of flowering Chinese cabbage and the current situation in flowering Chinese cabbage breeding[J].Chin Veget,2010,(3):10-12.
[2] 张振贤,喻景权,于贤昌,等.蔬菜栽培学[M].北京:中国农业大学出版社,2003:177-183. ZHANG Z X,YU J Q,YU X C,et al.Vegetable cultivation[M].Beijing:China Agricultural University Press,2003:177-183.
[3] 李荣华,郭培国,张华,等.高温胁迫对菜心农艺性状的影响[J].长江蔬菜,2011(22):39-43. LI R H,GUO P G,ZHANG H,et al.Effect of heat stress on agronomic traits of flowering Chinese cabbage[J].J Chang Jiang Veget,2011(22):39-43.
[4] 李荣华,郭培国,张华,等.高温条件下不同耐热性菜心材料的生理特性差异研究[J].北方园艺,2012(1):1-6. LI R H,GUO P G,ZHANG H,et al.Effects of heat stress on several physiological traits in heat-tolerant and heat-sensitive genotypes of flowering Chinese cabbage[J].North Hort,2012(1):1-6.
[5] DIATCHENKO L,LAU Y F,CAMPBELL A P,et al.Suppression subtractive hybridization:A method for generating differentially regulated or tissue-specific cDNA probes and libraries[J].Proc Nat Acad Sci USA,1996,93(12):6025-6030.
[6] GUO P,BAI G,CARVER B,et al.Transcriptional analysis between two wheat near-isogenic lines contrasting in aluminum(Al)tolerance under Al stress[J].Molec Genet Genom,2007,277(1):1-12.
[7] 李小庆,景志忠.抑制性消减杂交技术的应用[J].生物技术通报,2009(5):46-50. LI X Q,JING Z Z.Supression subtractive hybridization technique and progress in application[J].Biotech Bull,2009(5):46-50.
[8] LI D M,LÜ F B,ZHU G F,et al.Identification of warm day and cool night conditions induced flowering-related genes in a Phalaenopsis orchid hybrid by suppression subtractive hybridization[J].Genet Molec Res,2014,13(3):7037-7051.
[9] SAMANTA P,SADHUKHAN S,BASU A.Identification of differentially expressed transcripts associated with bast fibre development in Corchorus capsularis by suppression subtractive hybridization[J].Planta,2015,241(2):371-385.
[10]柴兴苹,张玉秀,谭金娟,等.锌胁迫下小麦SSH文库的构建及初步分析[J].中国生物化学与分子生物学报,2013,29(8):783-790. CHAI X P,ZHANG Y X,TAN J J,et al.Construction and analysis of wheat SSH libraries induced under Zinc Stress[J]. Chin J Bioch Mol Biol,2013,29(8):783-790.
[11]GLIGORIJEVI'C V,JANJI'C V,PRŽULJ N.Integration of molecular network data reconstructs Gene Ontology[J].Bioinformatics,2014,30(17):594-600.
[12]丁勇,常玮,张石宝,等.热胁迫下中甸角蒿叶片SSH文库的构建及初步分析[J].植物分类与资源学报,2012,34(1):47-55. DING Y,CHANG W,ZHANG S B,et al.Construction of leave library by SSH and preliminary analysis of genes responsible for heat sress in Incarvillea zhongdiannensis[J].Plant Divers Resour,2012,34(1):47-55.
[13]苏红英,张鹏飞.抑制性消减杂交技术研究进展[J].福建医科大学学报,2004,38(3):354-357. SU H Y,ZHANG P F.Research progress of supresión subtractive hybrization technique[J].J Fujian Med Univ,2004,38(3):354-357.
[14]彭琦,胡燕,杜培粉,等.甘蓝型油菜种子不同发育时期SSH文库的构建[J].作物学报,2009,35(9):1576-1583. PENG Q,HU Y,DU P F et al.Construction of SSH library with different stages of seeds development in Brassica napus L[J].Acta Agron Sin,2009,35(9):1576-1583.
[15]朱妍,王超.利用SSH技术分离甘蓝抗黑腐病相关的基因的研究[J].中国蔬菜,2010(10):20-24. ZHU Y,WANG C.Studies on isolation of resistance related-genes to black rot by suppression subtractive hybridization in Brassica oleracea[J].Chin Veget,2010(10):20-24.
[16]王雯,刘辰,沈火林.辣椒细胞质雄性不育系和保持系SSH-cDNA文库的构建[J].中国瓜菜,2011,24(3):1-5. WANG W,LIU C,SHEN H L.Construction of SSH cDNA library for cytoplasm male sterility lines and maintainer lines in pepper[J].Chin Cucurb Veget,2011,24(3):1-5.
[17]CRAFTS-BRANDNER S J,SALVUCCI M E.Rubisco activase constrains the photosynthetic potential of leaves at high temperature and CO2[J].Proc Nat Acad Sci USA,2000,93:6025-6030.
Preliminary study for investigation of heat-tolerant related genes in flowering Chinese cabbage
GUO Pei-guo1,WANG Zhi-liang1,XIA Yan-shi1,XU Lan-gui1,LI Rong-hua1,HUANG Hong-di2,ZHANG Hua2,ZHEN Yan-song2
(1.School of Life Sciences,Guangzhou University,Guangzhou 510006,China;2.Guangzhou Academy of Agricultural Science,Guangzhou 510308,China)
In order to investigate differentially expressed genes related to heat tolerance in flowering Chinese cabbage,two genotypes“Sijiu 19 caixin(heat tolerance)”and“3T6(heat sensitive)”were chosen as plant materials,a cDNA library comprising the cDNA fragments of differentially expressed genes under heat stress in“Sijiu 19 caixin”was constructed by utilizing the technique of suppression subtractive hybridization(SSH). The library contains 154 contigs which represent 99 unique ESTs through sequencing and assembling.The lengths of the ESTs range from 122 to 819 bp,with an average length of 344 bp.Blast analysis shows the 99 ESTs stand for 81 genes;among them,68 genes were annotated,9 genes were non-annotated,and 4 novel genes did not match any entry in the databases.These genes may be heat-tolerant related genes in flowering Chinese cabbage.
flowering Chinese cabbage;heat tolerance;SSH cDNA library;gene
S 634.5
A
【责任编辑:周 全】
1671-4229(2015)01-0043-07
2014-11-10;
2014-11-19
广州市科技计划资助项目(1212011541,2014J4100123);广州市属高校科技计划资助项目(1201420621)
郭培国(1963-)男,教授.E-mail:guopg@yahoo.com
