免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素
2015-06-21严忠雍张小军李奇富王莹柳家鹏龙举祝银杨会成
严忠雍 张小军 李奇富 王莹 柳家鹏龙举 祝银 杨会成
1(浙江省海洋水产研究所,舟山316021)
2(江苏美正生物科技有限公司,无锡214135)
3(浙江省海洋渔业资源可持续利用技术研究重点实验室,舟山316021)
4(浙江省海洋开发研究院,舟山316021)
1 引言
河豚毒素(Tetrodotoxin,TTX)是一种天然海洋生物神经毒素,分布广泛,主要存在于河豚鱼中,圆尾鲎、蓝环章鱼、螺类等其它海洋生物中也有存在。河豚毒素毒性极强,食用0.5 mg 就可致人死亡,其带正电荷的胍基能伸入钠通道的离子选择过滤器,和通道内壁上的游离羧基结合,阻碍Na+进入,从而抑制神经冲动的传导,使人感觉神经麻痹,四肢瘫痪,呼吸困难,最后因呼吸抑制而死亡[1~4]。我国每年都有因食带有TTX 的海洋生物而导致中毒的事件发生。鉴于河豚毒素的严重危害,有必要建立一种简便、快速有效检测河豚毒素的方法。目前,河豚毒素的检测方法有生物测定法[5]、高效液相色谱法(HPLC)[6,7]、液相色谱串联质谱法(LC-MS)[8~11]及酶联免疫法(ELISA)[12]等。其中,生物测定法一般需要专门动物,适用性差,且操作繁琐,费时费力重复性差;酶联免疫法虽特异性强,但酶联免疫反应耗时长,操作难度较大;液相色谱串联质谱法灵敏度高,但现有的文献方法检出限偏高,前处理复杂,且采用的固相萃取技术净化样品不理想、易受基质干扰,回收率低。免疫亲和柱(IAC)是一种基于抗原抗体反应的新型层析柱,利用生物大分子具有对一类生物大分子特异识别和可逆结合的特性制作而成,具有独特的选择专一性和良好的吸附净化性能。目前,尚未见以免疫亲和柱作为前处理净化手段检测河豚毒素的相关报道,本实验基于液相色谱串联质谱的高灵敏性和精确性,利用免疫亲和柱的独特选择识别性,建立一种快速、简便、高效测定海洋生物中河豚毒素的分析方法。
2 实验部分
2.1 仪器与试剂
ACQUITY 超高效液相色谱-质谱仪Quattro Premier XE(美国Waters 公司);MS2 漩涡混合器(德国IKA 公司);N-EVAP-112 氮吹仪(美国Organomation 公司);Centrifuge5810 高速离心机(德国Eppendorf公司);12 通道固相萃取装置(美国Supelco 公司)。
TTX 标准品(纯度≥98.0%,德国Dr.Ehrenstorfer 公司);TTX 免疫亲和柱(柱容量3 mL,北京华安麦科生物技术有限公司);乙腈、甲醇(色谱纯,德国Merck 公司);乙酸铵、甲酸(美国Sigma 公司);乙酸、Na2HPO4·12H2O、NaH2PO4·2H2O、NaCl、NaOH(上海国药集团);实验用水均为超纯水。
2.2 溶液的配制
TTX 标准溶液:准确称取5.00 mg TTX 标准品,用0.1%甲酸-乙腈(1∶1,V/V)溶液溶解并定容至50 mL,4 ℃避光保存,保存期限为6 个月;使用时逐级用0.1%甲酸-乙腈溶液(1∶ 1,V/V)稀释至100 μg/L。磷酸盐缓冲液(PBS):分别称取Na2HPO4·12H2O 6.45 g,NaH2PO2·2H2O 1.09 g,NaCl 4.25 g,用水溶解并定容至500 mL。
2.3 色谱及质谱条件
色谱柱:ACQUITY UPLC BEH Amide 柱(50 mm×2.1 mm,1.7 μm);样品室温度10 ℃;柱温40 ℃;进样体积10 μL;流速0.3 mL/min;流动相A 为含0.1%甲酸的5 mmol/L 乙酸铵溶液,B 为乙腈,梯度洗脱:0 ~1.5 min,5% ~80% A;1.5 ~3.0 min,80% A;3.0 ~3.5 min,80% ~5% A;3.5 ~5 min,5% A。
质谱条件:电喷雾离子源,正离子扫描(ESI +);检测方式:多反应监测(MRM);毛细管电压:3.0 kV;离子源温度:110 ℃;脱溶剂气温度:350 ℃;锥孔气流量:50 L/h;脱溶剂气流量:600 L/h;锥孔电压、碰撞能量、分析物母离子及子离子等质谱多反应监测实验条件如表1 所示。

表1 河豚毒素的质谱多反应监测实验条件Table 1 Conditions of multiple reaction monitoring for tetrodotoxin (TTX)
2.4 样品处理
2.4.1 样品提取 称取已充分均质样品2.00 g 于50 mL 具塞离心管中,加入10 mL 含有1%乙酸的甲醇溶液,涡旋振荡2 min,60 ℃水浴超声提取15 min,冷却至室温后,6000 r/min 离心5 min。移取5 mL 上清液至另一个50 mL 离心管中,加入20 mL PBS 溶液稀释,用1 mol/L NaOH 调至pH 7 ~8,待净化。
2.4.2 免疫亲和柱净化 取出免疫亲和柱,待回至室温,去掉亲和柱堵头,放出柱内保存液后,上样品液。上样结束后,用8 mL 水淋洗亲和柱,挤干柱内残留液,并弃去以上全部流出液,最后用4 mL 含有1%乙酸的甲醇溶液洗脱,收集的洗脱液于60℃氮气吹干,用1 mL 流动相溶解并定容,经0.22 μm 滤膜后供液相色谱-质谱分析。
3 结果与讨论
3.1 色谱与质谱条件选择
TTX 由于亲水性和极性较强,在一般的反向色谱柱上不易保留,而ACQUITY UPLC BEH Amide 色谱柱作为专用于强极性化合物分析的亲水色谱柱,对TTX 保留性强,且具有较好的色谱峰形,满足TTX液相色谱分析的需要。乙酸铵溶液能促进TTX 胍电离,并为阳离子的形成提供了质子来源,提高TTX离子化效率;甲酸能通过调节流动相pH 达到合适的分离效果,改善色谱峰形。本实验研究比较了多组不同体积分数甲酸及不同浓度乙酸铵溶液对色谱分析的影响。结果表明,以0.1%甲酸的5 mmol/L 乙酸铵溶液与乙腈为流动相具有良好的色谱分离效果,且峰形尖锐对称。
TTX 分子结构中具有带正电荷的胍基,本实验选择在正离子扫描模式下用蠕动泵以3.0 mg/L 的TTX 标准溶液进行流动注射分析,对质谱参数进行优化。通过一级质谱扫描分析,得到TTX 的分子离子,调试选择最佳锥孔电压和毛细管电压,其中[M+H]+(m/z 320)丰度最高,从而可选择离子m/z 320作为母离子进行检测,如图1 所示。对分析物离子进行二级质谱分析,获取碎片离子信息,并对碰撞能量等质谱参数进行优化,见表1。
3.2 提取试剂的选择
TTX 是一种氨基全氢喹唑啉型化合物,只溶于酸性水或有机溶液。本实验比较了乙腈和甲醇对TTX 的提取效率。乙腈作为常用的提取试剂,提取效率较好,但毒性较大;考虑到甲醇能迅速穿透组织,沉淀蛋白质,并具有脱水性,是提取TTX 的良好试剂。为考察TTX 提取所需的合适酸度,通过添加不同体积分数的乙酸获取不同酸度的甲醇,比较不同酸度甲醇下提取得到的5 μg/L TTX 峰面积,结果如图2 所示。当提取试剂中乙酸体积分数小于1%时,提取得到的TTX 峰面积随乙酸的体积分数增加而增大;当体积分数大于1%后,峰面积基本保持不变,而过量的乙酸不利于调节样品液pH 值,因此选择含1%乙酸甲醇作为TTX 提取试剂。

图1 TTX 一级质谱全扫描图Fig.1 MS scan spectra of TTX
3.3 免疫亲和柱条件优化
免疫亲和柱的亲和结合作用与样品液的pH 值直接相关,不适宜的pH 值会使亲和作用减弱或破坏。本实验采用HCl 和NaOH 调节样品液pH 值,通过比较不同pH 值下TTX 的回收率,考察不同pH值下免疫亲和柱的亲和作用能力,结果如图3 所示。当pH =7 ~8 时,亲和作用能力最佳,TTX 回收率最高;当pH <6.5 或pH >9 时,亲和能力明显减弱,由此确定pH=7 ~8 时为TTX 免疫亲和柱的最适宜pH 值。当使用8 mL 水淋洗亲和柱时,杂质可基本除去,而TTX 未被洗脱下来;当4 mL 含有1%乙酸甲醇洗脱亲和柱时,TTX 几乎已完全洗脱,回收率也趋于稳定。因此本实验采用8 mL 水作为淋洗液,4 mL 含有1%乙酸甲醇作为洗脱液。

图2 提取试剂酸度对TTX 提取效果的影响Fig.2 Effect of extraction reagent acidity on TTX extraction
本实验还比较了MCX 柱、C18柱、SCX 柱与免疫亲和柱对海洋生物的净化效果,并考察4 种层析柱对TTX 回收率的影响。实验结果表明,免疫亲和柱对海洋生物样品的净化效果最好,目标峰能与杂峰有效分离,且响应强度高,回收率好,如图4 所示。

图3 样品液pH 值对样品中TTX 的回收率的影响Fig.3 Influence of pH on the recoveries of TTx in sample solution
3.4 线性范围和定量限
用TTX 标准使用液配制浓度为0.3,1.0,2.0,5.0,10.0 和20.0 μg/L 标准工作溶液,峰面积-TTX 浓度标准曲线的线性回归方程为y =72.2835x +13.5344(R2=0.9972),TTX 在0.3 ~20.0 μg/L 范围内线性良好。以3 倍信噪比确定本方法的检出限(LOD)为0.1 μg/kg,以10 倍信噪比确定本方法的定量限(LOQ)为0.3 μg/kg,如图5 所示。本方法较文献[10,11]检出限更低,灵敏度提高了3 ~4 倍,适用于海洋生物中TTX 的检测。

图4 10 μg/kg 加标阴性样品经免疫亲和柱净化后的MRM 图谱(a.定量离子对;b.定性离子对)Fig.4 MRM chromatograms of 10 μg/kg spiked sample cleaned up by IAC column(a.quantitative ion pair;b.qualitative ion pair)

图5 TTX 定量限的MRM 图(a.定量离子对;b.定性离子对)Fig.5 MRM chromatograms of quantification limit (a.quantitative ion pair;b.qualitative ion pair)
3.5 回收率和精密度
准确称取2.00 g 阴性对虾样品,添加水平为0.30,1.50 和5.00 μg/kg 的TTX 标准溶液,每个添加水平平行测定6 次,计算回收率和精密度,结果见表2。TTX 在0.30 ~5.00 μg/kg添加水平的平均回收率88.7% ~102.3%,相对标准偏差为2.0% ~6.4%。
3.6 实际样品分析
采用本方法对鹰爪虾、对虾、海鳗、荔枝螺、单齿螺、织纹螺、枪乌贼、曼氏无针乌贼、贻贝、花蛤、三疣梭子蟹、细点圆趾蟹、圆尾鲎等共计13 种样品进行检测,其中织纹螺、花蛤、圆尾鲎样品中检出TTX,浓度依次为56.4,2.43 和174 μg/kg。分析结果表明,本方法采用免疫亲和柱净化、液相色谱-串联质谱法检测海洋生物中河豚毒素,灵敏度高,精密度和回收率均能满足检测分析的要求。
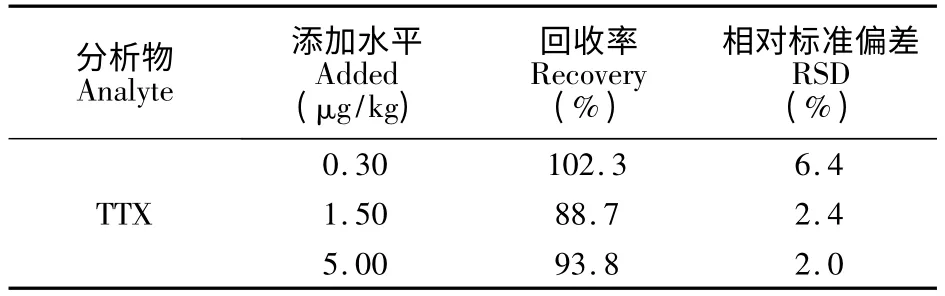
表2 TTX 的标准加入回收率和相对标准偏差(n=6)Table 2 Recoveries of standard addition and relative standard deviation for TTX (n=6)
1 WANG Jian-Wei,WANG De-Bin,LUO Xue-Yun,JI Rong,ZHANG Jing,CAO Ming-Hua.Journal of Hygiene Research.,1996,25(5):308 -311
王健伟,王德斌,罗雪云,计融,张靖,曹明华.卫生研究,1996,25(5):308 -311
2 LIN Zhong,FANG Guang-Wei,LU Wei,HUANG Ping,TONG Yu-Gui,CHENG Qun,LIN Bi-Fen.Chin.J.Food Hyg.,2012,24(2):145 -148
林中,方光伟,吕伟,黄萍,童玉贵,程群,林碧芬.中国食品卫生杂志,2012,24(2):145 -148
3 ZHANG Yong-Yi,WANG Yan,ZHANG Ji,WANG Ren-Feng,YAN Chao.Chinese J.Anal.Chem.,2008,36(5):588 -592
郑雍怡,王彦,张计,王刃锋,阎超.分析化学,2008,36(5):588 -592
4 Takuya M,Yuji N,Hiroyuki K,Shoichiro I,Kuniyoshi S,Kazuo S.Toxicon.,2008,51(6):1051 -1059
5 JI Yuan,LIU Yan,GONG Qing-Li.Journal of Fisherles of China.,2010,34(4):589 -597
纪元,刘岩,宫庆礼.水产学报,2010,34(4):589 -597
6 Tsai Y H,Hwang D F,Cheng C A,Hwang C C,Deng J F.J.Chromatogr.B,2006,832(1):75 -80
7 Allen D T,Jon L,Stacey E,Jonathan D,Sherwood H,Jiang S Y.Sens.Actuators B.,2008,130(1):120 -128
8 ZHANG Xiu-Yao,CAI Xin-Xin.Chinese J.Anal.Chem.,2009,37(12):1829 -1833
张秀尧,蔡欣欣.分析化学,2009,37(12):1829 -1833
9 Xiao W C,Hong X L,Yi B J,Shang F L,Xin B,Stephen C,Shu S Z,Yu Y J.Toxicon,2011,57(6):938 -943
10 Hsiao C,Thi A N,Ya J,Tung H,Osamu A,Wen F,Deng F.J.Food Drug Anal.,2014,22(2):178-188
11 Hsiao C,Shin J,Yung H,Chun H,Zu C,Deng F.J.Chromatogr.B,2008,871(2):95 -100
12 Determination of tetrodotoxin in fresh pufferfish.GB/T 5009.206-2007
鲜河豚鱼中河豚毒素的测定.中华人民共和国国家标准.GB/T 5009.206-2007
