液相色谱-电感耦合等离子质谱和电喷雾电离质谱研究乙二胺二氯合钯与鸟嘌呤脱氧核糖核苷酸反应产物
2015-06-21刘德晔朱峰马永建吉文亮刘华良
刘德晔 朱峰 马永建 吉文亮 刘华良
(江苏省疾病预防控制中心,南京210009)
1 引言
与Pt(Ⅱ)配合物相同,Pd(Ⅱ)配合物也有杀伤肿瘤细胞作用[1~4],Pt(Ⅱ)和Pd(Ⅱ)性质相近,采用dsp2 杂化形成平面四边形配合物,具有高度相似的结构特征。Pt(Ⅱ)配合物杀伤肿瘤细胞的机理是:其与DNA 中的鸟嘌呤脱氧核糖核苷酸5′-dGMP 形成分子键,使核酸变性细胞死亡[5,6];同样,Pd(Ⅱ)配合物也能使核酸变性[7~10]的细胞死亡。核酸由单核苷酸组成,而5′-dGMP 和5′-GMP(鸟嘌呤核糖核苷酸)是核酸的重要组成,研究Pd(Ⅱ)与5′-dGMP 和5′-GMP 发生分子键合原理和方式对Pd(Ⅱ)损伤DNA 以及细胞凋亡机理有理论和现实意义,对开发Pd(Ⅱ)抗癌药物有指导作用。Zhu 等[11]用电位滴定法和H1NMR 研究了乙二胺二水合Pd[Pd(en)(H2O)2]2+与鸟嘌呤核苷酸5′-GMP 相互作用,认为在pH 5.0 时[Pd(en)(H2O)2]2+与5′-GMP 的N1 位氮形成化合物[Pd(en)(N1-5′-GMP)(H2O)];在pH >8.0 时,4 分子5′-GMP 上N1 和N7 位氮会与4 分子[Pd(en)(H2O)2]2+形成四元环状化合物[Pd(en)(μ-N1,N7-5′-GMP)]4。Zhang 等[12]通过计算确定了[Pd(en)(H2O)2]2+与鸟嘌呤形成的四元环状化合物结构。Wirth 等[13]研究了[Pd(en)(H2O)2]2+与5′-GMP 相互作用,认为溶液中除了形成化合物单体和环状四聚体外还有二聚体。文献[11,13]均在混合体系中研究产物组成而未对其进行分离检测具有一定局限性,且文献所采用的滴定分析法不能直观定性,产物具有潜在不确定性。色谱和质谱是对复杂体系分离和定性的有力工具,近年来,基于HPLC-ICP-MS 研究食品保健品、水质、生物样本中元素的形态得到巨大的发展[14~17],在铂类抗癌药物的研究中得到广泛应用[18~20],但未见用于Pd 类抗癌药物的研究。本研究采用HPLC-ICP-MS 联用分离[Pd(en)Cl2](结构式见图1b)与5′-dGMP(结构式见图1a)反应产物,HPLC-DAD 对产物初步定性,并用ESI-MS 得出主产物分子结构。研究发现,[Pd(en)Cl2]与5′-dGMP反应产物中有两种能够在给定色谱条件下流出,且具有相同的紫外吸收光谱,其中主产物经ESI-MS(MS/MS)定性为[Pd(en)(N1-5′-dGMP)],而另一种产物为它的多聚物,其中[Pd(en)(N1-5′-dGMP)]可大量存在于碱性体系中。研究还发现,在反应体系pH 6.0 时,[Pd(en)Cl2]与5′-dGMP 反应在12 h内完成。本研究建立的基于HPLC-ICP-MS 分离乙二胺二氯合Pd[Pd(en)Cl2]与5′-dGMP 反应产物的方法未见报道,本方法经改进,可用于其它Pd(Ⅱ)抗癌药物的形态分析。
2 实验部分
2.1 仪器与试剂
ESI-MS 为TSQ QUANTUM ACCESS MAX 串联质谱仪、X-7 电感耦合等离子体质谱及其工作站(美国,Thermal 公司);色谱与ICP-MS 用Peek 管相连,电子触发采集数据;OriginPro 7.0 绘图软件;LC-20AB 液相色谱仪(日本岛津公司),配备二极管阵列检测器(DAD),色谱柱为Acclaim PA2 C18柱(250 mm×4.6 μm,美国戴安公司)。
99%乙二胺二氯合Pd 和鸟嘌呤脱氧核糖核苷酸二钠盐(美国Sigma-Aldrich 公司);Na2HPO4、KH2PO4、HCl、NaOH(分析纯,南京化学试剂二厂);娃哈哈纯净水(电阻率大于18 MΩ cm),1000 mg/L Lu 和Pd 单标溶液(美国Spex 公司);HNO3(德国默克公司)。
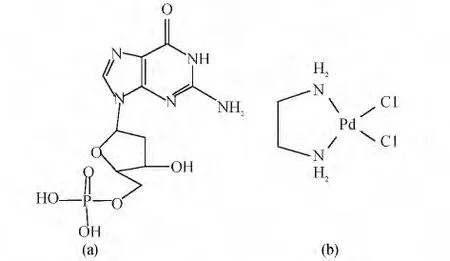
图1 5′-dGMP(a)和[Pd(en)Cl2](b)的结构图Fig.1 Structure of 5′-deoxyguanyli acid (5′-dGMP)(a)and[Pd(en)Cl2](b)
2.2 [Pd(en)Cl2]与5′-dGMP 反应条件
分别称取4.7 mg(0.02 mmol)[Pd(en)Cl2]和7.8 mg 5′-dGMP 二钠盐(0.021 mmol),混合,用水溶解并定容至10 mL,其中5′-dGMP 略过量,用磷酸盐缓冲液和NaOH 分别调节至pH 6.0,8.0,9.0 和10.0,在37 ℃水浴中恒温反应48 h,得到产物的浓溶液,色谱进样前适当稀释。
2.3 ICP-MS 和ESI-MS优化的工作参数
本研究选用丰度最高的106Pd(27.33%)作为测定同位素,HPLC-ICP-MS 联用时基线离子强度小于50 个计数。同心雾化器,雾化室为撞球式雾化室,主要参数经优化后如表1 所示。
利用ESI-MS(MS/MS)研究含Pd 色谱峰的化学结构,需富集色谱流出物至10 mg/L(以Pd 计)以上有较好的响应,且随着离子源挥发气温度和毛细管温度提高信号响应也对应提高,经优化ESI-MS 的主要参数为:正离子模式,喷雾电压3000 V,挥发气温度450 ℃,毛细管温度400℃,鞘气12 L/min,辅助气3 L/min。
2.4 色谱流出物总Pd与进入色谱柱总Pd比例的测定
因没有Pd(en)-5′-dGMP1 和Pd(en)-5′-dGMP2 标准物质,无法通过峰面积积分对反应产物进行定量分析,但可通过收集色谱流出物,然后消解得到流出物中总Pd 含量,并与进样前总Pd 含量进行对比。
将2.2 节中的反应液稀释至含Pd 4.0 mg/L,色谱进样50 μL,收集保留时间2.0 ~4.0 min 的色谱流出物共1.6 mL,加入1 mL HNO3-HCl(1∶3,V/V),密封水浴,100 ℃消解30 min 后冷却,定容至10 mL,ICP-MS测定。ICP-MS 使用10 μg/L Lu 作为在线内标。

表1 电感耦合等离子体质谱条件Table 1 ICP-MS experimental conditions
3 结果与讨论
3.1 HPLC-ICP-MS及HPLC-DAD条件优化
HPLC-ICP-MS 形态分析中常用的流动相缓冲盐中碳酸盐和醋酸盐可能会导致ICP-MS 锥口积碳,所以不采用;而铵盐可能会与Pd 盐络合,也不采用。因此,流动相用磷酸盐缓冲液配制,高浓度缓冲溶液可使峰型对称,但易导致ICP-MS 锥口沉积盐分。实验表明,最佳条件为:25 mmol/L 磷酸盐缓冲液作为流动相,流速0.8 mL/min。流动相pH 值影响[Pd(en)Cl2]与5′-dGMP 反应产物的色谱行为,2.2 节中反应产物(pH 6.0)稀释后,以HPLC-ICP-MS 研究其在不同流动相中行为,结果见图2。
由图2a 可见,主产物Pd(en)-5′-dGMP1 峰拖尾覆盖了另一产物Pd(en)-5′-dGMP2,因此纯水不适合作为流动相。由图2b ~2e 可见,随着流动相pH值增大,主产物Pd(en)-5′-dGMP1 的拖尾现象消失;pH 8.0 时,主产物保留时间为2.8 min,且Pd(en)-5′-dGMP2 保留时间为3.2 min,峰型良好;虽然pH 9.0 时Pd(en)-5′-dGMP2 峰型更好,但碱性过强,柱压升高,易损坏色谱柱。因此,本实验选用25 mmol/L 磷酸盐缓冲液(pH 8.0)作为流动相,[S3]色谱进样定量环为50 μL。[Pd(en)Cl2]在此色谱条件下不出峰。
作对应研究的HPLC-DAD 所采用色谱条件与HPLC-ICP-MS 条件相同。DAD 检测器波长为200 ~350 nm,分辨率1 nm。
3.2 [Pd(en)Cl2]与5′-dGMP 在不同pH 值下反应产物
按照2.2 节的方法控制体系pH 6.0,8.0,9.0,10.0,反应48 h 后,将溶液稀释使总Pd 含量为40 μg/L 进HPLC-ICP-MS 分析,结果如图3 所示。同时,将2.2 节得到的反应液稀释至含Pd 4.0 mg/L,按照2.4 节方法测定色谱流出的总Pd 和进样前样品的总Pd,得出比值。由图3 可见,随着反应体系pH 值的增加,Pd(en)-5′-dGMP1 浓度降低,Pd(en)-5′-dGMP2 在pH 6.0 ~9.0 之间浓度上升,但在pH 10.0 时却降低,说明Pd(en)-5′-GMP1 易在酸性条件下生成,而Pd(en)-5′-dGMP2 易在碱性条件下生成,与文献[11,13]的研究结果不同,[Pd(en)Cl2]与5′-dGMP在碱性条件下反应产物中始终存在Pd(en)-5′-dGMP1,这是5′-dGMP 比5′-GMP 少一个羟基导致。

图2 反应稀释液,以Pd 计含量60 μg/L 的HPLC-ICPMS 图谱Fig.2 HPLC-ICP-MS chromatogram of reaction diluent(containing 60 μg/L Pd)
由图3 计算得出,随着pH 值增大,Pd(en)-5′-dGMP1 与Pd(en)-5′-dGMP2 色谱峰面积之和降低,说明色谱流出的Pd 含量降低。为了定量研究这一过程,用2.4 节方法以ICP-MS 直接测定色谱流出物总Pd 和进样前总Pd 含量,得出比值分别96%(pH 6.0)、92% (pH 8.0)、81% (pH 9.0)、43%(pH 10.0)。说明随着pH 值升高,导致体系生成这两种产物的比例降低。
3.3 反应体系pH 6.0 Pd(en)-5′-dGMP1生成速度研究
由图4a 和3.1 节得出,在pH 6.0 时,[Pd(en)Cl2]与5′-dGMP 反应产物多为Pd(en)-5′-dGMP1,因此,在此条件下研究Pd(en)-5′-dGMP1 的反应速度较易行,通过测定反应时间和Pd(en)-5′-dGMP1 峰高的关系得出反应完成度(图4)。由图4 可见,pH 6.0 条件下反应生成的Pd(en)-5′-dGMP1 在12 h 后即稳定。
3.4 Pd(en)-5′-dGMP1 和Pd(en)-5′-dGMP2定性研究
取pH 9.0 的反应液稀释至总Pd 含量6.0 mg/L,进HPLC-DAD 研究色谱行为和紫外吸收。

图3 不同pH 值反应稀释液中的HPLC-ICP-MS 图谱(以Pd 计含量40 μg/L)Fig.3 HPLC-ICP-MS chromatogram of reaction diluent with different pH value (containing 40 μg/L Pd)
由图5 可见,Pd(en)-5′-dGMP1 和Pd(en)-5′-dGMP2 紫外吸收光谱相同,说明这两种物质由有高度的相似性,再由图5a 与图2c 两种物质峰高比对应说明这两种产物分子中Pd 百分比相同,进一步印证两者相似。综合文献[11,13]及图3 和图5,可推断Pd(en)-5′-dGMP1 为5′-dGMP 的N1 位氮与[Pd(en)Cl2]按照摩尔比1∶ 1 反应生成的单体[Pd(en)(N1-5′-dGMP)],而Pd(en)-5′-dGMP2 为Pd(en)-5′-dGMP1 的多聚物。
Pd(en)-5′-dGMP1 分子用ESI-MS(MS/MS)确定。Pd 有5 个同位素,丰度为104Pd(10.97%)、105Pd(22.23%)、106Pd(27.33%)、108Pd(26.71%)和110Pd(11.81%)。因此,在质谱图中,母离子有特征同位素指纹,如图6 所示。

图4 pH 6.0 反应液稀释后经HPLC-ICP-MS 测得的Pd(en)-5′-dGMP1 时间-峰高图,稀释液中总 Pd 200 μg/LFig.4 Peak height-time curve of Pd(en)-5′-dGMP1 under reaction pH 6.0,acquired by HPLC-ICP-MS diluent containing 200 μg/L Pd

图5 pH 9.0 反应稀释液以Pd 计含量6 mg/L 的HPLC-DAD 图谱及Pd(en)-5′-dGMP1、Pd(en)-5′-dGMP2 的紫外吸收光谱(a)HPLC 图谱,(b)t =2.8 min Pd(en)-5′-dGMP1 紫外吸收光谱,(c)t =3.2 min Pd(en)-5′-dGMP2 紫外吸收光谱,(d)t=7.3 min 游离的5′-dGMP 紫外吸收光谱Fig.5 HPLC-DAD study of Pd(en)-5′-dGMP1 and Pd(en)-5′-dGMP2 under reaction pH 9.0,(a)HPLC chromatography,(b)t=2.8 min Pd(en)-5′-dGMP1 UV spectrum,(c)t =3.2 min Pd(en)-5′-dGMP2 UV spectrum,(d)t=7.3 min 5′-dGMP UV spectrum
图6 中m/z 510,511,512,514 和516 对应Pd(en)-5′-dGMP1 的[M+1]+碎片,质谱图丰度比近似对应Pd 同位素丰度比,说明Pd(en)-5′-dGMP1中只含有1 个Pd 原子,证明该分子是单体,验证了图4 的推论。对m/z 511,512,514 进行MS/MS 分析,分别得到m/z(315 和152)、(316 和152)、(318和152)的主要碎片。解析Pd(en)-5′-dGMP1 结构,m/z 315,316,318 [M +1]+碎片及m/z 152[M +1]+碎片如图7 所示。
由图7a 可见,Pd(en)-5′-dGMP1 分子结构为[Pd(en)(N1-5′-dGMP)],其中PO3-4的负电荷和Pd原子的正电荷使分子呈电中性,而原与Pd 连接的Cl(或者水解生成的H2O)在质谱高能过程中丢失。MS/MS 分析时磷酸脱氧核糖从[Pd(en)(N1-5′-dGMP)]分子上解离得到m/z 315,316 和318 的[M+1]+同位素碎片,同位素碎片进一步解离得到鸟嘌呤。图7b 和图7c 两个碎片印证了图7a 分子结构的正确性。本实验尝试对Pd(en)-5′-dGMP2 进行结构定性,但即使富集到150 mg/L 总Pd,也无明显质谱信号,这可能是由于形成聚合物后所需的离子源挥发气温度和毛细管温度超出仪器允许范围。

图6 Pd(en)-5′-dGMP1 的ESI-MS 质谱图Fig.6 ESI-MS spectrum of Pd(en)-5′-dGMP1
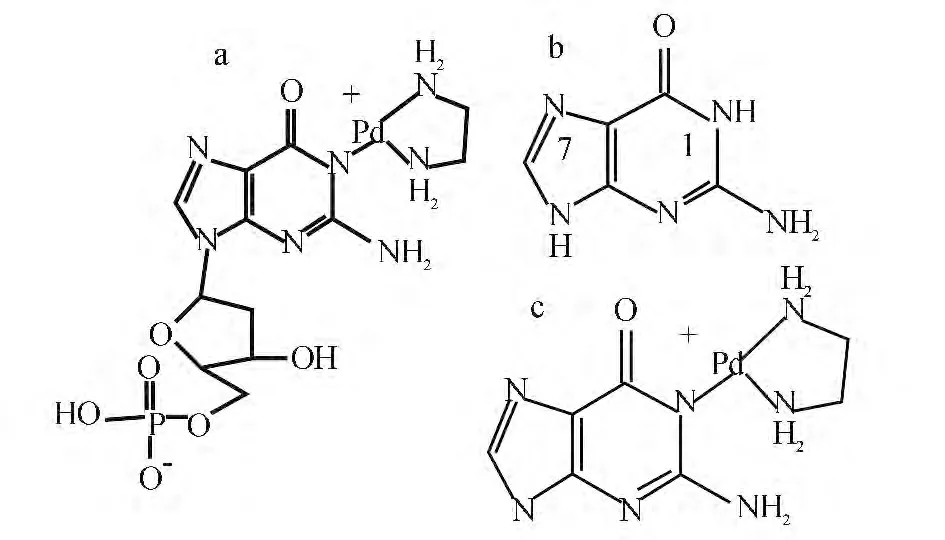
图7 ESI-MS 得出的Pd(en)-5′-dGMP1 分子结构及其碎片Fig.7 Structure of Pd(en)-5′-dGMP1 and its fragments derived by ESI-MS
1 Puthraya K H,Srivastava T S,Amonkar A J,Chitnis M P.J.Inorg.Biochem.,1985,25:207 -212
2 Tusek-Bozic L,Furlani A,Scarcia V,Clercq E D.J.Inorg.Biochem.,1998,72:201 -210
3 Kuduk-Jaworska J,Puszko A,Kubiak M,Pelczynska M.J.Inorg.Biochem.,2004,98:1447 -1456
4 Hunter T M,Paisey S L,Park H,Cleghorn L,Parkin A,Parsons S,Sadler P J.J.Inorg.Biochem.,2004,98:713 -719
5 Sar D G,Montes-Bayon M,Gonzalez E B,Sierra L M,Aguado L,Comendador M A,Koellensperger G,Hann S,Sanz-Medel A.Anal.Chem.,2009,81(23):9553 -9560
6 Chiavarino B,Crestoni M E,Fornarini S,Scuderi D,Salpin J.J.Am.Chem.Soc.,2013,135:1445 -1455
7 Corduneanu O,Chiorcea-Paquim A,Garnett M,Oliveira-Brett A M.Talanta,2009,77:1843 -1853
8 Vieites M,Smircich P,Pagano M,Otero L,Fischer F L,Terenzi H,Prieto M J,Moreno V,Garat B,Gambino D.J.Inorg.Biochem.,2011,105:1704 -1711
9 Sonmez M,Celebi M,Yardim Y,Senturk Z.Eur.J.Med.Chem.,2010,45:4215 -4220
10 Mukherjee T,Sen B,Zangrando E,Hundal G,Chattopadhyay B,Chattopadhyay P.Inorg.Chim.Acta,2013,406:176 -183
11 Zhu S R,Matilla A,Tercero J M,Vijayaragavan V,Walmsley J A.Inorg.Chim.Acta,2004,357:411 -420
12 Zhang D D,Zhou L X.Comput.Theor.Chem.,2011,967:102 -112
13 Wirth W,Baltronat-Blotevogel,Kleinkes U,Sheldrick W S.Inorg.Chim.Acta,2002,339:14 -26
14 LIU Li-Ping,LV Chao,WANG Ying.Journal of Instrumental Analysis,2010,29(8):767 -771
刘丽萍,吕超,王颖.分析测试学报,2010,29(8):767 -771
15 Nam S H,Oh H J,Min H S,Lee J H.Microchem.J.,2010,95:20 -24
16 JIN Peng-Fei,WU Xue-Jun,ZOU Ding,KUANG Yong-Mei,HU Xin,JIANG Wen-Qing,SUN Chun-Hua.Spectroscopy and Spectral Analysis,2011,31(3):816 -819
金鹏飞,吴学军,邹定,邝咏梅,胡欣,姜文清,孙春华.光谱学与光谱分析,2011,31(3):816 -819
17 Jitaru P,Goenaga-Infante H,Vaslin-Reimann S,Fisicaro P.Anal.Chim.Acta,2010,657:100 -107
18 ZHAO Lei-Chao,WANG Meng,ZHENG Ling-Na,GONG Xin,WANG Bing,FENG Wei-Yue,LIANG Jin-Sheng.Chinese J.Anal Chem.,2012,40(8):1289 -1292
赵磊超,王萌,郑令娜,宫锌,汪冰,丰伟悦,梁金生.分析化学,2012,40(8):1289 -1292
19 LIU De-Ye,ZHU Chun,MA Yong-Jian,JI Wen-Liang,LIU Hua-Liang.Chinese Journal of Analysis Laboratory,2012,31(7):75 -79
刘德晔,朱醇,马永建,吉文亮,刘华良.分析试验室,2013,31(7):75 -79
20 LIU De-Ye,HAO Yuan-Bin,HAN Wen-Ru,LI Jian,HUO Zong-Li,LIU Hua-Liang.Chinese J.Anal.Chem.,2014,42(11):1667 -1672
刘德晔,郝元斌,韩文儒,李健,霍宗利,刘华良.分析化学,2014,42(11):1667 -1672
