河豚鱼皮胶原寡肽制备工艺的优化
2015-06-05郭洪辉张怡评陈思谨李黄庭
郭洪辉,洪 专,张怡评,陈思谨,李黄庭
(国家海洋局第三海洋研究所,国家海洋局海洋生物资源综合利用工程技术研究中心,福建厦门 361005)
河豚鱼皮胶原寡肽制备工艺的优化
郭洪辉,洪 专*,张怡评,陈思谨,李黄庭
(国家海洋局第三海洋研究所,国家海洋局海洋生物资源综合利用工程技术研究中心,福建厦门 361005)
研究以无毒河豚鱼皮作为原料,采用两步酶解法制备胶原寡肽的最佳工艺。以水解度和分子量为指标,通过单因素和正交实验优化工艺条件。实验结果表明,第一步最佳用酶为鱼鳞鱼皮胶原蛋白水解专用酶或胰蛋白酶,第二步最佳用酶为酸性蛋白酶。酸性蛋白酶的最佳酶解条件为:投酶量2%,pH4.5,温度50℃,水解时间8h。制备得到的河豚鱼皮胶原寡肽分子量分布主要集中在100~600u。冻干样品的胶原肽含量为94.0%,灰分为0.71%,水分为5.2%。
鱼皮,胶原寡肽,水解度,正交实验
河豚鱼(puffer fish),又名气泡鱼,味道鲜美却又剧毒。野生河豚鱼中含有的剧毒物质河豚鱼毒素,具有极高的经济价值和医疗价值[1]。上世纪90年代初,由于野生河豚产量剧减,远远满足不了市场需求,很多地方对其开展了人工养殖。经过近20年的发展,我国养殖技术逐步成熟,养殖的河豚鱼大多数已达到无毒级,目前我国无毒河豚鱼已成为国外河豚鱼供给的主要来源。河豚鱼的出口加工产生了大量的鱼皮等下脚料,仅被用于生产高附加值的鱼粉,造成了极大的资源浪费[2-3]。因此,鱼皮资源的深加工和高值化利用,不仅对水产品加工综合利用有重要意义,而且也能支持和促进养殖生产的发展。
利用河豚鱼皮为原料制备胶原和胶原蛋白肽已有研究[4],但未见以河豚鱼皮为原料制备胶原寡肽的研究报道。胶原寡肽是由2~12个氨基酸组成的肽,分子量小于1000u[5],具有许多重要的生理功能如:抑制ACE[6-7]、提高免疫性等[8-9]、促进皮肤胶原代谢[10]、预防骨质疏松、抗肿瘤[11]等。本文以河豚鱼皮作为原料,先用酸碱进行预处理,再用两步酶法制备鱼皮胶原寡肽,利用单因素和正交实验优化工艺条件,为规模化生产提供了理论依据。
1 材料与方法
lactic acid production by pellet-formRhizopusoryzaeR1021 in a stirred tank fermentor[J]. Chemical Engineering Science,2003,58(3-6):785 - 791.
[18]C D Skory. Lactic acid production byRhizopusoryzaetransformants with modified lactate dehydrogenase activity[J].Applied Microbiology and Biotechnology,2004,64(2):237-242.
1.1 材料与仪器
河豚鱼皮 购于福建漳州水产品加工厂;Superdex peptide 10/300GL凝胶分析柱 美国GE公司;氢氧化钠、盐酸 广州西陇化工有限公司;胃蛋白酶(4000 U/g),胰蛋白酶(4000 U/g),菠萝蛋白酶(105U/g),木瓜蛋白酶(2×106U/g),碱性蛋白酶(105U/g),中性蛋白酶(105U/g),风味酶(104U/g),海产品水解专用酶(105U/g),鱼鳞鱼皮胶原蛋白,水解专用酶(105U/g),酸性蛋白酶(104U/g) 南宁庞博生物工程有限公司;蛋白标准物质 美国sigma公司。
30L双层玻璃反应釜、DFY-20L/20低温恒温反应浴 巩义市予华仪器有限责任公司;工业EDI纯水机 杭州华麒水处理设备厂;Milli-Q超纯水纯化系统 美国millipore公司;管式离心机 上海浦东天本离心机有限公司;SG2便携式pH计 梅特勒-托利多仪器上海有限公司;ICS3000离子色谱仪 戴安中国有限公司;AKTA全自动蛋白层析系统 美国GE公司;Epsilon 2-6D冻干机 德国Christ公司。
1.2 实验方法
1.2.1 河豚鱼皮胶原寡肽的制备 5 kg河豚鱼皮,依次采用六倍体积的0.2% NaOH和0.3%H2SO4水溶液处理,洗至中性,加入5L纯水,60℃恒温加热搅拌提取2h后,冷却至室温,以管式离心机过滤除渣,得到30L河豚鱼皮的胶原提取液[12]。
1.2.2 一次酶解 分别选用十种常用的蛋白酶(胃蛋白酶,胰蛋白酶,菠萝蛋白酶,木瓜蛋白酶,碱性蛋白酶,中性蛋白酶,风味酶,海产品水解专用酶,鱼鳞鱼皮胶原蛋白水解专用酶,酸性蛋白酶)加入到河豚鱼皮胶原提取液中进行一次酶解。按表1调节适合不同酶反应的温度和pH,加入等酶活的蛋白酶,进行酶解,反应时间为6h。反应结束后,加热灭酶活,离心后即得一次酶解液。
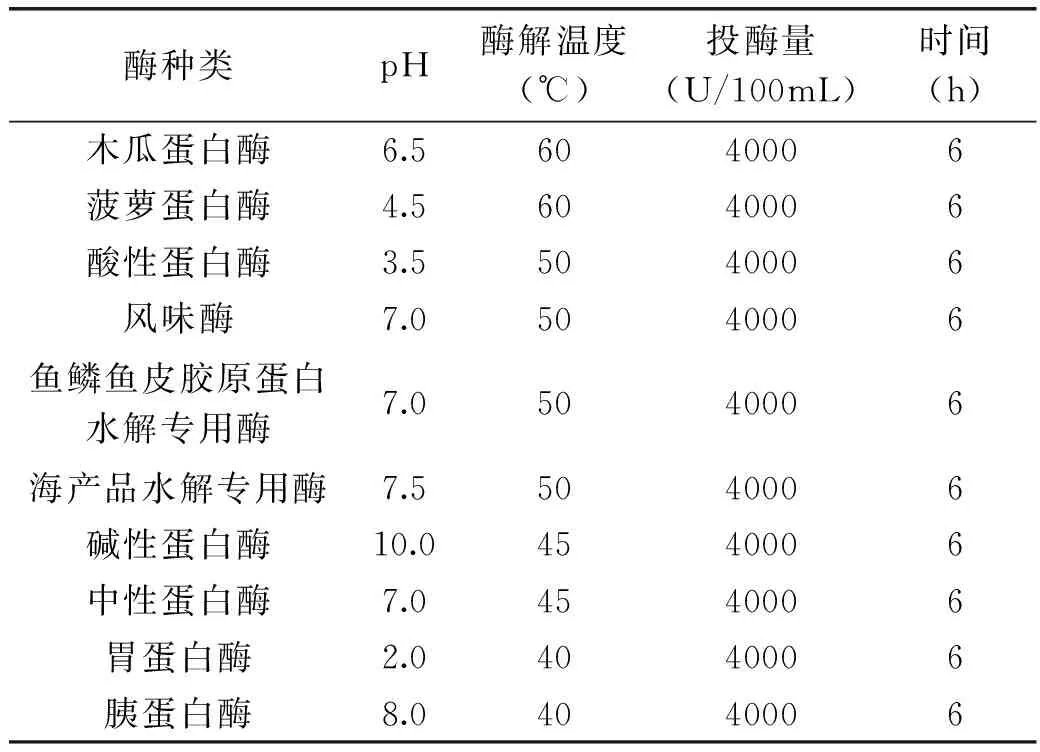
表1 不同蛋白酶的酶解反应条件[13]Table 1 Conditions for specific protease enzymatic reaction[13]
1.2.3 二次酶解 选用除了第一步水解用酶的其它九种蛋白酶,对一次酶解液进行再次酶解。具体方法同1.2.2。
1.2.4 二次酶解单因素实验 考察蛋白酶不同投酶量、酶解时间、酶解pH、温度等因素对水解度的影响。
1.2.5 二次酶解正交实验 在单因素实验的基础上,进行投酶量、酶解时间、酶解pH、温度等四因素三水平的正交实验,以确定最佳工艺。
1.2.6 胶原肽分子量的测定 采用AKTA全自动蛋白层析系统对胶原肽的分子量分布进行测定,检测条件为:色谱柱Superdex 200 10/300 GL;流动相:50mmol/L磷酸盐、0.15mol/L氯化钠、pH7.0的缓冲液;流速:0.5mL/min,检测波长:214nm;进样量:50μL。标准蛋白分别为:Cytochrome C(Mr=12384)、Aprotinin(Mr=6512)、Bacitracin A(Mr=1423)、(Gly)3(Mr=189)、Gly(Mr=75)。
1.2.7 胶原寡肽冻干粉基本成分的测定 取1000mL河豚鱼皮胶原寡肽提取液,冻干成固体,测定其基本成分。
胶原肽含量的测定:采用离子色谱法以羟脯氨酸的含量进行表征[14]。灰分的测定:GB 5009.4-2003。水分的测定:GB/T 5009.3-2003。
1.2.8 水解度的测定 采用甲醛法测定水解度[15]。取5 mL二次酶解液于小烧杯中,加入60 mL去二氧化碳水,用磁力搅拌器搅拌,用精密pH计指示其pH。配取0.1 mol/L标准NaOH溶液滴定至pH8.2,加入已中和(pH7.0)的甲醛溶液20 mL,记录将其溶液pH滴定至9.2时所消耗的0.1 mol/L标准NaOH溶液的体积。
式中:VNaOH:消耗的NaOH体积(mL);CNaOH:所滴定的NaOH浓度(mol/L);V样品:样品体积(mL)。
2 结果与讨论
2.1 标准蛋白的分子量分布
图1为五种标准蛋白的分子量分布,按照出峰顺序,从左到右依次为Cytochrome C(Mr=12384)、Aprotinin(Mr=6512)、Bacitracin A(Mr=1423)、(Gly)3(Mr=189)、Gly(Mr=75)。各标准蛋白分子量的对数值对洗脱体积做标准曲线,得到回归方程:lgMr=-0.246v+6.6697(R2=0.9959),式中v为洗脱体积,Mr为分子量。通过洗脱体积可以计算出胶原寡肽的分子量分布。
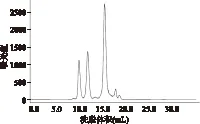
图1 标准蛋白的分子量分布Fig.1 Molecular weight distribution of standard proteins

表2 不同蛋白酶的水解度Table 2 Hydrolysis degree of specific protease
2.2 一次酶解
本实验选用了十种常见的蛋白酶分别加入到30L的河豚鱼皮胶原提取液中进行水解实验,酶解结果如表2所示。结果表明,鱼鳞鱼皮胶原蛋白水解专用酶和胰蛋白酶的水解效果最佳。其水解胶原多肽的分子量分布如图2所示。根据洗脱体积可以计算出胶原多肽的分子量分布,实验结果表明两种蛋白酶的酶解液,胶原多肽的分子量分布基本相近,分子量范围是在100~5000u。在实验过程中,酶解条件的优化对水解液中胶原多肽的分子量范围影响并不明显,因此,要获得分子量小于1000u的胶原寡肽还需进行第二步酶解。在后续的实验中,主要采用胰酶的一次酶解液进行再次酶解。

图2 经胰酶和鱼鳞鱼皮胶原蛋白水解专用酶酶解的 河豚鱼皮胶原多肽的分子量分布图Fig.2 Molecular weight distribution of collagen peptide from puffer fish skin hydrolyzed by trypsin or fish scale collagen hydrolysis special enzyme
2.3 二次酶解实验条件优化
根据表1的实验条件,选择除了第一步水解用酶的其它九种蛋白酶进行二次酶解。实验结果表明,酸性蛋白酶的水解效果最佳,其水解胶原肽的分子量均小于1000u。因而选用酸性蛋白酶进行二次酶解,并对其酶解条件作了进一步的优化。
2.3.1 酶解时间的影响 在pH3.5,加酶量1%(m/v),酶解温度为50℃的酶解条件下,用酸性蛋白酶进行二次酶解,不同反应时间对水解度的影响如图3所示。结果表明,酸性蛋白酶在反应初期的2h内,活性较高,水解度迅速上升,而后继续水解,虽然仍有所上升,但是上升幅度较小。当酶解时间为6h后,酶解反应达到平衡状态,水解度变化缓慢,这可能是因为在水解过程中,酶切位点逐渐减小,小分子寡肽已基本溶出。因此考虑到时间成本,选择酶解时间为6h。
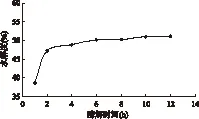
图3 不同酶解时间对水解度的影响Fig.3 Effect of different hydrolysis time on hydrolysis degree
2.3.2 酶解pH的影响 由图4可知,酶解pH在3.0~5.0时,水解度随着pH的增加而增大,当pH达到5.0时,水解度达到最大值,而当酶解pH大于5.0时,水解度又逐渐呈现下降趋势。这说明pH5.0时,能最大限度地发挥酸性蛋白酶的酶活,因此确定最佳酶解pH为5.0。

图4 不同pH对水解度的影响Fig.4 Effect of different pH value on hydrolysis degree
2.3.3 酶解温度的影响 不同温度对水解度的影响如图5所示。酸性蛋白酶在30~60℃的酶解温度范围内,都具有较强的活性。从图上可以看出,当酶解温度为50℃时,酸性蛋白酶的水解效果最佳,因此最适酶解温度为50℃。
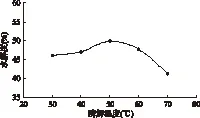
图5 不同温度对水解度的影响Fig.5 Effect of different temperature on hydrolysis degree
2.3.4 投酶量对的影响 由图6可知,当酸性蛋白酶投酶量在0.2%~2%浓度范围时,水解度随着酶添加量的升高而迅速增大,这是由于在酶解反应初期,酸性蛋白酶作用于酶切位点,使得寡肽逐渐释放出来。但是,当继续增加投酶量,水解度的增幅缓慢。考虑到生产成本,确定较适宜的酶添加量为2%。
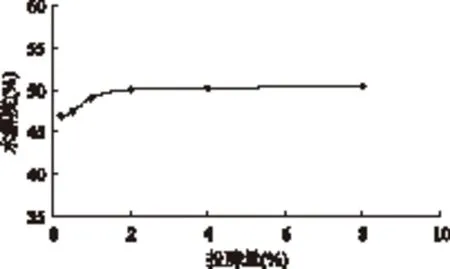
图6 不同投酶量对水解度的影响Fig.6 Effect of different enzyme concentration on hydrolysis degree
2.3.5 正交实验 酸性蛋白酶的正交实验结果见表3。实验结果表明,水解度影响最大的是投酶量(C),然后依次是酶解时间(A)、酶解pH(B)、酶解温度(D)。综上结果,采用酸性蛋白酶进行二次酶解的最佳工艺为A3B2C2D2,即酸性蛋白酶酶解时间8h,酶解pH4.5,投酶量2%,酶解温度50℃。
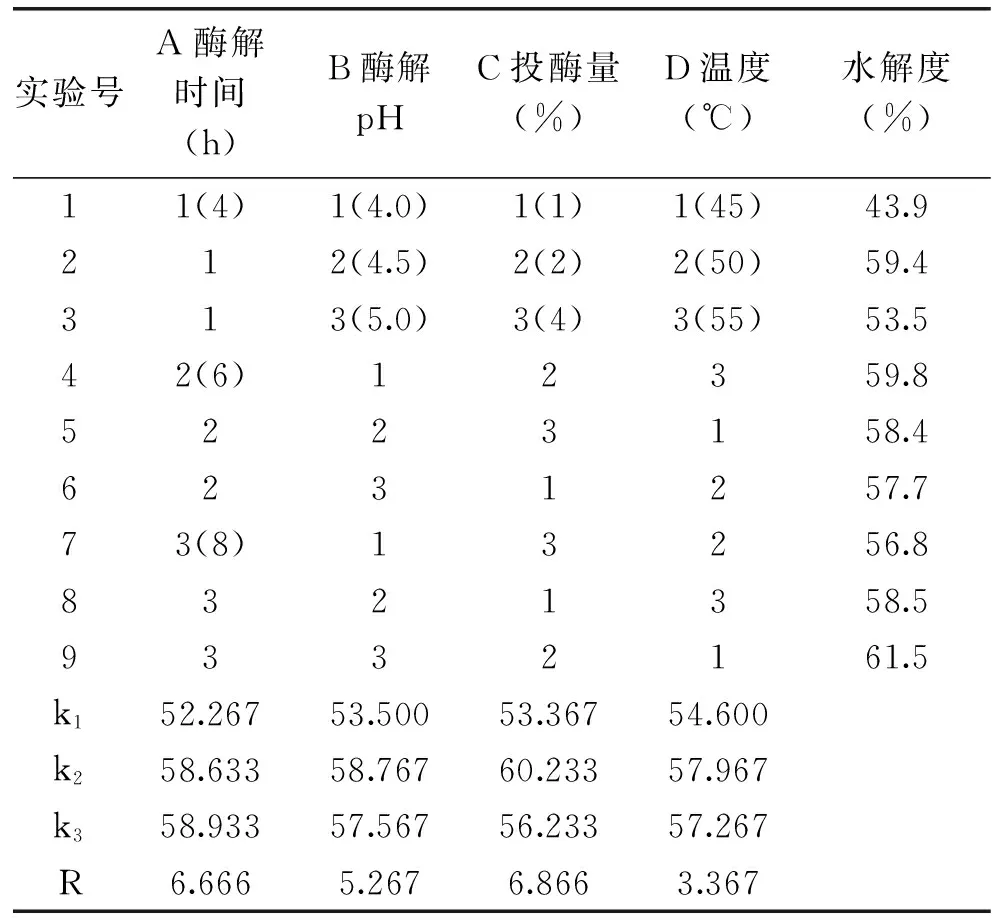
表3 酸性蛋白酶酶解正交实验结果Table 3 Results of orthogonal test
采用正交实验最优组合进行胶原蛋白二次水解,水解度为62%,所得胶原寡肽分子量分布均在1000u的范围内,分子量分布较为集中,主要为100~600u,如图7所示。经测定,胶原寡肽冻干样品的胶原肽含量为94.0%,灰分为0.71%,水分为5.2%。
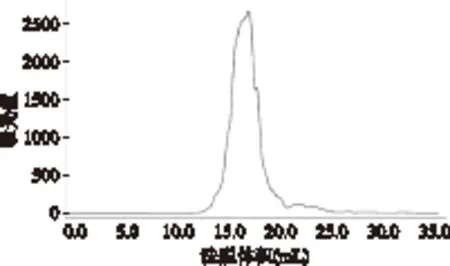
图7 鱼皮胶原寡肽的分子量分布图Fig.7 Molecular weight distribution of collagen oligopeptide from puffer fish skin
3 结论
本实验以河豚鱼皮作为原料,先用酸碱进行预处理后进行提取,获得到河豚鱼皮明胶,再从十种常用的蛋白酶中选取鱼鳞鱼皮胶原蛋白水解专用酶、海产品水解专用酶或胰蛋白酶进行一次酶解,酶解得到的河豚鱼皮胶原多肽分子量范围是在100~5000u。最后采用酸性蛋白酶进行二次酶解,并通过单因素实验和正交实验优化酶解工艺条件,确定最佳工艺条件为酸性蛋白酶投酶量2%,酶解时间8h,酶解pH4.5,酶解温度50℃,制备得到的河豚鱼皮胶原寡肽分子量分布主要集中在100~600u。本研究以水产加工业产生的大量河豚鱼皮副产物作为原料制备胶原寡肽,实现了资源的高值化利用,可为今后的规模化生产提供了理论依据。
[1]陶宁萍,龚玺,刘源,等.三种养殖河豚鱼肌肉营养成分分析及评价[J].营养学报,2011,33:92-94.
[2]任俊凤,任婷婷,朱蓓薇.河豚鱼皮胶原蛋白肽的提取及其抗氧化活性的研究[J].中国食品学报,2009,9:77-83.
[3]宋芹,颜军,郭晓强,等.酶法制取罗非鱼鱼鳞胶原蛋白寡肽的工艺[J].食品研究与开发,2011,32:39-43.
[4]张怡评,谢荣伟,孙继鹏,等.河豚鱼皮明胶提取工艺研究[J].福建水产,2011,33:5-8.
[5]宋芹,陈封政,颜军,等.一种胶原蛋白寡肽促进皮肤胶原蛋白与透明质酸合成的研究[J].食品工业科技,2013,34:105-107.
[6]Hee-Guk Byun,Se-Kwon Kim. Purification and characterization of angiotensin converting enzyme(ACE)inhibitory peptides from Alaska Pollack(Theragrachalcogramma)skin[J]. Process Biochemistry,2001,36:1155-1162.
[7]A Fahmia,S Morimuraa,H C Guo,etal. Production of angiotensin Ⅰconverting enzyme inhibitory peptides from sea bream scales[J]. Process Biochemistry,2004,(39):1195-1200.
[8]贾建萍,周彦钢,鲁健章,等.三文鱼皮胶原肽的制备及其抗氧化活性的研究[J].中国食品学报,2010,10:94-99.
[9]Yang R Y,Zhang Z F,Pei X R,etal. Immunomodulatory effects of marine oligopeptide preparation from Chum Salmon(Oncorhynchus keta)in mice[J]. Food Chemistry,2009,113:464-470.
[10]韩凤杰,赵征.酶法制取比目鱼皮胶原蛋白寡肽[J].食品研究与开发,2006,27:104-107.
[11]Takeshi Nagaia,Nobutaka Suzukib. Isolation of collagen from fish waste material-skin,bone and fins[J]. Process Biochemistry,2000,(68):277-281.
[12]张怡评,谢荣伟,孙继鹏,等.河豚鱼皮明胶提取工艺研究[J].福建水产,2011,33:5-8.
[13]刘颖.鱼鳞ACE抑制肽的研究[D]. 厦门:厦门大学,2012.
[14]张怡评,易瑞灶,陈晖,等.离子色谱法测定鱼鳞胶原蛋白中羟脯氨酸含量方法的研究[J].中国海洋药物,2011,30(4):45-48.
[15]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,11:65-67.
Optimization of preparation process of collagen oligopeptide from puffer fish skin
GUO Hong-hui,HONG Zhuan*,ZHANG Yi-ping,CHEN Si-jin,LI Huang-ting
(Third Institute of Oceanography State Oceanic Administration,Xiamen 361005,China)
The best preparation process of collagen oligopeptide from puffer fish skin by two-step enzymatic hydrolysis was studied. Taking hydrolysis degree and molecular weight as indices,the hydrolysis conditions were optimized by the single factor experiments and orthogonal tests. The results showed that the first-step optimal enzyme was fish scale collagen hydrolysis special enzyme or trypsin and the second-step optimal enzyme was acid protease. The optimal hydrolysis conditions of acid protease were found to be reaction at 50℃ and pH of 4.5 for 8h with protease concentration of 2%.The molecular weight of prepared collagen oligopeptide ranged from 100u to 600u. The collagen peptide,ash and water content of the lyophilized sample was respectively 94.0%,0.71%,and 5.2%.
fish skin;collagen oligopeptide;hydrolysis degree;orthogonal test
2014-04-08
郭洪辉(1982-),女,博士,助理研究员,主要从事海洋生物资源综合利用研究。
*通讯作者:洪专(1970-),男,硕士,教授级高工,主要从事海洋生物毒素、海洋生物蛋白、海洋生物多糖、海洋脂类物质等领域的应用基础研究与开发、中试和研究成果工程化转化研究,以及海洋生物活性天然产物国家标准样品研发。
国家海洋局第三海洋研究所基本科研业务费专项资金项目(海三科2013029);厦门海洋研究开发院共建项目(2014);海洋公益性行业科研专项(201205022-8);海洋生物产业化中试技术研发公共服务平台(12PZP001SF10);国家青年科学基金(41106149)。
TS254.1
B
1002-0306(2015)01-0198-04
10.13386/j.issn1002-0306.2015.01.032
