苹果疏除幼果与成熟果多糖成分分析及抗氧化活性研究
2015-06-05郭玉蓉陈玮琦张晓瑞
窦 姣,郭玉蓉,李 洁,陈玮琦,张晓瑞
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
苹果疏除幼果与成熟果多糖成分分析及抗氧化活性研究
窦 姣,郭玉蓉*,李 洁,陈玮琦,张晓瑞
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)

苹果疏除幼果,成熟果,多糖,单糖组成,抗氧化
多糖又称多聚糖(polysaccharides),由10个以上单糖残基通过糖苷键连接而成,广泛存在于植物、动物和微生物中[1-2]。研究发现多糖及其复合物分子可以参与调节许多生命现象,同时具有抗氧化、抗肿瘤、降血脂、降血糖等多种功效。随着对多糖生物活性研究的深入及其在医药领域的广泛应用,消费者对多糖的需求将会越来越大[3-4]。苹果多糖是植物多糖的重要种类之一,目前对苹果多糖的研究主要集中在利用苹果加工的主要副产物苹果渣进行提取[5],而对于没有食用价值的苹果疏除幼果中提取多糖尚未见报道。
我国已成为世界最大的苹果生产国,2012年苹果种植面积约为3330万亩,面积和产量分别占全球的一半以上。疏花疏果是苹果生产环节必须进行的操作,生产中以疏果为主,每亩地约疏除50公斤苹果幼果,总量达166万吨。苹果幼果营养价值丰富,农药残留少(果农一般在疏果前不喷农药),其中多酚含量是成熟果实的10倍[6],同时还含有丰富的多糖、维生素、矿物质等多种功能成分,是一种可资源化利用且附加值较高的植物资源。
本研究主要是从苹果疏果期的幼果及成熟期果实榨汁后的果渣中分别提取多糖,并对苹果幼果多糖(TYAP)和成熟果多糖(MAP)的单糖组成及抗氧化活性进行比较研究,以期开发新的多糖提取植物资源,并为苹果多糖的进一步研究拓宽了思路。
1 材料与方法
1.1 材料与仪器
实验选择陕西省咸阳市礼泉县苹果综合实验站10年生“长富2号”苹果树,苹果幼果采自盛花期后第30天同一产地疏除的幼果,单果平均重量5g;成熟果果渣:由陕西师范大学冷破碎制汁生产线提供;D-甘露糖(Man)、D-核糖(Rib)、L-鼠李糖(Rha)、D-葡萄糖醛酸(GlcUA)、D-半乳糖醛酸(GalUA)、D-葡萄糖(Glc)、D-木糖(Xyl)、D-半乳糖(Gal)、L-阿拉伯糖(Ara)、D-岩藻糖(Fuc)、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;甲醇、乙腈,均为色谱纯;无水乙醇、苯酚、浓硫酸、邻苯三酚、三羟甲基氨基甲烷(Tris)、三氯乙酸、Na2HPO4、NaH2PO4、硫酸亚铁铵、铁氰化钾、水杨酸、H2O2,均为分析纯。
Shimadzu LC-2010A 高效液相色谱仪 日本岛津公司;LGJ-18C冷冻干燥机 北京四环科学仪器厂;WFJ2100型分光光度计 尤尼科仪器有限公司上海分公司;TU-1810紫外可见分光光度计 北京普析通用仪器厂;PHS-3C精密pH计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 苹果多糖的提取制备 苹果幼果多糖的提取:苹果幼果→切片→漂烫灭酶1min→55℃干燥→粉碎(过60目筛)→70%乙醇脱除多酚(料液比1∶10,重复3次)→热水浸提3次(120min,料液比1∶20,80℃)→上清液浓缩至原体积的1/6→95%乙醇沉淀(4℃,静置过夜)→离心20min(4000r/min)→沉淀物用无水乙醇、丙酮洗涤2次→sevage法除蛋白→溶解沉淀→透析48h→真空冷冻干燥→苹果幼果多糖(TYAP)。
成熟果多糖的提取:以成熟果果渣为原料,55℃干燥后提取,其方法同苹果幼果多糖提取方法,得到成熟果多糖(MAP)。
1.2.2 总糖含量的测定 采用苯酚-硫酸显色法[7]测定苹果幼果与成熟果多糖的总糖含量。
1.2.3 单糖组成分析
1.2.3.1 标准品溶液的制备 精密称取一定量的10种单糖,分别用10%甲醇溶液配成0.1mol/L 的母液。取适量母液稀释为5个不同质量浓度的单糖溶液,参照何念武等[8]的衍生化方法制备标准品溶液。
1.2.3.2 苹果多糖溶液的制备 分别称取20mg TYAP和MAP粉末溶解于装有2.0mL 3.0mol/L TFA溶液的安瓿瓶中并密封,于90℃下水解8h后冷却至室温,4000r/min 离心5min,上清液浓缩蒸干后加1mL超纯水溶解,即得到苹果多糖的水解液[9]。分别取样品溶液100μL,按“1.2.3.1所示方法”制备样品PMP标记物。
1.2.3.3 HPLC色谱条件 色谱柱:Venusil C18柱(250mm × 4.6mm ID,5μm),检测波长为250nm,柱温为35℃,进样量10μL,流速1.0mL/min。流动相A为纯乙腈;B由0.45g KH2PO4、0.5mL TEA、100mL乙腈和900mL超纯水组成(pH7.5)。梯度洗脱条件为:0~5min,99% B;5~15min,99%~95% B;15~30min,95%~90% B;30~45min,90%~70% B。
1.2.4 抗氧化活性分析
1.2.4.1 对·OH的清除能力 应用Feton体系法测定[10-11],依次配制浓度为0.2、0.4、0.6、0.8、1.0mg/mL的TYAP和MAP溶液。分别取1mL各多糖溶液于试管中,依次加入6mmol/L FeSO4溶液1mL,6mmol/L 水杨酸溶液1mL和6mmol/L H2O2溶液1mL,37℃水浴1h,在510nm处测定吸光值。用蒸馏水代替多糖溶液做阴性对照,用蒸馏水代替H2O2溶液做本底对照组。每个处理重复3次,以VC作对照,计算清除率。
清除率(%)=(1-Aj/Ai)×100
式中:Aj为样品管的吸光值;Ai为对照管的吸光值。
清除率(%)=(1-A1/A0)×100
式中:A1为样品管的吸光值;A0为自氧化管的吸光值。
1.2.4.3 对DPPH·的清除能力 分别配制浓度为0.2、0.4、0.6、0.8、1.0mg/mL的TYAP和MAP溶液。移取各浓度的多糖溶液2.0mL于小试管中,分别加入0.2mmol/L的DPPH溶液2.0mL并摇匀,静置40min,以体积分数为50%乙醇溶液作空白调零,在525nm处测定吸光值,每个处理重复三次,以VC作对照,计算清除率。
式中:A0为未加苹果多糖DPPH溶液的吸光值;Ai为加苹果多糖后DPPH溶液的吸光值;Aj为对应多糖溶液自身的吸光值。
1.2.4.4 苹果多糖总还原力的测定 分别配制浓度为0.2、0.4、0.6、0.8、1.0mg/mL的多糖溶液。取1mL多糖溶液,加入2.5mLpH6.6的磷酸盐缓冲液,再加入2.5mL1%的铁氰化钾混匀,50℃水浴20min,立即加入2.5mL10%的TCA终止反应,4000r/min离心10min。取上清液2.5mL于试管中,先加入2.5mL无水乙醇,再加入质量分数0.1%的FeCl3溶液0.5mL,混匀,以蒸馏水作空白调零,以VC作对照,在700nm处测定吸光值[13]。
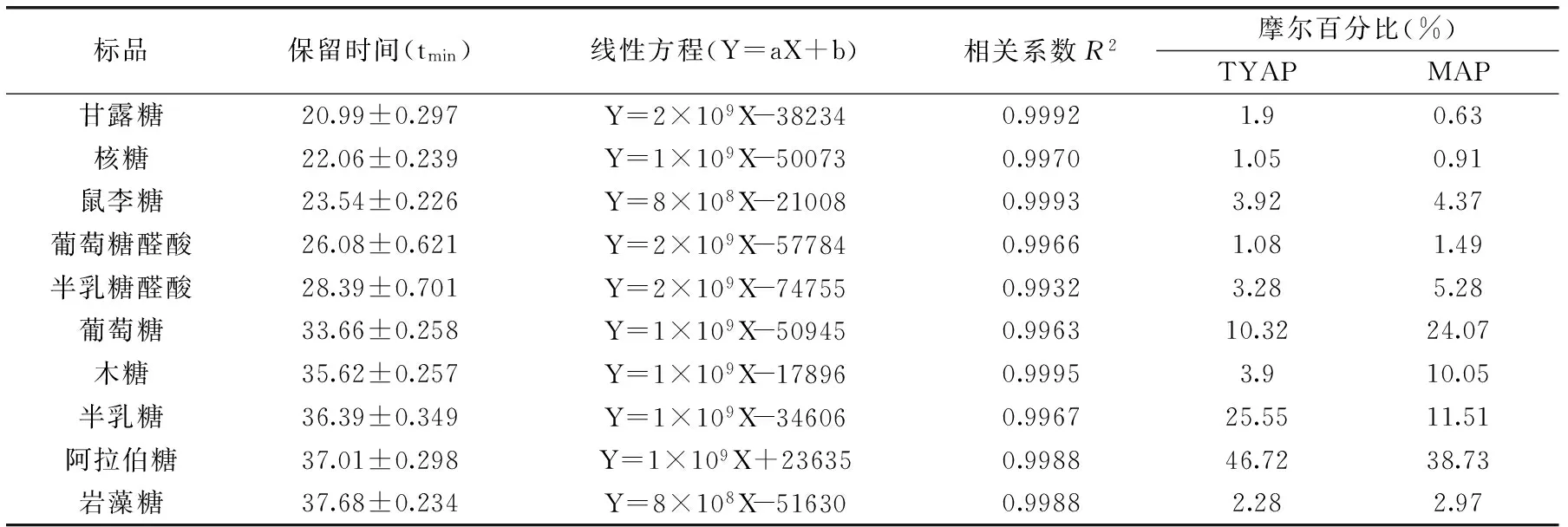
表1 10种单糖标品的HPLC分析结果及TYAP和MAP单糖的摩尔百分比Table 1 The results of 10 standard monosaccharides based on HPLC and the molar ratio of TYAP and MAP
1.2.5 数据处理与统计分析 所有实验均进行3次重复。实验结果采用“DPS 7.05”统计软件进行统计分析,Excel软件绘图制表。不同处理间的数据采用多重比较的方法进行显著性分析,显著水平为 0.05。
2 结果与分析
2.1 YAP和MAP得率及总糖含量的测定
采用热水浸提法分别从苹果幼果与成熟果果渣中提取多糖,可以得出:成熟果果渣中的多糖得率为14.53%,显著(p<0.05)高于苹果幼果中的多糖含量10.40%,苯酚-硫酸显色法可以得出所提取的TYAP与MAP的总糖含量分别为64.43%和65.70%,二者差异不显著。
2.2 YAP和MAP的单糖组成分析
将5个不同浓度的单糖标准品溶液,经PMP 标记后进行HPLC 分析,获得各PMP标记单糖的峰面积。以样品浓度(X)为横坐标,待测PMP 标记单糖的峰面积(Y)为纵坐标,绘制标准曲线,结果见表1。
TYAP和MAP样品的HPLC分析结果见图1。由图1可知,10种单糖标品和样品在40min内均可以保持很好的基线分离,出峰顺序依次为:甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、木糖、半乳糖、阿拉伯糖和岩藻糖。根据各单糖的保留时间可以确定样品的单糖组成,通过峰面积可以计算出各单糖组分的比例[14]。根据HPLC分析结果可以得出:TYAP中各单糖的摩尔百分数分别为1.9%、1.05%、3.92%、1.08%、3.28%、10.32%、3.9%、25.55%、46.72%和2.28%,主要由阿拉伯糖、半乳糖和葡萄糖三种单糖构成,其摩尔百分数可达到82.59%;MAP中各单糖的摩尔百分数依次为:0.63%、0.91%、4.37%、1.49%、5.28%、24.07%、10.05%、11.51%、38.73%和2.97%,阿拉伯糖、葡萄糖、半乳糖和木糖是构成成熟果多糖的主要成分,摩尔百分数可以达到84.37%。
由表1可以得出,TYAP与MAP的主要单糖组成相同,均为:阿拉伯糖、半乳糖和葡萄糖,但单糖比例相差较大,同时,含量较少的其他单糖也因多糖来源不同存在较大的差异[15-17]。所以,TYAP和MAP的单糖组成存在较大差异。
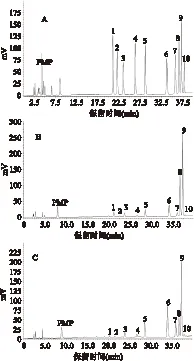
图1 PMP衍生化的HPLC色谱图Fig.1 HPLC chromatograms based on precolumn derivatization with PMP注:A:PMP标记的10种单糖标品的HPLC色谱图; B:PMP标记的TYAP的HPLC色谱图; C:PMP标记的MAP的HPLC色谱图; 1.D-甘露糖(Man);2.D-核糖(Rib);3.L-鼠李糖(Rha); 4.D-葡萄糖醛酸(GlcUA);5.D-半乳糖醛酸(GalUA); 6.D-葡萄糖(Glc);7.D-木糖(Xyl);8.D-半乳糖(Gal); 9.L-阿拉伯糖(Ara);10.D-岩藻糖(Fuc)。
2.3 TYAP和MAP抗氧化活性的比较研究
2.3.1 TYAP和MAP清除·OH能力的比较 TYAP和MAP清除·OH的能力比较见图2。由图2可知:TYAP和MAP均具有清除·OH能力,其清除能力与多糖浓度在一定范围内呈正相关,随着多糖浓度的增加,TYAP对·OH的清除能力由12.29%升高到75.67%,而MAP对·OH的清除能力增加缓慢,仅由5.97%增加到25.04%。在相同浓度水平下,TYAP对·OH的清除能力显著高于MAP,但仍显著低于VC。
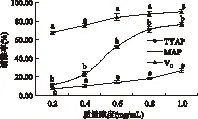
图2 TYAP和MAP清除·OH的能力比较Fig.2 Comparision of the inhibitory capacity to ·OH between TYAP and MAP注:两种多糖抗氧化活性是否存在差异用标记字母法 进行标记,若不存在差异用相同字母表示,存在差异 则用不同字母表示,如图中的a和b等,下同。
2.3.2 TYAP和MAP对DPPH·的清除能力比较 TYAP和MAP清除DPPH·能力的比较见图3。由图3可知,TYAP和MAP对DPPH·的清除能力均随浓度的升高而增大。在相同浓度水平下,MAP清除DPPH·的能力最弱,显著低于TYAP和VC,同时,TYAP对DPPH·的清除能力尽管显著低于VC,但随着浓度的升高其清除能力逐步接近于VC。
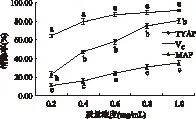
图3 TYAP和MAP清除DPPH·的能力比较Fig.3 Comparision of the inhibitory capacity to DPPH· between TYAP and MAP

图4 TYAP和MAP清除O-2·的能力比较Fig.4 Comparision of the inhibitory capacity to · between TYAP and MAP
2.3.4 TYAP和MAP总还原力的测定 TYAP和MAP的还原力比较见图5。由图5可知,在实验质量浓度范围内,TYAP和MAP还原力测试混合液的OD值与其质量浓度呈现剂量依赖关系,均随质量浓度的升高而增大,但在相同浓度水平下,还原能力依次为:MAP 图5 TYAP和MAP的还原力测定结果比较Fig.5 Comparision of the reducing powers between TYAP and MAP 本实验通过从苹果疏除幼果与成熟果果渣中分别提取多糖类物质,通过HPLC分析发现不同原料所提取的多糖其单糖组成相同,但比例存在较大差异,而且从幼果中提取的多糖类物质对O-2·、DPPH·和·OH的清除能力及还原力均显著高于从成熟果果渣中提取的多糖,分析其原因可能是因为苹果幼果与成熟果处于苹果生长过程的不同时期,在苹果不同的生长时期,果实中多糖类物质的含量及单糖比例必然存在一定的差异[21],而这种差异将不仅表现在多糖的组成和结构等方面,同时也会因多糖结构和构象的变化而表现不同的生物活性,因此,很有必要对不同生长时期的苹果多糖进行单独研究[15]。本研究结果表明,TYAP和MAP的单糖组成相同,但比例存在较大差异,这种差异必然导致其多糖结构的不同,这为两种多糖抗氧化活性的差异奠定了理论基础。Jia Xuejing[22]等人的研究表明:老鹰茶的单糖组成对其抗氧化活性有显著影响,与本实验的研究结果一致。韩苗苗[23]等人对苹果梨疏果与成熟果果渣中果胶的理化特性进行了比较研究,结果表明这种特性差异是由果胶物质的组分差异引起的,因此,可以证明多糖类物质的组分差异对其理化特性及功能活性均会产生影响。同时,苹果幼果处于苹果生长周期的生育期,其多糖对机体的免疫调节、抗病性及抗氧化活性均强于成熟果[24]。 [1]安晓娟,冯琳,宋红平,等. 植物多糖的结构分析及药理活性研究进展[J]. 中国药学杂志,2012,47(16):1271-1275. [2]何余堂,潘孝明. 植物多糖的结构与活性研究进展[J]. 食品科学,2010,31(17):493-496. [3]Ge Y,Duan Y F,Fang G Z,etal. Study on biological activities of physalis alkekengi var francheti polysaccharide[J]. J Sci Food Agric,2009,89(9):1593-1598. [4]Chen S K,Tsai M L,Huang J R,etal.Invitroantioxidant activities of low-molecular-weight polysaccharides with various functional groups[J]. Journal of Agricultural and Food Chemistry,2009,57:2699-2704. [5]Na Y S,Kim W J,Kim S M,etal. Purification,characterization and immunostimulating activity of polysaccharide isolated from capsosiphon fulvescens[J]. International Immunopharmacology,2010,10:364-370. [6]Sun L J,Guo Y R,Fu C C,etal. Simultaneous separation and purification of total polyphenols,chlorogenic acid and phlorizin from thinned young apples[J]. Food Chemistry,2013,136(2):1022-1029. [7]田灵敏,邱雪梅,潘子敬,等. 新型糖组成高效液相色谱分析技术的构建及其在水飞蓟多糖质控中的应用[J]. 药学学报,2010,45(4):498-504. [8]何念武,杨兴斌,田灵敏,等. 黄瓜多糖的体外抗氧化活性[J]. 食品科学,2011,32(19):70-74. [9]杨兴斌,赵燕,周四元,等. 柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J]. 分析化学,2005,33(9):1287-1290. [10]Zou C,Du Y M,Li Y,etal. Preparation of lacquer polysaccharide sulfates and their antioxidant activityinvitro[J]. Carbohydrate Polymers,2008,73:322-331. [11]Sun Z W,Zhang L X,Zhang B,etal. Structural characterisation and antioxidant properties of polysaccharides from the fruiting bodies of Russula virescens[J]. Food Chemistry,2010,118:675-680. [12]王峰,严东,侯杰,等. 绞股蓝多糖的单糖组成分析及其抗氧化活性研究[J]. 食品科技,2013,38(3):183-187. [13]Chen Y,Xie M Y,Nie S P,etal. Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry,2008,107(01):231-241. [14]Yang X B,Yang S,Guo Y R,etal. Compositional characterization of soluble apple polysaccharides,and their antioxidant and hepatoprotective effects on CCl4-caused liver damage in mice[J]. Food Chemistry,2013,138:1256-1264. [15]张汇,鄢嫣,聂少平,等. 黑灵芝不同部位多糖成分分析及抗氧化活性[J]. 食品科学,2011,32(1):56-61. [16]鲍素华,査学强,郝杰,等. 不同分子量铁皮石斛多糖体外抗氧化活性研究[J]. 食品科学,2009,30(21):123-127. [17]包怡红,梁雪,秦蕾,等. 东方伊萨酵母胞外多糖的单糖组成及抗氧化活性分析[J]. 食品与发酵工业,2012,38(4):94-98. [18]宣丽,刘长江. 不同提取方法对软枣猕猴桃多糖单糖组成及抗氧化活性的影响[J]. 天然产物研究与开发,2013,25:1260-1265. [19]罗强,颜亮,吴莉莎. 印度块菌水溶性多糖的单糖组成与抗氧化活性研究[J]. 食品科学,2010,31(23):52-56. [20]Guo S D,Mao W J,Han Y,etal. Structural characteristics and antioxidant activities of the extracellular polysaccharides produced by marine bacterium Edwardsiella tarda[J]. Bioresource Technology,2010,101:4729-4732. [21]赵金伟,李范洙,张先. 苹果梨酚类物质抗氧化活性研究[J]. 食品科学,2010,31(17):170-172. [22]Xue J J,Ding C B,Yuan S,etal. Extraction,purification and characterization of polysaccharides from Hawk tea[J]. Carbohydrate Polymers,2014,99:319-324. [23]韩苗苗,李范洙,朴一龙,等. 苹果梨果胶理化特性的研究[J]. 食品科学,2010,31(17):44-46. [24]韩苗苗. 苹果梨果胶理化特性及生理活性研究[D]. 延吉:延边大学,2010. Composition and antioxidant activity of polysaccharides from thinned-young-apple and matured-apple DOU Jiao,GUO Yu-rong*,LI Jie,CHEN Wei-qi,ZHANG Xiao-rui (Shaanxi Normal University,College of Food Engineering and Nutritional Science,Xi’an 710062,China) thinned-young-apple;matured-apple pomace;polysaccharides;monosaccharide composition;antioxidative activity 2014-03-10 窦姣(1990-),女,硕士研究生,主要从事功能成分开发及利用方面的研究。 *通讯作者:郭玉蓉(1962-),女,博士,教授,主要从事食品生物加工研究。 农业部现代苹果产业技术体系建设专项基金资助(CARS-28)。 TS201.2 A 1002-0306(2015)01-0110-05 10.13386/j.issn1002-0306.2015.01.015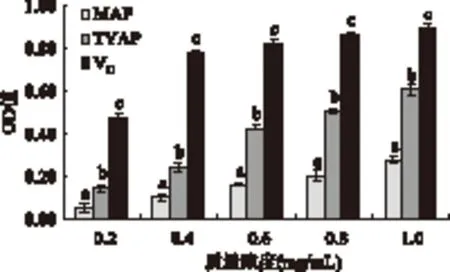
3 结论与讨论


