碱不溶性酵母胞壁多糖苯酚硫酸测定法的研究
2015-06-05周丽明
周丽明,张 勇
(上饶师范学院生命科学学院,江西上饶 334001)
周丽明,张 勇
(上饶师范学院生命科学学院,江西上饶 334001)
为了测定碱不溶性酵母胞壁多糖含量,采用硫酸溶液水解碱不溶性酵母胞壁多糖,苯酚-硫酸法测定水解液的糖含量。通过单因素和正交实验对硫酸溶液水解碱不溶性酵母胞壁多糖的条件进行了优化,优化后的水解条件为:称取碱不溶性酵母胞壁多糖10mg,加入3mol/L H2SO4溶液20mL置于100℃水浴中水解90min。水解液定容至250mL,测定其糖含量。该方法的精密度RSD为0.30%,稳定性RSD为0.67%,重现性RSD为0.29%,样品的平均加标回收率为99.87%,RSD为1.16%,是测定碱不溶性酵母胞壁多糖含量的有效方法。
碱不溶性,酵母胞壁多糖,水解,苯酚-硫酸法
啤酒废酵母是啤酒生产工艺过程中剩下的副产物,主要由大量的死细胞和弱细胞组成[1],每生产100t啤酒,产生约1.5t剩余酵母(含水75~80%)[2]。2012年我国啤酒产量数为4435万t[3],可回收废啤酒酵母60多万吨(湿重)。目前,废啤酒酵母的综合利用集中在酵母细胞的氨基酸、肽、蛋白质资源、酵母抽提物调味品、β-葡聚糖、甘露糖以及活性酶类如超氧化物歧化酶等产品的生产与研究[4]。受到多糖成为食品科学、天然药物、生物化学与生命科学领域中的研究热点[5]的影响,酵母多糖越来越受到科研工作者的重视。研究表明,酵母多糖具有增强免疫[6-9]、抗氧化[10]、抗诱变[11]、抗肿瘤[12]、抗辐射[13]、吸收毒素[14]、降血脂[15-16]等生物功能;在肉制品生产中可替代部分脂肪和淀粉[17]。
酵母细胞壁中存在碱不溶性葡聚糖、碱溶性葡聚糖、酸溶性葡聚糖、连接有蛋白质的无定性的碱溶性甘露聚糖等多糖类物质,其中不溶性葡聚糖除因不溶使其在抗肿瘤等的临床应用上受到限制外,高度的粘性、持水性和热稳定性以及制备工艺简单等方面的优点,使其在食品、医药、化妆品、造纸和建筑材料等行业广泛应用[18]。碱不溶性酵母胞壁多糖的不溶解性造成了其测定的困难性。鉴于此,本实验用硫酸溶液对其进行水解,苯酚-硫酸法测定水解液的糖含量。通过单因素和正交实验优化水解条件,以期建立高效、快速、可靠、能作为酵母多糖质量控制方法的碱不溶性酵母胞壁多糖测定方法。
1 材料与方法
1.1 仪器与试剂
废啤酒干酵母 湖北金龙泉啤酒有限公司提供;葡萄糖、氢氧化钠、苯酚、浓硫酸、盐酸、无水乙醇、丙酮、乙醚 分析纯。
320-S型pH计 梅特勒-托利多仪器(上海)有限公司;JJ-1型电动搅拌器 常州国华电器有限公司;DZT-6020型真空干燥箱 上海精宏实验设备有限公司;722S型可见光分光光度计 上海精密科学仪器有限公司;HH·SY11-Ni2型电热恒温水浴锅 北京长源实验设备厂。
1.2 溶液的配制
标准葡萄糖溶液制备:取105℃干燥至恒重的D(+)葡萄糖,精密称重,配成3.62mg/mL的标准储备液。使用前用蒸馏水稀释配制成标准葡萄糖使用液(0.0362mg/mL)。
80%苯酚:80g苯酚(分析纯重蒸馏试剂)加20g水使之溶解,置冰箱中避光贮存。
6%苯酚:临用前以80%苯酚配制。
1.3 实验方法
1.3.1 碱不溶性酵母胞壁多糖制备工艺[19]称取100g废啤酒干酵母,按料液比1∶10g/mL加入1mol/L的NaOH溶液,100℃搅拌处理1h,冷却后用HCl调pH4.5,充分搅拌,3000r/min离心20min后弃上清液,沉淀即为酵母胞壁多糖粗品。将沉淀用200mL蒸馏水洗出,100℃水浴20min,3000r/min离心20min;沉淀用100mL95%乙醇洗出,用电动搅拌器搅拌15min后3000r/min离心20min;重复一次;沉淀用100mL丙酮洗出,搅拌15min后3000r/min离心20min;重复一次;然后沉淀用100mL无水乙醚洗出,搅拌15min,3000r/min离心20min,沉淀置于沸水浴中挥发残余无水乙醚,最后置于37℃下真空烘干,即得碱不溶性酵母胞壁多糖。
1.3.2 标准曲线的制作 采用苯酚-硫酸法[20]。分别精密吸取标准葡萄糖使用液0.40、0.60、0.80、1.00、1.20、1.40、1.60及1.80mL于试管中,各以水补至2.00mL,另一试管加入2.00mL蒸馏水作为空白对照。各试管分别加入6%苯酚1.00mL,然后冷水浴中迅速加入浓硫酸5.00mL,摇匀,并于冷水浴中放置5min,再置沸水浴中加热15min,取出冷却至室温后于490nm处测其吸光度,横坐标为葡萄糖微克数,纵坐标为吸光度值,得标准曲线。
1.3.3 碱不溶性酵母胞壁多糖含量测定 准确吸取多糖水解液1.00mL,按1.3.2操作,测其吸光度,根据回归方程计算水解液的糖浓度,然后按式(1)计算碱不溶性酵母胞壁多糖的含量。
多糖含量(%)=水解液的糖浓度(mg/mL)×250mL/称取的碱不溶性酵母胞壁多糖质量(mg)×100
(1)
1.3.4 碱不溶性酵母胞壁多糖水解条件单因素及正交实验 水解时间筛选:精确称取制备的碱不溶性酵母胞壁多糖10mg,加入20mL 3mol/L H2SO4溶液后于100℃水浴中分别水解60、90、120、150、180min,5000r/min离心20min后定容至250mL,然后按1.3.3操作。以多糖含量为考察指标研究水解时间对多糖水解程度的影响。
水解所需H2SO4溶液浓度的筛选:精确称取制备的碱不溶性酵母胞壁多糖10mg,加入20mL浓度分别为1、2、3、4、5mol/L的H2SO4溶液后于100℃水浴中水解90min,5000r/min离心20min后定容至250mL,然后按1.3.3操作。以多糖含量为考察指标研究H2SO4溶液浓度对多糖水解程度的影响。
水解所需H2SO4溶液体积的筛选:精确称取制备的碱不溶性酵母胞壁多糖10mg,分别加入10、15、20、25、30mL的3mol/L H2SO4溶液水解后于100℃水浴中水解90min,5000r/min离心20min后定容至250mL,然后按1.3.3操作。以多糖含量为考察指标研究H2SO4溶液体积对多糖水解程度的影响。
水解温度的筛选:精确称取制备的碱不溶性酵母胞壁多糖10mg,加入20mL 3mol/L H2SO4溶液后分别于60、70、80、90、100℃水浴中水解90min,5000r/min离心20min后定容至250mL,然后按1.3.3操作。以多糖含量为考察指标研究水解温度对多糖水解程度的影响。
在单因素实验基础上,确定水解时间、H2SO4溶液浓度、H2SO4溶液体积、水解温度为实验因素,以多糖含量为考察指标,根据正交表L9(34)进行正交实验,优化碱不溶性酵母胞壁多糖水解条件。
1.3.5 精密度实验 准确吸取多糖水解液1.00mL,按1.3.2操作,连续5次测定其吸光度。
1.3.6 稳定性实验 每间隔2h准确吸取同一多糖水解液1.00mL,按1.3.2操作,测其吸光度,连续实验12h,观测其稳定性。
1.3.7 重现性实验 取同一批碱不溶性酵母胞壁多糖样品5份,每份10mg,各加入20mL 3mol/L H2SO4溶液后于100℃水浴中水解90min,定容至250mL。然后准确吸取多糖水解液1.00mL,按1.3.3操作,测其吸光度并计算多糖含量。
1.3.8 回收率实验 取同一批碱不溶性酵母胞壁多糖样品6份,其中5份分别加入不同质量的烘干后的葡萄糖,6份样品均加入20mL 3mol/L H2SO4溶液于100℃水浴中水解90min,定容至250mL。然后准确吸取多糖水解液1.00mL,按1.3.2操作,测其吸光度并根据回归方程计算水解液中的糖量,按式(2)计算加标回收率。
加标回收率(%)=(加标样品总糖量-样品中的糖量)/加入的葡萄糖质量×100
(2)
2 结果与讨论
2.1 标准曲线
按1.3.2操作,制作标准曲线,见图1。结果表明,葡萄糖含量在0~0.06516mg范围内与其吸光度呈良好的线性关系,在此范围内的线性回归方程为:y=0.0057x+0.0008,r=0.9998。
2.2 碱不溶性酵母胞壁多糖水解条件单因素实验
2.2.1 碱不溶性酵母胞壁多糖水解时间的筛选 碱不溶性酵母胞壁多糖水解后的溶液状况和多糖含量见表1。
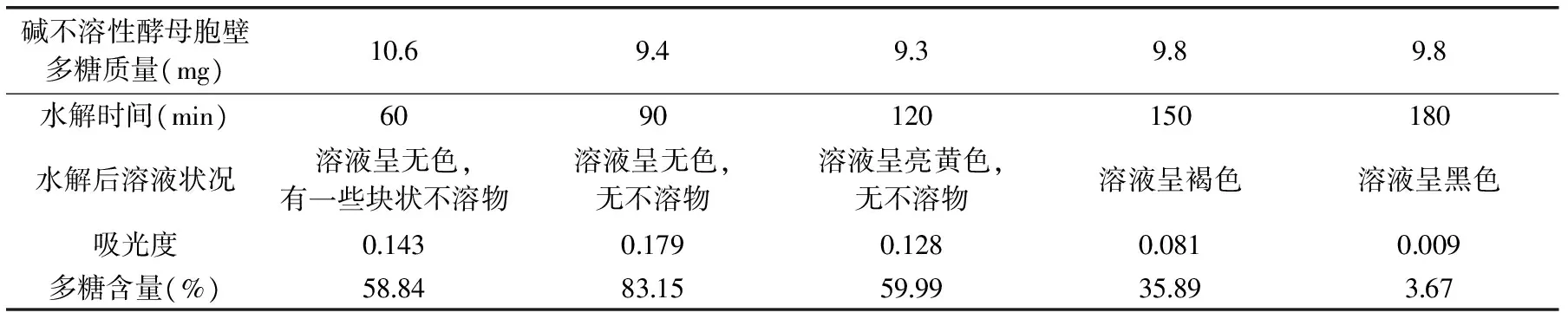
表1 水解时间对碱不溶性酵母胞壁多糖水解的影响Table 1 Effect of hydrolysis time on the hydrolysis of alkali-insoluble yeast cell wall polysaccharides
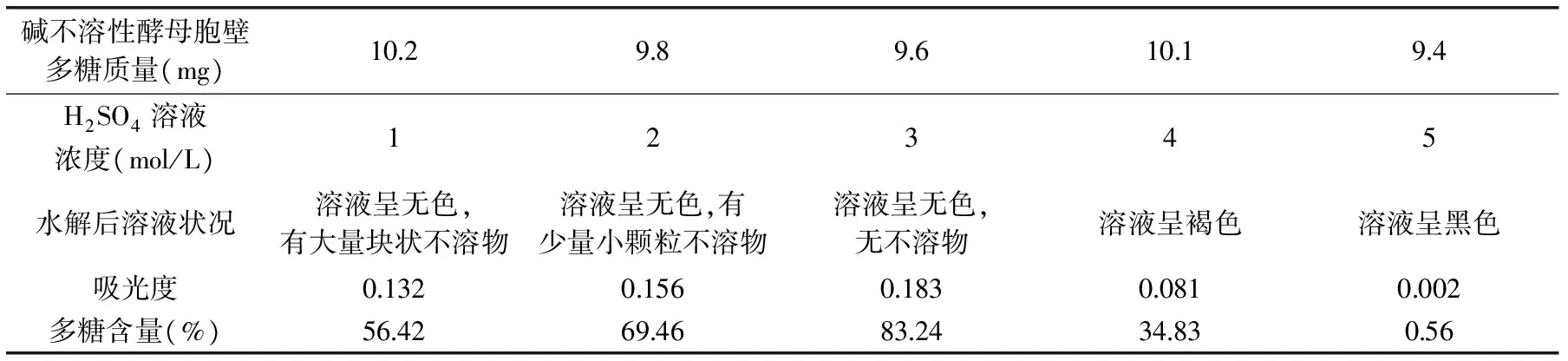
表2 H2SO4溶液浓度对碱不溶性酵母胞壁多糖水解的影响Table 2 Effect of the content of H2SO4 solution on the hydrolysis of alkali-insoluble yeast cell wall polysaccharides

表3 H2SO4溶液体积对碱不溶性酵母胞壁多糖水解的影响Table 3 Effect of the volume of H2SO4 solution on the hydrolysis of alkali-insoluble yeast cell wall polysaccharides
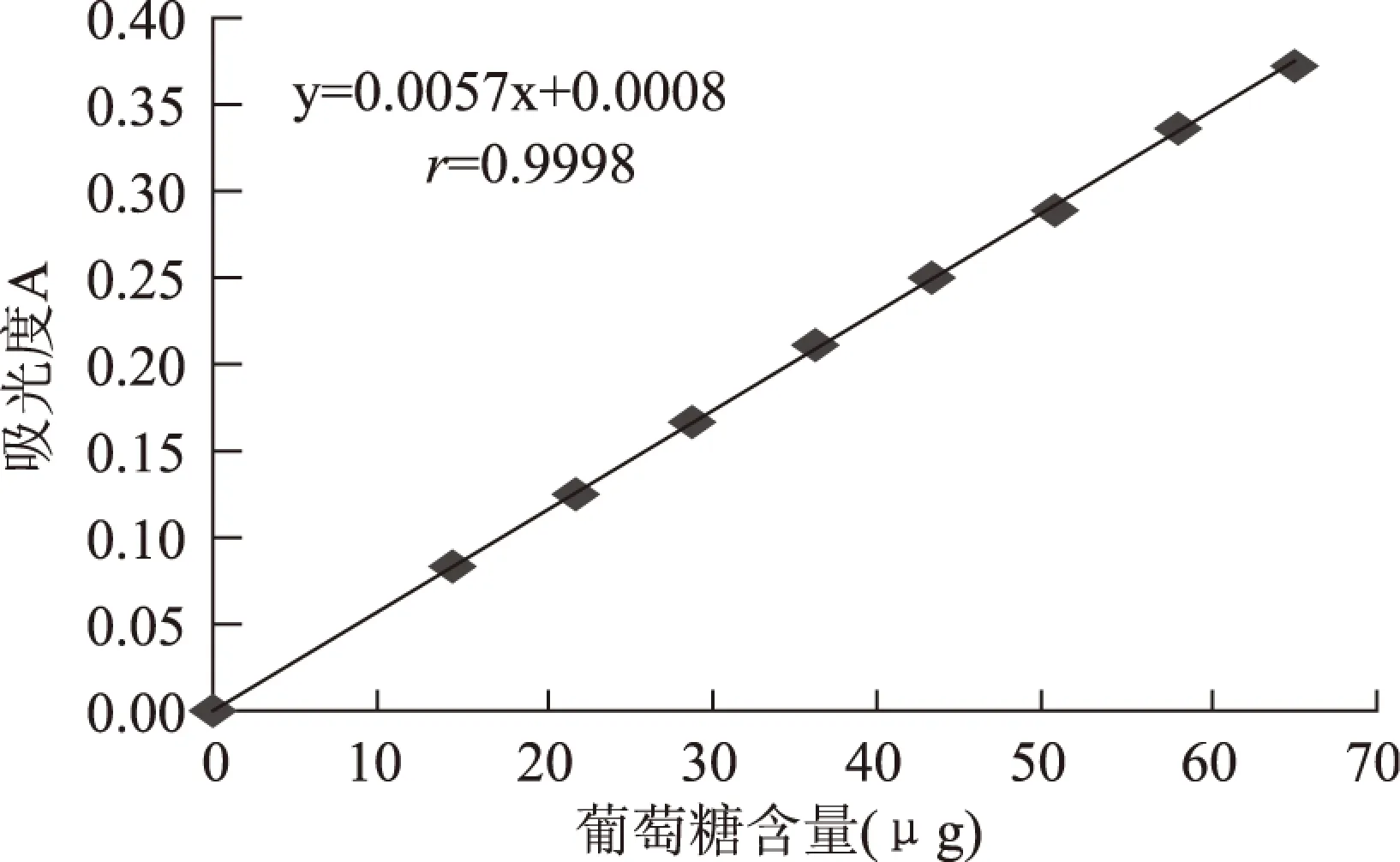
图1 葡萄糖标准曲线Fig.1 Calibration curve of glucose
从表1中可以看出,在90min前,随着水解时间的延长,不溶物逐渐减少,水解程度不断增大,在90min的时候水解程度达到最佳;90min后,硫酸可能使水解生成的糖部分碳化,致使多糖含量减少,水解3h后糖类几乎全部碳化;也有可能是生成了腐黑物[21]。所以确定水解时间为90min。
2.2.2 碱不溶性酵母胞壁多糖水解所需H2SO4溶液浓度的筛选 碱不溶性酵母胞壁多糖水解后的溶液状况和多糖含量见表2。从表2中可以看出,随着硫酸溶液浓度从1mol/L增至3mol/L,碱不溶性酵母胞壁多糖水解程度增大,不溶物减少,多糖含量增加;但当硫酸溶液浓度增至4mol/L及以上时,造成糖类碳化或生成了腐黑物,多糖含量下降。所以确定水解所需硫酸溶液浓度为3mol/L。
2.2.3 碱不溶性酵母胞壁多糖水解所需H2SO4溶液体积的筛选 碱不溶性酵母胞壁多糖水解后的溶液状况和多糖含量见表3。从表3中可以看出,随着硫酸溶液用量从10mL增至20mL,碱不溶性酵母胞壁多糖水解程度增大,不溶物逐渐减少,多糖含量增加;但当硫酸溶液用量超过20mL时,造成糖类碳化或生成了腐黑物,多糖含量下降。所以确定水解所需硫酸溶液用量为20mL。
2.2.4 碱不溶性酵母胞壁多糖水解温度的筛选 碱不溶性酵母胞壁多糖水解后的溶液状况和多糖含量见表4。从表4中可以看出,随着水解温度的升高,碱不溶性酵母胞壁多糖水解逐渐完全,多糖含量增加,且溶液颜色呈无色,说明无碳化和腐黑物生成。所以100℃水浴条件下水解碱不溶性酵母胞壁多糖最适宜。
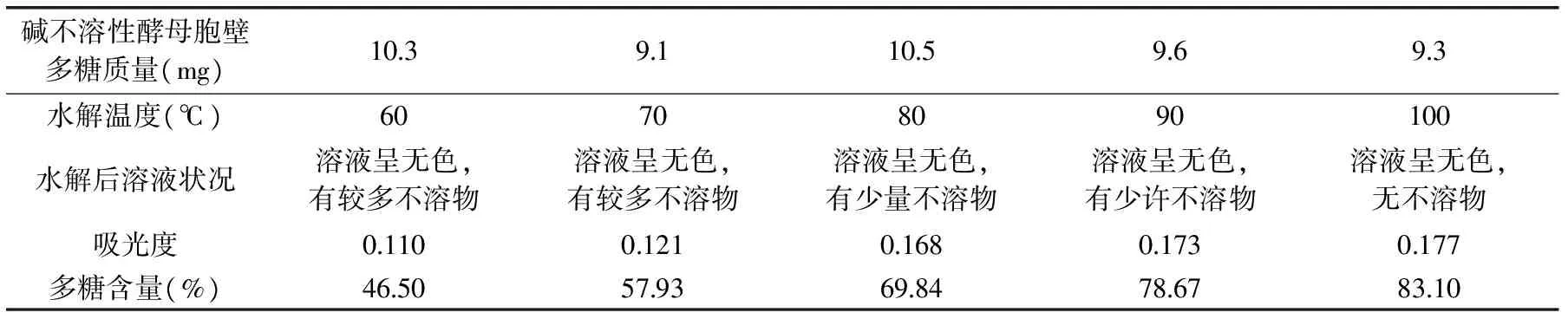
表4 水解温度对碱不溶性酵母胞壁多糖水解的影响Table 4 Effect of hydrolysis temperature on the hydrolysis of alkali-insoluble yeast cell wall polysaccharides
2.3 碱不溶性酵母胞壁多糖水解条件正交实验
由表5可以看出,各因素对碱不溶性酵母胞壁多糖水解的影响程度依次为H2SO4溶液浓度>水解时间>H2SO4溶液体积>水解温度。直观分析最佳水解条件为:称取制备的碱不溶性酵母胞壁多糖10mg,加入20mL 3mol/L H2SO4溶液于100℃水浴中水解90min。按此条件进行验证实验,测得制备的碱不溶性酵母胞壁多糖含量为83.21%,高于所有正交实验组合。因此确定此条件为最佳水解条件。
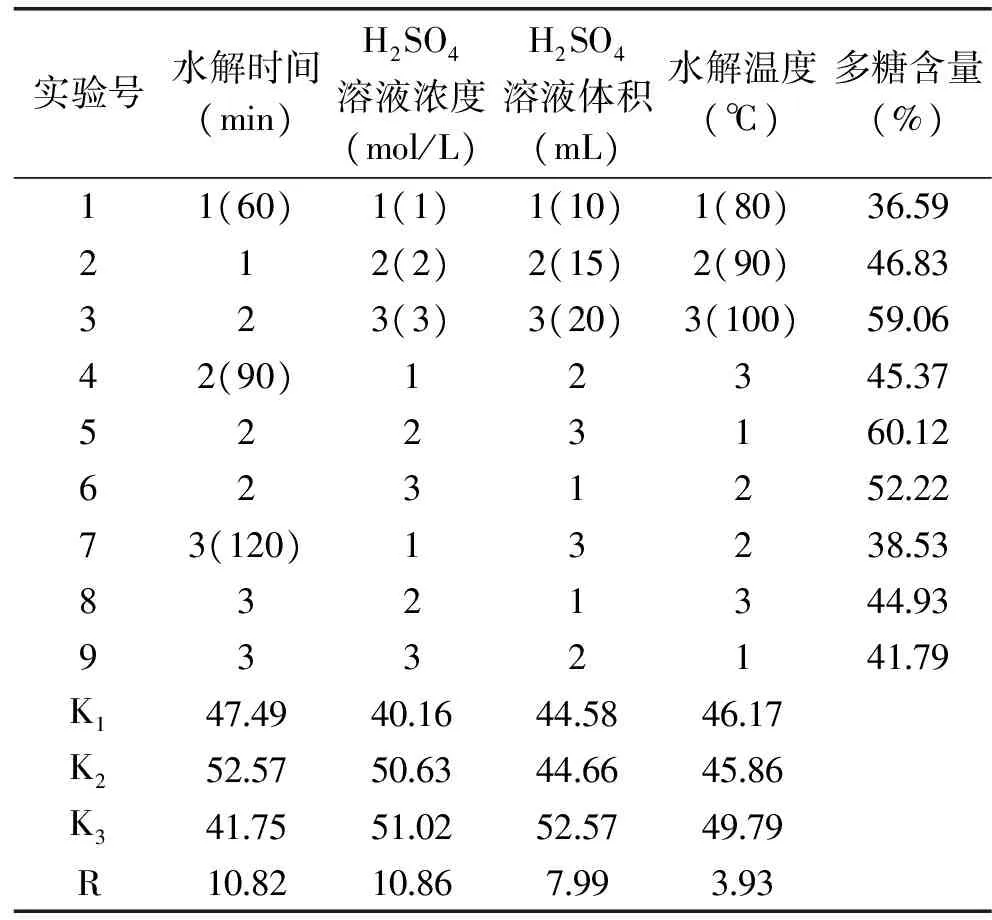
表5 正交实验结果Table 5 Results of L9(34)orthogonal array design tests
2.4 精密度实验
连续5次测定的吸光度见表6。结果显示,水解液经苯酚-硫酸法显色后的吸光度平均值为0.1806,相对标准偏差(RSD)为0.30%(n=5),表明精密度好。
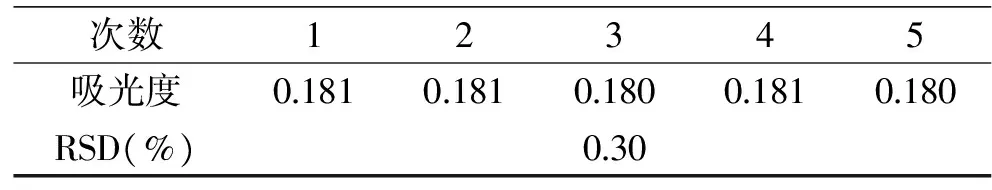
表6 精密度实验结果(n=5)Table 6 Precision of the method(n=5)
2.5 稳定性实验
实验结果见表7。结果显示,相对标准偏差(RSD)为0.67%(n=7),说明水解液在12h内的稳定性良好。
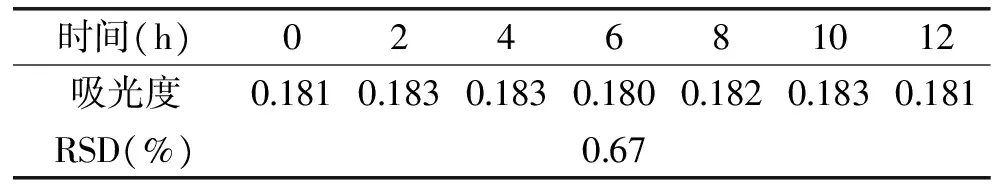
表7 稳定性实验结果Table 7 Stability of the method
2.6 重现性实验
重现性实验结果见表8。结果显示,碱不溶性酵母胞壁多糖中多糖含量的平均值为83.10%,相对标准偏差(RSD)为0.29%(n=5),重现性良好。

表8 重现性实验结果(n=5)Table 8 Reproducibility of the method(n=5)
2.7 回收率实验
实验结果见表9。结果显示,加标回收率的平均值为99.87%,相对标准偏差(RSD)为1.16%(n=5),说明测试结果准确度高。因此用本方法测定碱不溶性酵母胞壁多糖可靠。
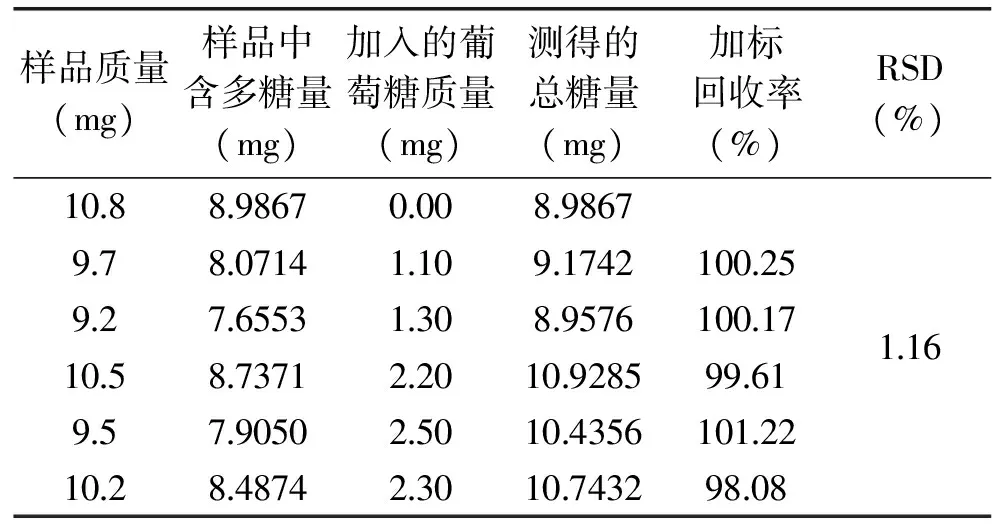
表9 样品测定结果和回收率(n=5)Table 9 Average spike recovery of the method(n=5)
3 结论
本实验通过硫酸溶液水解碱不溶性酵母胞壁多糖,水解条件为:准确称取碱不溶性酵母胞壁多糖10mg,加入20mL 3mol/L H2SO4溶液后于100℃水浴中水解90min,然后定容至250mL。准确吸取水解液1.0mL,按苯酚-硫酸法操作,测其吸光度,根据回归方程和式(1)计算碱不溶性酵母胞壁多糖含量。本方法准确率高,稳定性好,重现性好,结果可靠,操作简便,水解时间较文献[21]缩短了很多,是测定碱不溶性酵母胞壁多糖含量的有效方法。
[1]袁燕舞.利用啤酒废酵母自溶酶解制备橘小实蝇蛋白引诱剂的研究[D].福州:福建农林大学,2013.
[2]赵治,周晶,王玉芹.利用啤酒废酵母泥生产营养酸奶的工艺研究[J].中国畜禽种业,2013,9(3):15-17.
[3]何勇.我国啤酒产业的中庸之道——2012年中国啤酒产业发展概况及趋势分析[J].啤酒科技,2013(6):1-10.
[4]朱益波,翟丽君,朱明,等.啤酒废酵母中β-D-葡聚糖非降解提取工艺[J].食品科学,2011,32(20):121-125.
[5]王慧.酵母多糖提取工艺优化及免疫学活性研究[D].兰州:甘肃农业大学,2012.
[6]王元秀,张桂香,李峰,等.酵母多糖的提取及其对雏鸡免疫器官发育的影响[J].食品科学,2011,32(2):256-259.
[7]王洪斌,李士虎,阎斌伦,等.海洋红酵母多糖提取及其对日本蟳血清中部分免疫活性因子的影响[J].微生物学通报,2011,28(2):176-180.
[8]Zhao W,Liang M,Zhang P. Effect of yeast polysaccharide on the immune function of juvenile sea cucumber,Apostichopus japonicus Selenka under pH stress[J].Aquaculture Internation,2010,18(5):777-786.
[9]Bohn J A,Bemiller J N.(1→3)-β-D-glucans as biological response modifiers:a review of structure-functional activity relationships[J].Carbohydrate Polymers,1995,89(1):3-14.
[10]刘晓丽,蔡东联,赞登,等.酵母多糖对S180荷瘤小鼠抗氧化作用和免疫机能的影响[J].氨基酸和生物资源,2009,31(4):60-64.
[11]Kogan G,Pajitinka M,Babincova M,etal. Yeast cell wall polysaccharides as antioxidants and antimutagens:can they fight cancer[J].Neoplasma,2008,55(5):387-393.
[12]吴华.啤酒酵母多糖高产菌株选育及其抗肿瘤活性研究[D].长春:吉林大学,2010.
[13]黄汝多,李振华,吴志芳,等.生物大分子功能的研究:——酵母甘露聚糖对8.2Gy60Co γ-射线辐照小鼠的辐射防护作用[J].激光生物学报,1999,8(3):171-178.
[14]Moruno EG,Sanlorenzo C,Boccaccino B,etal. Treatment with yeast to reduce the concentration of ochratoxin A in red wine[J]. American Journal of Enology and Viticulture,2005,56(1):73-76.
[15]杨晓红,王元秀,郑明洋,等.酵母甘露聚糖的降血脂作用研究[J].食品与药品,2013,15(2):92-93.
[16]Nicolosi R,Bell S J,Bistrian B R,etal. Changes in plasma lipids from a yeast-derived-glucan fiber in hypercholesterolemic patients[J].Submitted to Am J Clin Nutr,1998(34):189-203.
[17]王淼,陈玉添.酵母葡聚糖在肉制品中的应用研究[J].食品与机械,2001(2):32-33.
[18]胡晓忠,冯万祥.酵母葡聚糖的制备及理化性质[J].华东理工大学学报,1999,25(5):477-479.
[19]张勇,周丽明.碱不溶性酵母胞壁多糖的提取条件[J].江苏农业科学,2013,41(11):307-309.
[20]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:132-136.
[21]徐希柱,辛培超.不溶性酵母多糖分析方法的研究[J].中国酿造,2008(13):80-83.
Study on the phenol-sulfuric acid determination methodof alkali-insoluble yeast cell wall polysaccharides
ZHOU Li-ming,ZHANG Yong
(College of Life Science,Shangrao Normal University,Shangrao 334001,China)
To determine the concent of alkali-insoluble yeast cell wall polysaccharides,the solution of H2SO4was used to hydrolysis the alkali-insoluble yeast cell wall polysaccharides,then the saccharide of the hydrolytic solution was determined by phenol-sulfuric acid method. The hydrolysis condition was optimized by single factor and orthogonal experiments. The optimized hydrolysis condition was as follows:10mg alkali-insoluble yeast cell wall polysaccharides were hydrolyzed for 90min at 100℃ with 20mL 3mol/L H2SO4solution. Then the solution was volumed to 250mL and the content of saccharide was determined. The RSD of precision was 0.30%. The RSD of stability was 0.67%. The RSD of reproducibility was 0.29%. The average spike recovery was 99.87%,with 1.16% RSD. The method was effective for determination of alkali-insoluble yeast cell wall polysaccharides.
alkali-insoluble;yeast cell wall polysaccharides;hydrolysis;phenol-sulfuric acid method
2014-04-08
周丽明(1980-),女,硕士,讲师,研究方向:生物活性物质。
TS261.9
A
1002-0306(2015)03-0311-05
10.13386/j.issn1002-0306.2015.03.057
