杜仲雄花茶多糖的响应面优化提取及其抗氧化活性评价
2015-06-05朱丽蓉吴萍萍杨大伟董娟娥
朱丽蓉,吴萍萍,杨大伟,董娟娥,*
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.山西省林业调查规划院,山西太原 030012;3.平利县古仙湖生态养殖有限公司,陕西平利 725500)
杜仲雄花茶多糖的响应面优化提取及其抗氧化活性评价
朱丽蓉1,吴萍萍2,杨大伟3,董娟娥1,*
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.山西省林业调查规划院,山西太原 030012;3.平利县古仙湖生态养殖有限公司,陕西平利 725500)
为了寻找杜仲雄花茶多糖的提取工艺,考察多糖的抗氧化活性,采用Design Expert 8.0软件设计实验,并用响应面法优化提取工艺,以DPPH·清除率、·OH清除率和还原力等指标评价杜仲雄花茶多糖的抗氧化活性。结果表明:杜仲雄花茶多糖的提取工艺参数为:提取温度90℃、提取时间4.5h、液料比15∶1。在此工艺条件下,多糖提取得率为3.48%。以合成抗氧化剂BHT为对照,1mg/mL杜仲雄花茶多糖对DPPH·的清除率为52.5%,还原力为72.73%,对·OH的清除率为63.1%。杜仲雄花茶具有一定的抗氧化活性。
杜仲,多糖,抗氧化,提取,响应面
多糖(polysaccharides)是由10个以上的单糖通过糖苷键连接形成的含醛基或酮基的天然高分子聚合物[1],广泛存在于真菌、藻类和高等植物中的一类生物活性物质[2]。近年研究表明,天然活性多糖具有广泛的药理活性,包括免疫调节[3]、抗肿瘤[4]、抗氧化[5]、降血糖[6]和抗病毒作用[7]等,又因其毒性较低,国内外关于它的研究得到迅速发展,一些多糖方面的药物也得到了开发,如香菇多糖等[8]。
杜仲(EucommiaulmoidesOliv.)为杜仲科、杜仲属的落叶乔木,其皮和叶皆可入药[9]。具有降血压、抗衰老、抗癌、抗菌、镇痛、消炎、利尿、镇静、安神、抗病毒以及增强机体非特异免疫力等作用,对细胞免疫有双向调节功效[10]。杜仲多糖是杜仲重要的活性成分,具有抗补体效应[11]、抗肝纤维化作用[12]、提高免疫作用[13]、毒性保护作用[14]等。杜仲为雌雄异株植物,杜仲雄花产量很高,据统计每年约有30000t的产花量[15]。我们对杜仲雄花中的生物活性成分和营养成分进行了系统研究[16],并将杜仲雄花加工成雄花茶,进一步对雄花茶的护绿工艺和干燥工艺等进行了研究[15,17]。有关杜仲雄花茶多糖及其生理活性研究鲜见报道。本研究采用响应面法优化了杜仲雄花茶多糖的提取工艺,并对其抗氧化活性进行了评价,为杜仲雄花的综合利用及新产品的开发提供了基础研究资料。
1 材料与方法
1.1 材料与仪器
杜仲雄花于2013年3月中下旬(初花期)采自西北农林科技大学林学院校区杜仲树林。在雄株花蕾形成后及时采收,避免花粉散落。按照文献方法制成杜仲雄花茶[15,17]。粉碎过20目筛成杜仲雄花茶粉末,冷藏备用。
DPPH(2,2-Diphenyl-1-picrylhydrazyl) 美国Sigma公司;Folin-Ciocalteu’s reagent(2N) 上海荔达生物技术有限公司;葡萄糖标准品 中国药品生物制品检定所;铁氰化钾、磷酸、三氯乙酸、FeSO4、硫代巴比妥酸、乙醇等 均为分析纯。
UV-1800紫外分光光度计 上海美谱达仪器有限公司;AG204分析天平 METTLER TOLEDO;RE52AA旋转蒸发器 上海亚荣生化仪器厂;101A电热鼓风干燥箱 上海实验仪器有限公司;TGL-16离心机 湘潭湘仪仪器有限公司。
1.2 实验方法
1.2.1 杜仲雄花茶多糖提取 取50℃下烘干至恒重的杜仲雄花茶粉末300g,用95%乙醇-水溶液浸提24h脱脂和除去低聚糖,真空抽滤,滤渣于低温下(30℃)真空烘至恒重。取2g滤渣,按照实验设定的量加入蒸馏水,以设定的提取条件浸提,用水提醇沉法得到杜仲雄花茶多糖。将多糖用丙酮洗3次脱色,得灰白色的杜仲雄花多糖。
1.2.2 标准曲线的制作 取葡萄糖对照品配制成1mg/mL的水溶液。分别将对照品溶液稀释成0.0、0.1、0.2、0.3、0.4、0.5和0.6mg/mL标准液。于标准液中加入DNS试剂[18],充分混匀,90℃水浴中显色10min,流水冷却,在490nm测吸光度。以浓度为因变量,吸光度为自变量计算得回归方程:
C=1.0183A-0.0109(R2=0.9931),其中,A为吸光度,C为样品中葡萄糖的质量浓度。
1.2.3 多糖水解 按照文献方法[18],取提取的多糖,热水溶解,加入5mL的HCl(6mol/L),沸水浴加热15min,冷却后用NaOH(6mol/L)调pH至中性。
1.2.4 多糖的含量测定 分别取多糖水溶液和多糖水解溶液2mL,各加入2mL DNS试剂和1mL蒸馏水,以2mL DNS试剂中加入3mL蒸馏水为对照,在90℃水浴中显色10min,测定样品还原性单糖量(a)和总糖量(b),用总糖含量减去还原性单糖量表示多糖量。多糖的含量计算公式为:
1.2.5 多糖提取的单因素实验 分别以液料比、提取时间、提取温度为单因素实验,考察各因素对杜仲雄花茶多糖提取率的影响。在提取温度单因素实验中,提取时间为4h,液料比为15∶1,温度分别设置为50、60、70、80、90、100℃。在提取时间单因素实验中,提取温度为90℃,液料比为15∶1,时间分别设置为1、2、3、4、5、6h。在料液比单因素实验中,提取时间为4h,提取温度为90℃,液料比分别设置为5∶1、10∶1、15∶1、20∶1、25∶1。
1.2.6 响应面优化多糖提取工艺 根据Box-Benhnken中心组合实验设计原理,根据单因素实验结果,以多糖提取得率为响应值,采用Design Expert软件设计三因素三水平响应面实验方案,优化杜仲雄花茶多糖提取工艺。实验因素和水平见表1。

表1 响应面实验因素水平表Table 1 Factors and their coded levels in the response surface analysis
1.2.7 杜仲雄花茶多糖的抗氧化活性评价
1.2.7.1 DPPH自由基清除活性测定 采用Sun等[19]的方法。取杜仲雄花茶多糖配制成不同质量浓度的溶液,加入2mL 2×10-4mol/L DPPH乙醇溶液,混匀。室温避光放置30min,517nm波长处测定吸光度(A),以2mL水代替多糖溶液为对照。清除率的计算公式为:

式中:A0为对照溶液的吸光度;A1为样品溶液的吸光度。
1.2.7.2 羟自由基清除活性测定 采用Takeshi 等[20]的方法。将300μL的FeSO4(10mmol/L)、300μL的EDTA(10mmol/L)和300μL的2-Deoxyribose(10mmol/L)与1.5mL 0.1mol/L的磷酸盐缓冲液(pH7.4)混合均匀,分别与不同质量浓度杜仲雄花茶多糖溶液混合,加入300μL的H2O2(10mmol/L),在37℃下培养4h。再加入1mL硫代巴比妥酸溶液(10g/L),混匀后在沸水浴中培养10min。冷却至室温后,于3000r/min离心5min,取上清,在532nm处测吸光度。对照以蒸馏水代替多糖样品。清除率计算公式为:

式中:A0为对照溶液的吸光度;A1为样品溶液的吸光度。
1.2.7.3 还原力测定 采用Ryszard[21]的方法。取多糖样品溶液,加入2.5mL0.2mol/L磷酸盐缓冲液(pH6.6)和2.5mL铁氰化钾溶液(10g/L),50℃水浴中放置20min。迅速冷却后,加入2.5mL三氯乙酸溶液(100g/L),混匀,于3000r/min离心20min。取2.5mL上清液,加入2.5mL蒸馏水和0.5mL三氯化铁(1g/L),反应10min,于700nm测吸光度。对照以蒸馏水代替杜仲雄花茶多糖样品溶液。
2 结果与分析
2.1 杜仲雄花茶多糖提取工艺单因素考察
2.1.1 提取温度对多糖提取得率的影响 提取温度对多糖提取得率的影响结果见图1。随着提取温度的升高,杜仲雄花茶多糖得率逐渐增大,60~80℃时,多糖得率急剧增加,80℃时多糖得率增加为60℃时的2.15倍;90℃时,多糖得率比80℃提高了0.1%,而90~100℃之间,多糖得率基本不变。故90℃左右为杜仲雄花茶多糖提取的适宜温度。

图1 提取温度对杜仲雄花茶得率的影响Fig.1 Effect of extraction temperature on extraction yield of polysaccharides from E. male flower
2.1.2 提取时间对多糖得率的影响 提取时间对多糖提取得率的影响结果见图2。随着提取时间的增加,杜仲雄花茶多糖得率逐渐增加。当提取时间在4~5h时,多糖得率已接近6h时的3.76%。考虑到实际生产成本,选4h为多糖的提取时间。

图2 提取时间对杜仲雄花茶多糖得率的影响Fig.2 Effect of extraction time on extraction yield of polysaccharides from E. male flower
2.1.3 液料比对多糖得率的影响 液料比对多糖提取得率的影响结果见图3。随着液料比的提高,杜仲雄花茶多糖得率提高,液料比为10∶1~20∶1时,杜仲雄花茶多糖提取得率由3.21%到3.67%逐渐增大,液料比为25∶1时提取得率已不再增加,考虑到实际生产成本,选15∶1为多糖的提取液料比。

图3 液料比对杜仲雄花茶多糖得率的影响Fig.3 Effect of liquid-to-solid ratio on extraction yield of polysaccharides from E. male flower
2.2 提取工艺参数的响应面优化
在提取温度、提取时间和液料比的不同组合条件下提取,计算多糖得率,见表2。
对表2数据采用Design Expert 8.0软件处理和分析,获得杜仲雄花茶多糖提取率对提取温度、时间和液料比的二次多元回归方程:Y=3.53-0.07X1+0.26X2+0.19X3+0.10X1X2+0.04X1X3-0.01X2X3-0.31X12-0.30X22-0.10X32对方程的各项回归系数及显著性进行检验,见表3。

表2 杜仲雄花茶多糖提取的响应面实验结果Table 2 The experimental design and results for response surface analysis

表3 回归系数及显著性检验Table 3 The regression coefficient and significance of each term in the fitted regression model

根据回归方程得响应面图(图4),观察拟合响应面的形状,分析提取温度、时间和液料比对多糖得率的影响。多糖得率随提取温度的提高和提取时间延长呈现先上升后下降的趋势,提取温度和提取时间的等高线形状趋于圆形,表明其交互作用不大(图4)。多糖得率随提取温度和液料比的提高呈现先上升后下降的趋势,提取温度和液料比的等高线形状趋于椭圆形,表明其交互作用显著;液料比轴向等高线变化密集,温度轴向等高线变化相对稀疏,故温度对响应值的影响较液料比大(图4)。多糖得率随提取时间和液料比的提高也呈现先上升后下降的趋势,提取时间和液料比的等高线形状趋于椭圆形,表明其交互作用显著,且液料比轴向等高线变化相对密集,提取时间等高线变化相对稀疏,故提取时间对响应值的影响较液料比大(图4)。提取温度、时间和液料比的增大均可提高多糖提取得率,但温度过高或时间过长均会增加多糖降解,溶剂用量的增大使得后续的浓缩量和生产成本加大。因此,选择适当的提取条件有助于提高多糖的提取效率。
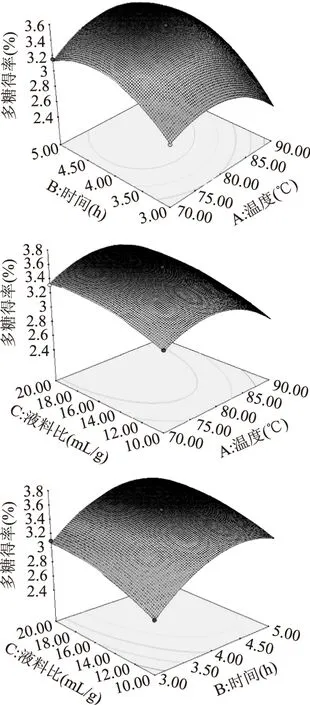
图4 各因素交互影响杜仲雄花茶多糖提取得率的响应面图Fig.4 Response surface for the effect of crossinteraction among factors on the yield of crude polysaccharides from E. male flower
2.3 杜仲雄花茶多糖提取条件的验证
由模型方程计算可得,在提取温度为88.89℃、提取时间为4.45h、液料比为15.02∶1时,杜仲雄花茶多糖理论最大理论得率为3.58%。根据实验实际操作优化条件为提取温度90℃、提取时间4.5h和液料比为15∶1时,杜仲雄花茶多糖平均提取得率为3.48%,与模型方程预测值的误差为2.9%,说明得到的提取参数可靠。
2.4 杜仲雄花茶多糖抗氧化活性评价
2.4.1 对DPPH·的清除作用 杜仲雄花茶多糖对DPPH·有一定的清除作用(图5),量效关系显著,在实验范围内随着杜仲雄花茶多糖浓度的增加,对DPPH·清除率显著增加。当质量浓度在0.2~0.6mg/mL时,对DPPH·清除率随着质量浓度的增加快速增加;当质量浓度在0.8~1mg/mL时,随着质量浓度增加,多糖对DPPH·清除率增加缓慢;该多糖的IC50值为0.814mg/mL;以合成的抗氧化剂BHT为对照,当质量浓度为1mg/mL时,杜仲雄花茶多糖对DPPH·的清除率可达到52.5%。

图5 杜仲雄花茶多糖和BHT对DPPH·的清除作用Fig.5 Scavenging effect of polysaccharides from E. male flower and BHT on DPPH·
2.4.2 对·OH的清除作用 在实验范围内杜仲雄花茶多糖和BHT对·OH的清除率随其质量浓度的升高而上升(图6)。多糖质量浓度低于0.4mg/mL时,对·OH的清除率较低;而质量浓度增加到0.8mg/mL时,清除率上升至59%;在质量浓度为1mg/mL时,对·OH的清除率为可达到63.1%;多糖对·OH清除的IC50值为0.725mg/mL。
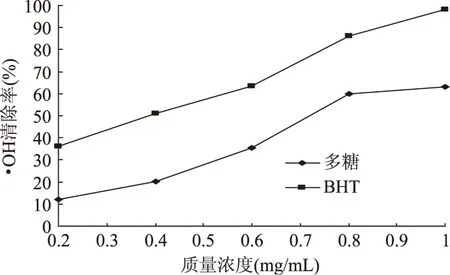
图6 杜仲雄花茶多糖和BHT对·OH的清除作用Fig.6 Scavenging effect of polysaccharide from E. male flower and BHT on ·OH
2.4.3 杜仲雄花茶多糖还原力 植物提取物还原力的大小与其抗氧化能力有关,还原力已成为衡量物质抗氧化活性的重要指标之一。杜仲雄花茶多糖表现较好的还原力(图7),随着质量浓度的增加,量效关系显著。当质量浓度为1mg/mL时,杜仲雄花茶多糖的还原力可达到BHT的72.73%。

图7 杜仲雄花茶多糖和BHT的还原力Fig.7 Reducing power of polysaccharide from E. male flower and BHT
3 结论
利用Design Expert 8.0设计实验,采用响应面法优化了杜仲雄花茶多糖的提取工艺。杜仲雄花茶多糖提取的工艺为:提取温度90℃、提取时间4.5h、液料比15∶1,在此条件下多糖提取得率可达到3.48%。体外抗氧化活性实验结果表明,以BHT作为标准,1mg/mL杜仲雄花茶多糖对DPPH·清除率为52.5%,对·OH的清除率为63.1%,还原力为72.73%。在实验范围内,杜仲雄花茶多糖抗氧化能力随质量浓度升高而增强,呈现出量效关系。说明杜仲雄花茶具有一定的抗氧化效果。
[1]林俊,李萍,陈靠山. 近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125.
[2]Kouakou K,Igor A S,Yapi A,etal. Immunomodulatory activity of polysaccharides isolated from Alchornea cordifolia[J]. Journal of Ethnopharmacology,2013,146:232-242.
[3]Jiang M H,Zhu L,Jiang J G. Immunoregulatory actions of polysaccharides from Chinese herbal medicine[J]. Expert Opinion on Therapeutic Targets,2010,14:1367-1402.
[4]Sun X,Gao R L,Xiong Y K,etal. Antitumor and immunomodulatory effects of a water-soluble polysaccharide from Lilii Bulbus in mice[J]. Carbohydrate Polymers,2014,102:543- 549.
[5]Liu Z S,Li C,Zhang Q,etal. Effect of Renshen polysaccharides on oxidative injury in kidney IR rabbits[J]. Carbohydrate Polymers,2012,90:773-777.
[6]Zhu J,Liu W,Yu J P,etal. Characterization and hypoglycemic effect of a polysaccharide extracted from the fruit of Lycium barbarumL[J]. Carbohydrate Polymers,2013,98:8- 16.
[7]Dong C X,Kyoko H,Yusuke M,etal. Structures of acidic polysaccharides from Basella rubra L. and their antiviral effects[J].Carbohydrate Polymers,2011,84:1084-1092.
[8]Ren L,Perera C,Hemar Y. Antitumor activity of mushroom polysaccharides:a review[J].Food & Function,2012,3:1118-1130.
[9]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国中国医药科技出版社,2010:154-155.
[10]李欣,刘严. 杜仲的化学成分及药理作用研究进展[J].食品工业科技,2012,33(10):378-381.
[11]Zhu H W,Di H Y,Zhang Y Y,etal. A protein-bound polysaccharide from the stem bark ofEucommiaulmoidesand its anti-complementary effect[J]. Carbohydrate Research,2009,344:1319-1324.
[12]周程艳,艾凌艳,王美,等. 杜仲多糖抗肝纤维化作用的实验研究[J].中草药,2011,42(2):324-330.
[13]徐贤柱,饶华,蔡险峰,等. 杜仲叶多糖提取及对小鼠免疫功能影响研究[J].时珍国医国药,2013,24(3):541-542.
[14]辛晓明,郭桂丽,王浩,等. 杜仲多糖对环磷酰胺致小鼠毒性的影响[J].时珍国医国药,2009,20(7):1664-1665.
[15]付卓锐,董娟娥,马希汉. 杜仲雄花茶加工中护绿工艺响应面优化[J].农业机械学报,2010,41(4):145-146.
[16]董娟娥,梁宗锁,张康健,等.杜仲雄花中次生代谢物合成积累的动态变化[J].植物资源与环境学报,2005,14(4):7-10.
[17]董娟娥,付卓锐,马希汉,等.不同干燥方法对杜仲雄花茶品质的影响[J].农业机械学报,2011,42(8):131-137.
[18]董娟娥,梁宗锁,靳爱仙,等.杜仲叶酸性多糖提取物分离及含量测定[J].林业科学,2006,42(10):59-61.
[19]Sun L J,Zhang J B,Lu X Y,etal. Evaluation to the antioxidant activity of total flavonoids extract from persimmon(DiospyroskakiL.)leaves[J]. Food and Chemical Toxicology,2011,49:2689-2696.
[20]Takeshi N,Reiji I,Hachiro I,etal. Scavenging capacities of pollen extracts fromCistusladaniferuson autoxidation,superoxide radicals,hydroxyl radicals,and DPPH radicals[J]. Nutrition Research,2002,22:519-526.
[21]Ryszard A,Isabel E,Teresa H,etal. Free radical-scavenging capacity,antioxidant activity,and phenolic composition of green lentil(Lensculinaris)[J]. Food Chemistry,2010,121:705-711.
Study on the optimization of extracting polysaccharidesfromEucommiamale flowers tea byresponse surface methodology and the antioxidant evaluation
ZHU Li-rong1,WU Ping-ping2,YANG Da-wei3,DONG Juan-e1,*
(1.College of Life Sciences,Northwest A&F University,Yangling 712100,China;2.Investigation and Planning Institute of Shanxi Forestry,Taiyuan 030012,China;3.Pingli Guxianhu ecological breeding Co.,Ltd.,Pingli 725500,China)
The optimum extraction process of polysaccharides fromEucommiamale flowers tea and its antioxidant activity were explored. The process was designed by Design Expert 8.0,and the extraction conditions were optimized by response surface methodology(RSM).The antioxidant activities were examined from the aspects of scavenging rate of DPPH and hydroxyl free radicals,reducing power,respectively. The results indicated that the optimum extraction conditions were:extraction temperature 90℃,extraction time 4.5h,ratio of solvent to material 15∶1. Under these conditions,the yield of polysaccharides had 3.48%.Compared with BHT,the rate of scavenging DPPH radicals was 52.5%,the reducing power reached to 72.73%,and the rate of scavenging hydroxyl radical was 63.1% when theEucommiamale flower polysaccharide concentration was 1mg/mL. The above results indicated that theEucommiamale flower polysaccharides had antioxidant effectsinvitro.
Eucommia;polysaccharides;antioxidant;extraction;RSM
2014-05-15
朱丽蓉(1990-),女,硕士,研究方向:天然产物提取分离与开发利用。
*通讯作者:董娟娥(1968-),女,博士,教授,主要从事药用植物学和天然产物开发利用的教学和研究工作。
国家林业公益性行业科研专项重大项目(201204603);工信部万亩中药材基地建设项目(万亩杜仲林建设)。
TS272.5
B
1002-0306(2015)03-0199-06
10.13386/j.issn1002-0306.2015.03.033
