X射线对嗜热乳杆菌产L乳酸的选育研究
2015-06-05吴庆华陈积红李文建魏子昊王曙阳
吴庆华,陈积红,张 珍,李文建,胡 伟,魏子昊,刘 敬,王曙阳
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.中国科学院近代物理研究所,甘肃兰州 730000;3.甘肃省辐照诱变育种工程实验室,甘肃兰州 730000)

吴庆华1,2,3,陈积红2,3,*,张 珍1,李文建2,3,胡 伟2,3,魏子昊1,刘 敬2,3,王曙阳2,3
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.中国科学院近代物理研究所,甘肃兰州 730000;3.甘肃省辐照诱变育种工程实验室,甘肃兰州 730000)
为了获得更适于工业生产的产L-乳酸菌株,提高生产效率。本文以X射线对嗜热乳杆菌(Lactobacillusthermophilus)进行诱变处理,通过碳酸钙-溴甲酚紫平板初筛结合摇瓶复筛的方法,最终获得稳定高产的突变菌株。结果表明:经X射线诱变得到的突变菌株SR7,平均发酵产酸量为22g/L,比原菌株产量提高了15.04%,且经过多次重复实验表明该菌株具有良好的遗传稳定性。
嗜热乳杆菌,L-乳酸,诱变育种
乳酸(Lactic acid),又名2-羟基丙酸(2-hydroxypropanoic acid),是一种重要的天然有机酸[1]。根据其构型和旋光性,可分为D-乳酸、L-乳酸和DL-乳酸[2]。由于人体只具有L-乳酸脱氢酶,所以只有L-乳酸能被人体完全代谢,而D-乳酸或DL-乳酸的摄入过量则有可能引起代谢紊乱甚至导致中毒[3]。因此,L-乳酸广泛应用于食品、医药、农业、化妆品等领域[4]。特别是高光学纯度的L-乳酸,可作为生物降解材料聚乳酸的前体。所以,从健康和环保的角度考虑,L-乳酸的制备及应用研究,已引起世界广泛重视,应用前景广阔,市场需求量巨大[5-6]。
目前,在工业上,L-乳酸的生产主要依赖于微生物发酵[7]。其中,细菌类嗜热乳杆菌属于同型乳酸发酵菌株,具有发酵温度高和需氧量低等特点,极大的减少了发酵过程中其他微生物的污染以及生产成本[8]。然而,从自然界中获得的野生型菌种往往不能达到工业发酵生产要求,需要经过诱变技术进一步人工的改造。如鲁明波[9]等人利用紫外线处理鼠李糖乳杆菌,筛选获得一株比原始菌株产L-乳酸提高了18.1g/L的高产突变株。蔡聪[10]等人通过等离子体诱变凝结芽孢杆菌,筛选得到了稳定高产L-乳酸突变株等。
而X射线作为一种短波长的电磁辐射,具有精度可调,操作简便等特点,被广泛应用于生物体的辐照效应研究[11]。例如,罗水忠[12]、陈亮[13]等人都以X射线对菌种进行诱变选育,效果显著。但该技术在产L-乳酸细菌类中应用很少见报道。
因此,本研究以X射线为诱变手段对嗜热乳杆菌进行诱变选育,以期望得到稳定高产L-乳酸的突变菌株,降低生产成本,利于工业生产。
1 材料与方法
1.1 材料与设备
嗜热乳杆菌(Lactobacillusthermophilus) 由中国科学院近代物理研究所生物物理室提供。
SW-CJ-1Cμ型双人单面净化工作台 苏州净化设备有限公司;TE101-L天平、BS224S电子天平 北京赛多利斯仪器系统有限公司;756PC型紫外可见分光光度计 上海光谱仪器有限公司;LDZX-30KB立式压力蒸汽灭菌器 上海申安医疗器械厂;PB-21酸度计 北京赛多利斯仪器系统有限公司;DHP-9082型电热恒温箱 上海一恒科学仪器有限公司;旋涡混合器 上海康华生化仪器制造有限公司。
培养基:MRS培养基[14](g/L):葡萄糖20g,蛋白胨10g,牛肉膏10g,酵母膏5g,柠檬酸钠5g,吐温-80 1mL,乙酸钠5g,K2HPO42g,MgSO4·7H2O 0.58g,MnSO4·4H2O 0.25g,琼脂15g,蒸馏水1000mL,pH6.2~6.4(用冰醋酸调pH);筛选平板(碳酸钙-溴甲酚紫):MRS培养基中添加0.25%的碳酸钙和0.01%溴甲酚紫;种子培养基(液体MRS):MRS培养基中不加琼脂;发酵培养基[15](g/L):种子培养基中葡萄糖50g,CaCO350g,pH6.8。以上培养基灭菌条件均为115℃,20min[16]。
1.2 实验方法
1.2.1 生长曲线的测定 将斜面保存的嗜热乳杆菌接种一两环于种子培养基中,50℃下静置培养。每2h取样,测定OD600,至24h。以时间为横坐标,OD600值为纵坐标作图,得到原始菌株的生长曲线[17]。
1.2.2 X射线诱变 X射线诱变[17]:取活化后的菌种,用生理盐水将菌浓度调整到10-8个/mL,用振荡器制成均匀的菌悬液。将制备好的菌悬液吸取1mL于辐照小皿,辐射计量为0.98Gy/min,以0、12.5、25、50、75、100、125、150Gy下进行X射线辐照。将辐照好的菌悬液进行梯度稀释,吸取0.1mL涂于筛选平板上,50℃培养24h后计算每皿菌落数,绘制致死曲线。进行突变菌株初步筛选,挑取单菌落进行后期发酵测定实验。
1.2.3 菌种筛选 初筛:将经X射线诱变处理的菌悬液适当稀释,吸取0.1mL涂布于筛选平板上,50℃培养24h,筛选平板上将出现乳白色菌落,并且在菌落周围出现黄色变色圈。将变色圈大的菌落挑取培养,然后稀释涂布成单菌落,测定变色圈直径和菌落直径之比(即HC值),并进行编号[18]。
复筛:挑取初筛菌种的保藏菌种一两环,在种子培养基中培养到对数后半期后,以10%的接种量转入发酵培养基,进行复发酵实验,培养72h进行产量测定。
1.2.4 分析方法 生物量测定:采用比浊法,紫外分光光度计测菌液OD600nm[18];致死率的测定:活菌平板计数法[19];乳酸的测定:EDTA滴定法[20]。
致死率(%)=(诱变前活菌数-诱变后活菌数)/诱变前活菌数×100
1.2.5 数据处理方法 数据处理均采用Excel、显著性结果分析均采用SPSS19;图表制作均采用origin 7.5。
2 结果与分析
2.1 原始菌株的生长曲线
为了了解原始菌株生长情况并为后期实验做准备。按照1.2.1的方法,得到原始菌株的生长曲线(图1)。由图1可以看出,前10h为延滞期,从10h到22h为对数生长期,22h后为稳定期。由于诱变在菌种生长的对数期后半期效果最明显,所以选取培养18h的菌种作后期诱变处理。
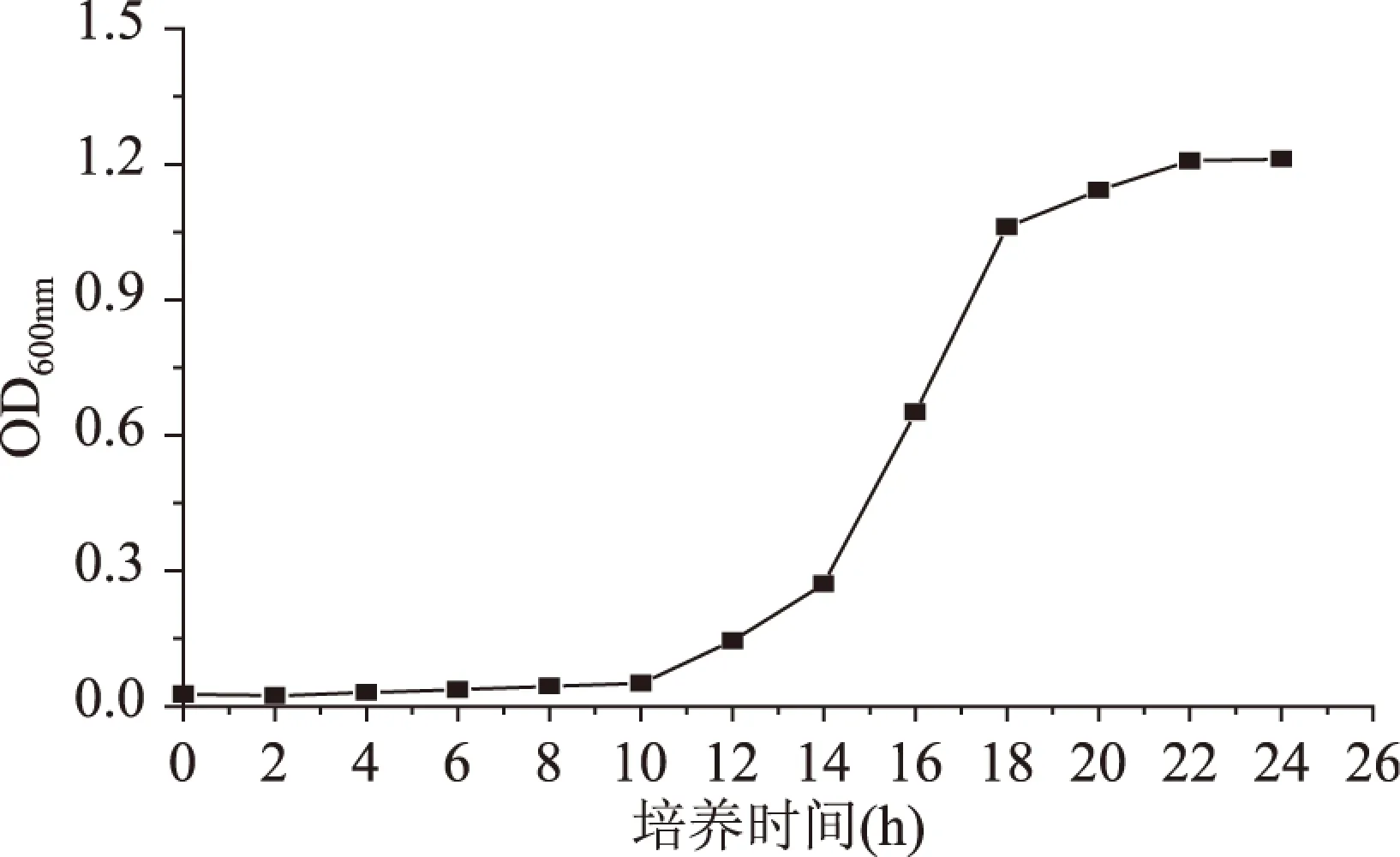
图1 嗜热乳杆菌的生长曲线Fig.1 Growth curve of Lactobacillus thermophilus
2.2 X射线诱变结果
本实验将X射线的流强控制在大致相同的范围内,按照1.2.2的方法,以相对辐照剂量为横坐标,致死率为纵坐标,作致死曲线,结果如图2所示。
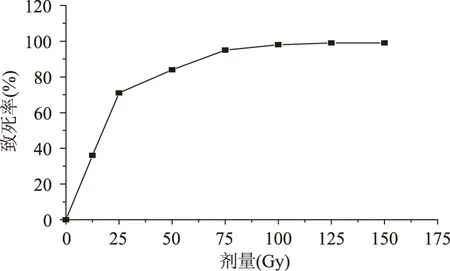
图2 嗜热乳杆菌的致死曲线Fig.2 Lethality rate curve of Lactobacillus thermophilus
根据诱变理论,有研究表明一般选择致死率为70%~80%的剂量辐照诱变菌株,菌株容易出现正突变[10,18]。由图2可以看出,随着辐照剂量的增加,细菌的致死率逐渐提高,当辐照剂量达到75Gy时,致死率已经达到94%。图2表明,本实验选取的辐照量范围合理,并选择辐照剂量在50~100Gy的菌液平板,挑取单菌落进行发酵测定。

表2 突变株SR3、SR5、SR7遗传稳定性测定(g/L)Table 2 The results of genetic stability of the mutation stain SR3、SR5、SR7(g/L)
2.3 X射线突变菌的筛选
2.3.1 初筛 将经X射线诱变处理的菌悬液适当稀释,按照1.2.3初筛的方法,初筛结果见表1。为了实验的可靠性和重复性,再对其做了发酵产酸测定(图3)。结果SR7的HC值高于原始的5.4%,发酵产酸也达到了23.35g/L,有显著差异(p<0.001)。则根据表1和图3挑选出HC值比出发菌株SR0大并产酸能力强的3株(S3、S5、S7)单菌落挑取保藏,以便进行下一步发酵实验。
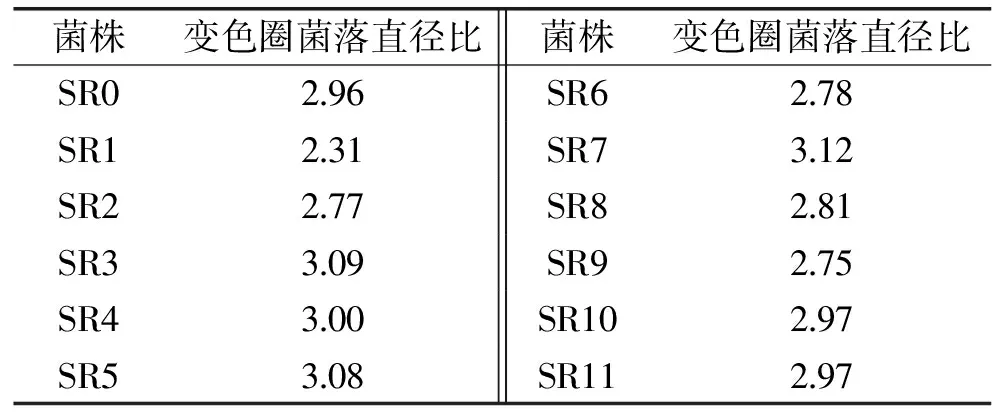
表1 嗜热乳杆菌的平板初筛Table 1 Screening results ofLactobacillus thermophilus with plate
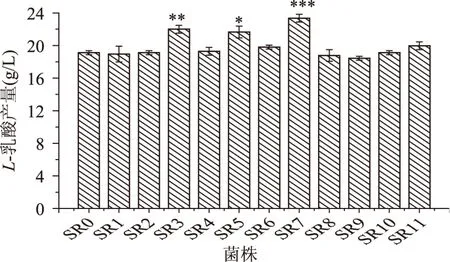
图3 菌株的产酸筛选Fig.3 The strains screening of acid production注:不同数量的*表示差异显著, *p<0.05,**p<0.01,***p<0.001;图4、表2同。
2.3.2 复筛 综上可见,将挑选出的SR3、SR5、SR7突变株进行重复发酵实验。按照1.2.3复筛的方法,得到突变菌株的产酸如图4。由图4可见,SR7突变菌株的产酸量比原始菌株有显著的提高。
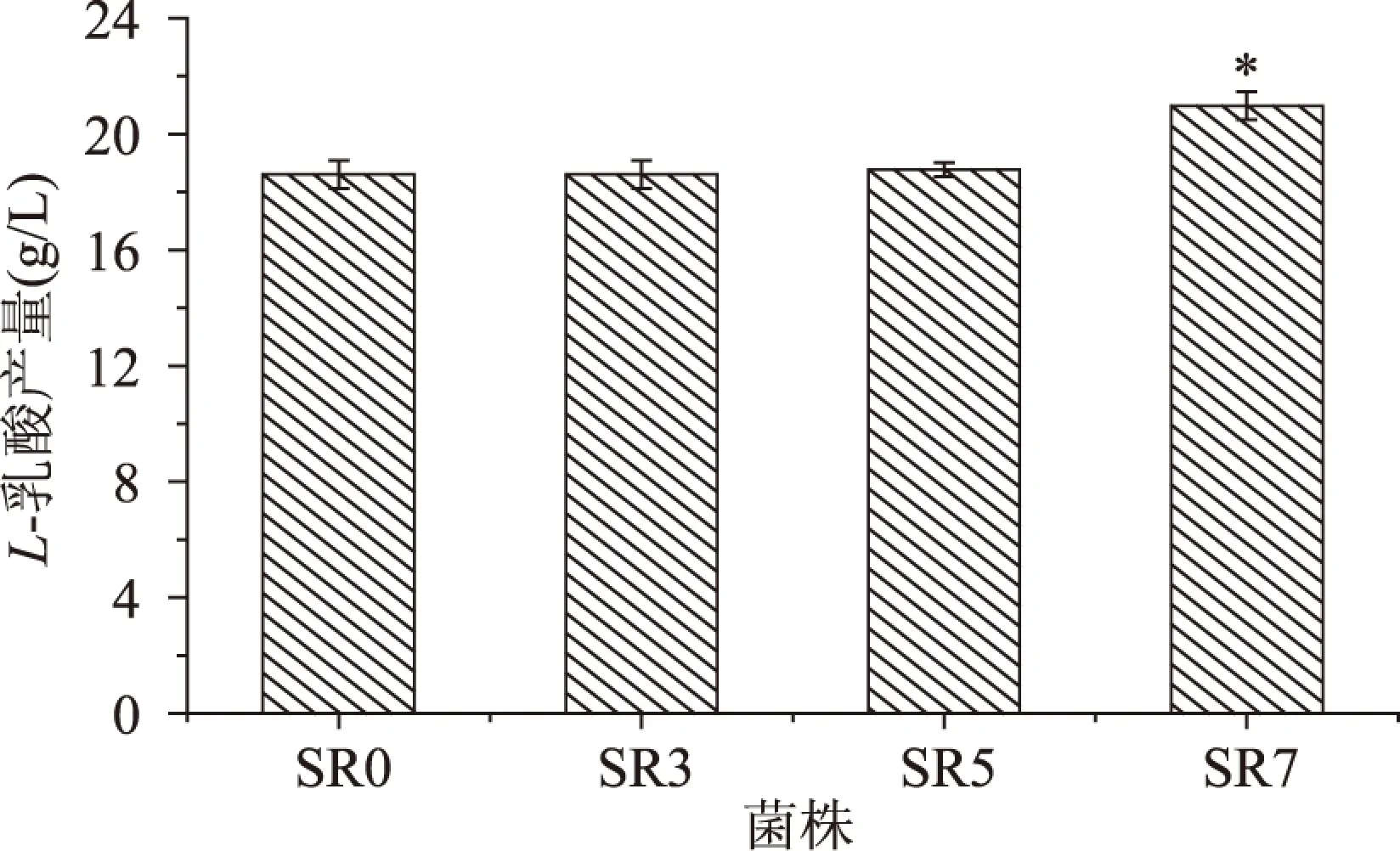
图4 菌株的产酸筛选Fig.4 The strains screening of acid production
2.4 突变株稳定性测定
将以上3个突变株连续传代7次,每隔一代分别进行发酵产酸实验,测定L-乳酸含量,结果见表2。从表2可以看出,SR3和SR5突变株的产酸稳定性不好,而SR7经过7次传代,L-乳酸产量变化不大,说明突变株SR7有稳定的产酸遗传特性。原始菌株L-乳酸产量平均为19.12g/L,SR7突变菌株的L-乳酸产量平均为22g/L,比原始菌株产酸率提高了15.04%。
3 结论
本实验通过对原始菌株SR0进行X射线诱变,经初筛、复筛,筛选得到一株稳定的、高产L-乳酸的嗜热乳杆菌的突变菌株SR7,其L-乳酸产量从最初的19.12g/L提高到22g/L,产率提高了15.04%,连续传代7次其L-乳酸产量变化不大,表明该突变菌株具有较好的遗传稳定性,这为利用该菌进行L-乳酸工业化生产奠定了一定的基础。
[1]Abdel-Rahman MA,Tashiro Y,Sonomoto K. Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria:overview and limits[J]. Journal of biotechnology,2011,156(4):286-301.
[2]Nguyen CM,Choi GJ,Choi YH,etal. d-and l-lactic acid production from fresh sweet potato through simultaneous saccharification and fermentation[J]. Biochemical Engineering Journal,2013,81:40-46.
[3]Mattey M. The production of organic acids[J]. Critical reviews in biotechnology,1992,12(1-2):87-132.
[4]Gao C,Ma C,Xu P. Biotechnological routes based on lactic acid production from biomass[J]. Biotechnology advances,2011,29(6):930-939.
[5]Ma K,Maeda T,You H,etal. Open fermentative production of l-lactic acid with high optical purity by thermophilic Bacillus coagulans using excess sludge as nutrient[J]. Bioresource technology,2014,151:28-35.
[6]Lu Z,He F,Shi Y,etal. Fermentative production of L(+)-lactic acid using hydrolyzed acorn starch,persimmon juice and wheat bran hydrolysate as nutrients[J]. Bioresource technology,2010,101(10):3642-3648.
[7]张秀凤,李正英,江均平. 细菌L-乳酸发酵的研究[J]. 食品与机械,2005,21(5):74-76.
[8]仇俊鹏,徐岩,阮文权,等. L-乳酸发酵的代谢调控育种及发酵影响因素的研究[J]. 微生物学通报,2007,34(5):929.
[9]鲁明波,曾翔,张力,等. 紫外线诱变和恒化器培养筛选耐高温的高产乳酸菌[J]. 微生物学通报,2010,37(4):520-523.
[10]蔡聪,姜婷,郑兆娟,等. 离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸[J]. 食品科学,2014,35(1):4.
[11]严建民,高美须,冯敏,等. 辐照食品的卫生安全性研究现状[J]. 核农学报,2010,24(1):88-92.
[12]罗水忠. 基于同步辐射软X射线诱变的产L-乳酸米根霉育种研究[D]. 安徽:合肥工业大学,2012.
[13]陈亮,蒋诗平,万里飚,等. 曲酸生产菌的同步辐射软X射线诱变选育和发酵动力学研究[J]. 辐射研究与辐射工艺学报,2006,24(5):310.
[14]Ramyasree S,Dutta JR. The effect of process parameters in enhancement of lipase production by co-culture of lactic acid bacteria and their mutagenesis study[J]. Biocatalysis and Agricultural Biotechnology,2013,2(4):393-398.
[15]朱朝阳. L-乳酸高产菌株的诱变选育[D].洛阳:河南科技大学,2011.
[16]侯艳梅,江均平,蒋立文. 利用木糖生产L-乳酸高产菌太空诱变育种[J]. 食品工业科技,2008,29(2):74-75.
[17]杜连祥,路福平主编. 微生物实验技术[M]. 北京:中国轻工业出版社,1992:111-114.
[18]李元媛,高媛,蔡俊. 理化诱变提高鼠李糖乳杆菌产L-乳酸的研究[J]. 湖北农业科学,2010,49(1):70-73.
[19]诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社,1994:240-250.
[20]李栋婵,孙柏,邓天龙. EDTA容量法测定钙方法的优化研究[J]. 广东微量元素科学,2007,14(1):56-60.
Breeding study ofLactobacillusThermophilicsinduced by
X-ray forL-lactic acid productionWU Qing-hua1,2,3,CHEN Ji-hong2,3,*,ZHANG Zhen1,LI Wen-jian2,3,HU Wei2,3,WEI Zi-hao1,LIU Jing2,3,WANG Shu-yang2,3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Modern Physics,Chinese Academy of Sciences,Lanzhou 730000,China;3.Engineering Laboratory of Radiation and Mutation Breeding,Gansu Province,Lanzhou 730000,China)
In order to obtain a lactic acid bacteria strain to more suitable for industrial production and to improve the production efficiency. TheLactobacillusthermophiluswhich irradiated by X-ray were screened by calcium carbonate-bromocresol purple plate and submerged fermentation in shaking flask. The results showed that a stable high-yield mutant strain,named SR7,could produce 22g/L ofL-lactic acid on average with the yield increase of 15.04%,compared to the original strain. It was also proved that SR7 strain had good genetic stability by repeating experiments.
Lactobacillusthermophilus;L-lactic acid;mutation breeding
10.13386/j.issn1002-0306.2015.03.015
2014-04-02
吴庆华(1988-),女,硕士研究生,研究方向:营养与食品卫生学。
*通讯作者:陈积红(1965-),男,本科,高级工程师,研究方向:辐射微生物选育研究。
科技部农业科技成果转化资金项目(2013GB24910680)(2012GB24910647);国家青年基金项目(11305225)。
TS201.1
A
1002-0306(2015)03-0116-04
