基于SternVolmer与Tachiya模型分析牛血清白蛋白与花青素的相互作用
2015-06-05宋兰兰
宋兰兰,周 瑞,景 浩
(中国农业大学食品科学与营养工程学院,北京 100083)
宋兰兰,周 瑞,景 浩*
(中国农业大学食品科学与营养工程学院,北京 100083)
本文采用了荧光光谱、同步荧光光谱和紫外可见光谱的方法,研究了牛血清白蛋白与花青素在不同温度(25、30、35℃)水体系中相互作用的光谱学特征,按照Stern-Volmer和Tachiya模型分析荧光光谱数据,获得了二者反应的热力学参数和结合参数(结合常数Ka、结合位点数n),进一步分析所得结合参数的差异。结果表明,花青素对牛血清白蛋白内源荧光有猝灭作用且属于静态猝灭。根据热力学参数ΔH、ΔS的数值确定它们之间的作用力主要是静电引力。同步荧光光谱显示花青素的加入引起色氨酸荧光峰波长发生蓝移,表明二者结合位点更接近于色氨酸残基。根据Stern-Volmer得出的Ka随温度的升高而降低、n却不受温度的影响,由Tachiya得出的Ka、n均会随温度的升高而增大。由此可知,Stern-Volmer获得的结合位点数几乎不随着温度变化而变化,但由Tachiya得到的实际结合位点数随温度的升高而增大,Tachiya模型得到的结果更符合小分子与生物大分子相互作用的实际情况。
花青素,牛血清白蛋白,Tachiya模型,Stern-Volmer模型,相互作用
花青素(Anthocyanin,ACN)是由一个3碳杂环(C环)连接两个芳香环(A和B环)构成的C6-C3-C6碳骨架母核结构(图1)。由于B环各碳位上取代基的不同,可将花青素归为6类,即飞燕草色素、天竺葵色素、锦葵色素、矢车菊色素、芍药色素和牵牛花色素,其中矢车菊素在自然界中分布最广[1]。ACN的活泼酚羟基很容易被氧化成醌,因此稳定性较差[2]。ACN与乳清蛋白相互作用可使ACN的降解率明显降低[3]。因此ACN与蛋白分子的相互作用,可以降低自身氧化过程并提高稳定性。
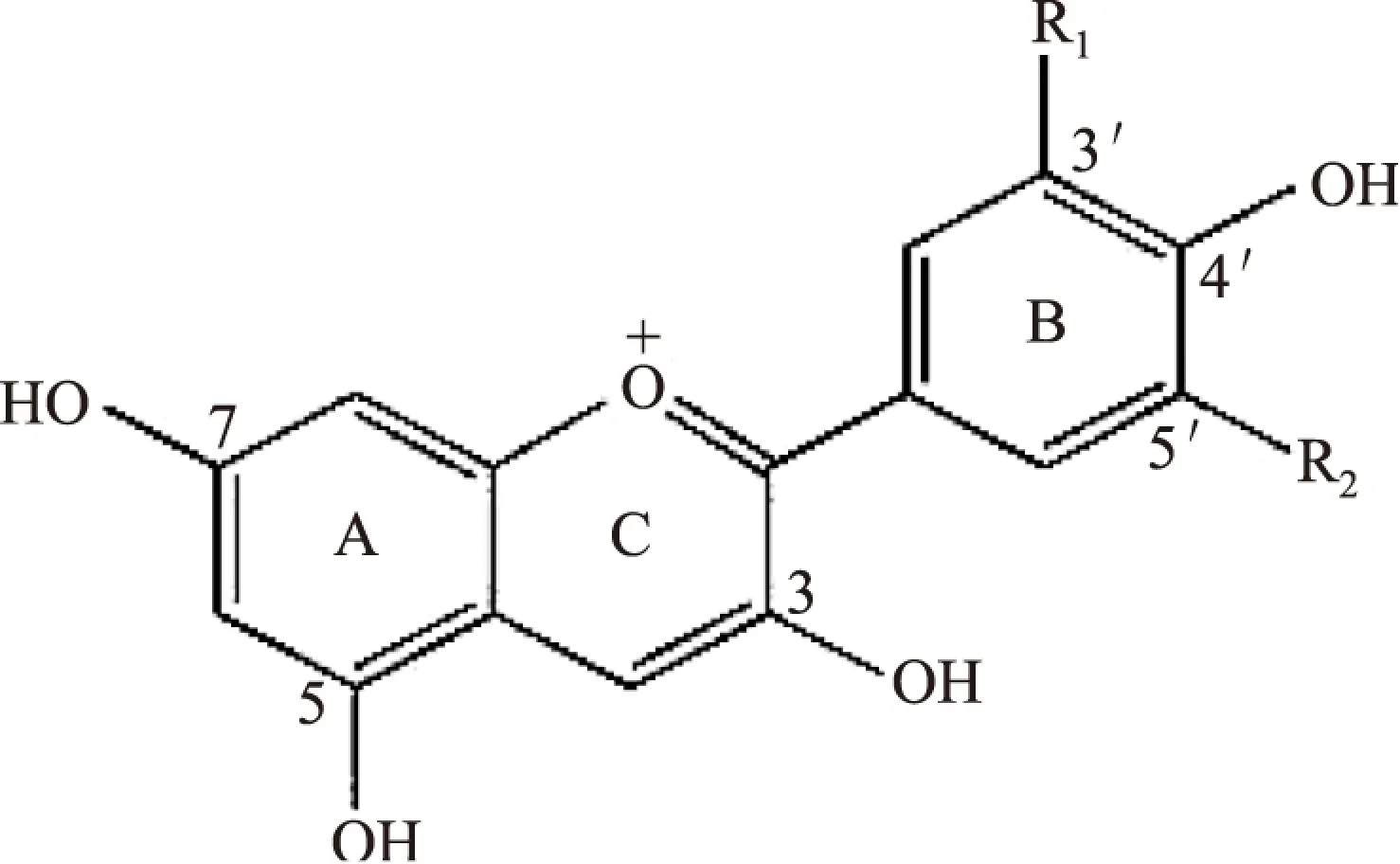
图1 花青素基本结构 Fig.1 Chemical structures of anthocyanin
采用荧光光谱法研究BSA与ACN结合的相互作用是基于BSA中三个发射荧光氨基酸残基(色氨酸、酪氨酸、苯丙氨酸)的最大波长分别为348,303,282nm。根据实验过程中ACN对BSA荧光光谱的变化,分析得到的荧光强度、发射峰特征、能量转移等指标。通过理论模型对这些指标参数的分析,计算得到结合常数、结合位点数、结合距离、作用力类型等信息,从而阐明生物大分子与小分子相互作用的方式[4]。
Stern-Volmer和Tachiya都是用于计算结合常数(Ka)和结合位点数(n)的常用理论模型,但所得参数值有可能出现偏差。分别使用这两种模型计算了BSA与金丝桃苷相互作用的n,发现Stern-Volmer计算的n值与温度有关,而Tachiya得到的n值却与温度无关[5]。本文根据这两个公式的理论基础,在水溶液中利用荧光光谱、紫外吸收光谱研究了不同温度(25、30、35℃)时,BSA与ACN之间相互作用的光谱学参数,以期为相关研究工作提供参考。
1 材料与方法
1.1 材料与仪器
牛血清白蛋白(BSA,Albumin Bovine V)第五组分纯度大于98%,分子量67200u,AMRESCO公司。笃斯越桔花青素(ACN,anthocyanin)购于大兴安岭华野生物工程有限公司(ACN含量为25%),实验中经过XAD-7树脂柱进一步纯化,得到ACN含量为35%。
F-7000型荧光光度计 日本Hitachi公司;XB 220A型电子天平 PrecisaGravimetric AG公司;pHS-3C+型酸度计 成都市纪方舟科技有限公司;UV-1800型紫外可见分光光度计 上海美普达仪器有限公司;培英THZ-C型恒温振荡器 太仓市实验设备厂;680型酶标仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 溶液配制BSA和ACN储备液配制 将BSA和ACN分别溶解于去离子水(dH2O,pH7.4)中,配成1.5×10-4mol/L和1.5×10-3mol/L的BSA和ACN储备液,保存于4℃的冰箱中备用,实验在4h内完成。移取1.0mL BSA储备溶液于15mL离心管中,再加ACN储备液,得到ACN与BSA的摩尔浓度比是0、1、2、4、6、8、10、12,并用dH2O(pH7.4)定容至10mL,用涡流振荡器混匀待用。最终BSA的浓度为1.5×10-5mol/L,ANC的浓度分别是0、1.5×10-5、3×10-5、6×10-5、9×10-5、12×10-5、15×10-5、18×10-5mol/L。以不加ACN的BSA溶液为空白。
1.2.2 紫外光谱和荧光光谱测定 精确移取3.0mL样品于石英皿中,在波长200~380nm范围内扫描其紫外吸收光谱;将样品分别在(25、30、35℃)水浴箱中保持恒温,空白为1.5×10-4mol/L的BSA溶液,移取3.0mL样品于石英皿,测定荧光光谱的条件如下:激发波长280nm,激发狭缝2.5nm,发射狭缝5nm。测定其同步荧光光谱条件如下:分别固定Δλ=15nm和Δλ=60nm。
1.3 Stern-Volmer与Tachiya的计算
1.3.1 Stern-Volmer;Stern-Volmer 常用于判断猝灭类型,且适合用于计算静态猝灭类型中的结合常数Ka和结合位点数n。用Stern-Volmer[6]进一步对荧光数据进行分析,阐明ACN与BSA相互作用的结合常数、结合位点等方面:
F0/F=KSV[Q]+1=Kqτ0[Q]+1
式(1)
式中:F0和F分别为BSA和BSA-ACN的荧光强度,KSV为动态猝灭常数,[Q]为ACN的浓度,Kq为双分子猝灭过程速率常数,τ0为没有猝灭剂存在下荧光分子平均寿命,生物大分子荧光寿命约10-8s[7]。对于猝灭过程中的Ka、n,可由(1)得知
lg[(F0-F)/F]=nlg[Q]+lgKa
式(2)
式中:n为结合位点数,[Q]为ACN的浓度,Ka为结合常数。
1.3.2 Tachiya;Tachiya等则认为一个荧光体分子上所含有的可以与猝灭剂结合的位点数可能和实际与荧光体结合的猝灭剂分子数不同,并由此得出Tachiya模型公式。利用Tachiya进一步对荧光数据进行分析,阐明ACN与BSA相互作用的结合模式,包括:结合常数、结合位点等方面[8]。
Tachiya中ACN与BSA之间的吸附与解吸可用下式表示:
Bn+Qaq→Bn+1
式(3)
Bn→Bn+1+Qaq
式(4)
式中,Qaq为猝灭剂分子ACN的浓度;Bn表示结合了n个猝灭分子的BSA。如果ACN与BSA相互作用的结合位点固定值,则ACN的分子数目遵循二项分布式:
式(5)
式中,BSA中结合的ACN的平均数目为nav:
式(6)
式中:K=k1/k2,k1是吸附速率常数,k2是解吸速率常数。若用[M]表示BSA的浓度,则加入ACN的总浓度[Q]为:
[Q]=nav[M]+[Qaq]
式(7)
联立式(6)和式(7)得到:
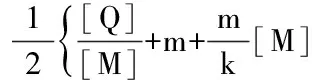
式(8)
BSA与ACN的能量转移速率常数为:
式(9)
式中:τ0为没有ACN存在时BSA的荧光寿命,r是BSA与ACN的结合距离,R0为E=50%的临界距离,此时荧光强度会变为:
式(10)
因此无论是否存在ACN,二者淬灭荧光强度的比值:
式(11)
其中:[M]、[Q]和F/F0的值可由实验确定,结合式(8)和(11),可得出m、Ka和r的值。然而当[Q]达到饱和状态时,F/F0也会饱和。BSA分子上的所有结合位点都已被ACN占用,再增加[Q]也不会增加结合数,此时荧光强度会变为:
式(12)
另外[Q]极低时,ACN与BSA结合的平均数nav很小,结合(1-8)得到:
式(13)
从而此时荧光强度为:
式(14)
1.4ANC与BSA相互作用的探讨
1.4.1ACN与BSA结合作用力的类型根据分子结构可知,蛋白质等生物大分子与有机小分子之间的作用力应当属于分子间的弱相互作用,包括氢键、范德华力、静电引力和疏水作用力等[9]。通过计算一些热力学参数,如焓变ΔH、熵变ΔS和吉布斯自由能ΔG,可以判断子蛋白质等生物大分子与有机小分之间的主要作用力。在温度变化范围不大时,作用过程的焓变ΔH随温度的改变可忽略不计,近似认为常数。相关公式如下:
ln(K2/K1)=[1/T1-1/T2]ΔH/R
式(15)
ΔG=ΔH-TΔS=-RTlnK
式(16)
可以确定ΔH、ΔS和ΔG的数值,从而判断ACN与BSA结合的作用力类型。
1.4.2ACN与BSA相互作用的结合距离 根据Förster能量转移理论[10]:
E=1-(F/F0)=R06/(R06+r6)
式(17)
式中:E是ACN与BSA之间的能量转移效率,F和F0分别为加入和未加入ACN时BSA的荧光强度,R0为E=50%时的临界距离:
R06=8.8×10-25K2n-4ΦJ
式(18)
式中:K2为偶极空间取向因子,n为介质的折射指数,Φ为BSA的荧光量子产率,J为BSA荧光光谱与ACN吸收光谱的重叠积分,可表示为:
式(19)
其中:F(λ)为荧光供体在波长λ处的荧光强度,ε(λ)为受体在波长λ处的摩尔吸光系数。由此可以确定ACN与BSA相互作用时的结合距离r。
2 结果与分析
2.1 ACN与BSA相互作用的荧光猝灭光谱
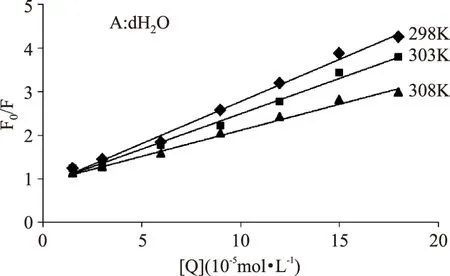
在BSA溶液中加入不同浓度的ACN溶液,随着ACN浓度的增大,BSA荧光光谱被有规律的猝灭且荧光峰从340nm红移到345nm(图1)。
蛋白分子中的色氨酸和酪氨酸均有荧光产生,但酪氨酸残基的荧光较弱,其变化很难观察到而色氨酸残基荧光很强,因此主要观察色氨酸的荧光变化。激发波长为280nm时,BSA在343nm有最大发射波长,而在304nm没有荧光峰形成。BSA荧光发生了猝灭,说明BSA分子中色氨酸残基空间位置发生了改变;而BSA荧光峰的红移说明色氨酸区域变得更加亲水[11]。ACN属于水溶性的小分子,可以与亲水的侧链残基结合,因此可以推断是位于BSA分子表面的色氨酸残基发生了位置的改变[12]。
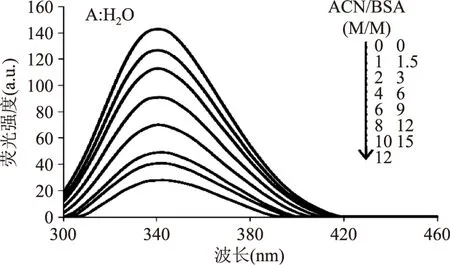
图1 不同浓度的ACN与BSA的荧光猝灭图Fig.1 Fluorescencespectra of BSA in the presence of different concentrations of ACN注:BSA:1.5×10-5mol·L-1;ACN:0,1.5×10-5, 3×10-5,6×10-5,9.0×10-5,12.0×10-5, 15.0×10-5,18.0×10-5mol·L-1.T=298K。
2.2 ACN与BSA相互作用的同步荧光光谱
BSA的浓度不变,逐渐增加ACN的浓度,测定Δλ=15 nm和Δλ=60nm时的同步荧光光谱(图2A和2B)。由图可知,随着ACN浓度的增加,酪氨酸残基和色氨酸残基的荧光强度明显减小,但酪氨酸残基的荧光峰波长没有明显变化(图2A),表明ACN对酪氨酸残基微环境几乎没有影响;而色氨酸荧光峰波长发生了从280nm到278nm的微小蓝移(图2B),表明色氨酸残基所处的微环境发生了改变,并且色氨酸残基荧光猝灭程度高于酪氨酸残基,表明ACN与BSA的结合位点更接近于色氨酸残基。
在蛋白质的同步荧光光谱中,Δλ=15nm时显示的是酪氨酸残基的光谱性质,Δλ=60nm显示的是色氨酸残基的光谱性质[13]。蛋白质中氨基酸残基的最大发射波长的变化与自身所处环境的极性有关,因此蛋白质构象的变化可通过由最大发射波长的改变来判断[14]。

图2 ACN-BSA的同步荧光光谱Fig.2 Synchronous scanning fluorescence spectra of ACN-BSA注:BSA:1.5×10-5mol·L-1;ACN:0,1.5×10-5, 3.0×10-5,6.0×10-5,9.0×10-5,12.0×10-5, 15.0×10-5,18.0×10-5mol·L-1. T=302K。
2.3 ACN与BSA结合作用力的类型
根据热力学参数之间的关系式(15)、(16)可以求得反应前后热力学焓变ΔH、熵变ΔS和吉布斯自由能ΔG的数值(表1),以此判断ACN与BSA之间的主要作用力类型[15]。

表1 不同温度下ACN与BSA作用的热力学参数Table 1 Thermodynamics constants of ACN-BSA system at different temperatures
由表1可知,BSA与ACN相互作用时,ΔG<0,ΔS>0,ΔH<0。
结果表明,ΔG<0,说明BSA与ACN的结合作用是自发过程。ΔS>0,ΔH<0,说明BSA与ACN分子间主要以静电引力相互结合[15]。
2.4 ACN与BSA相互作用的结合距离
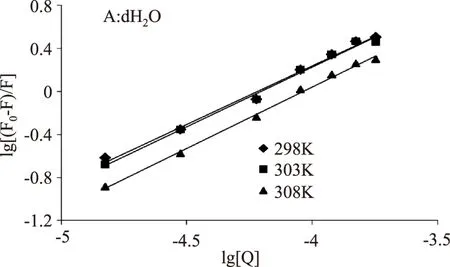
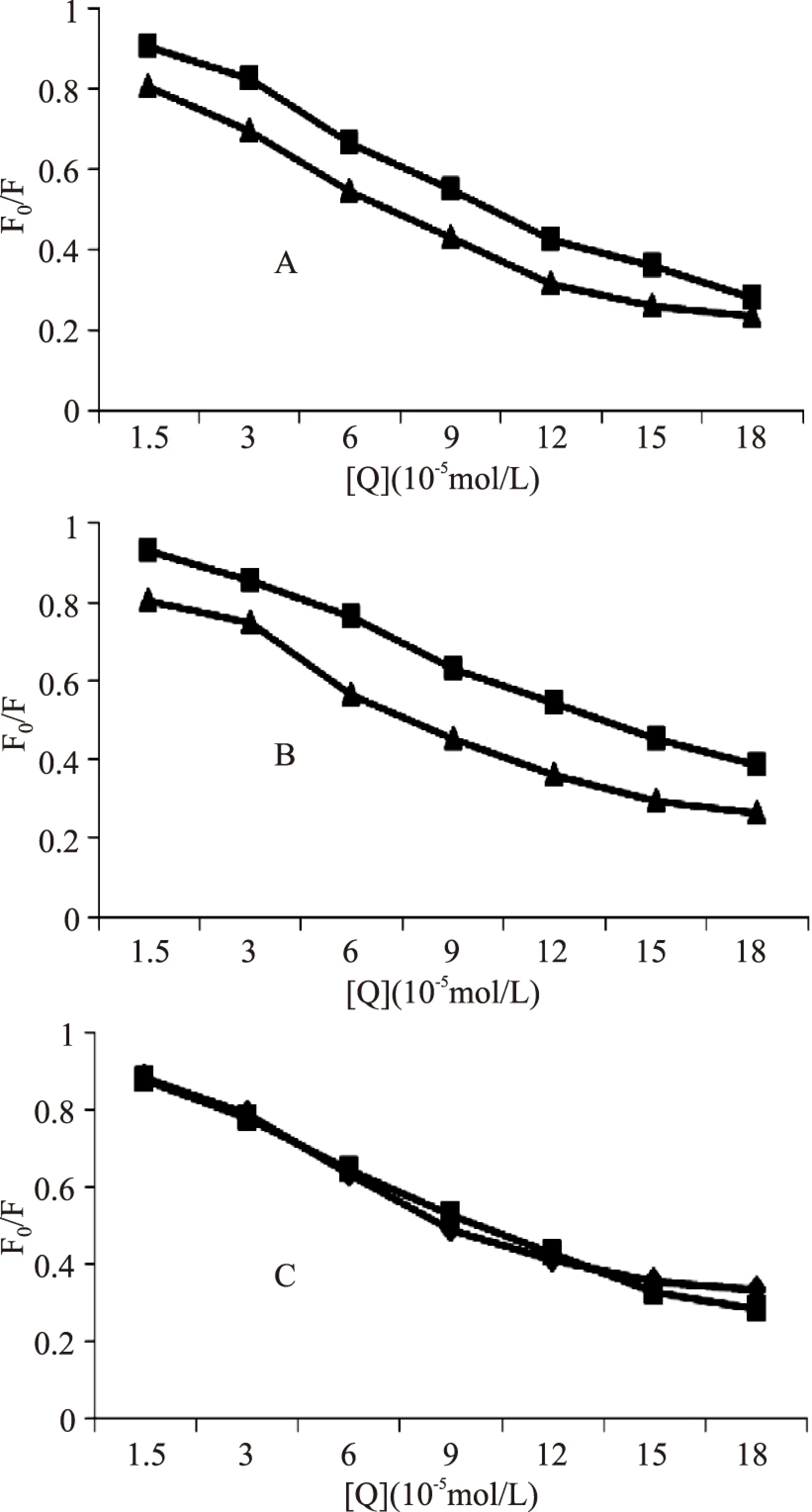
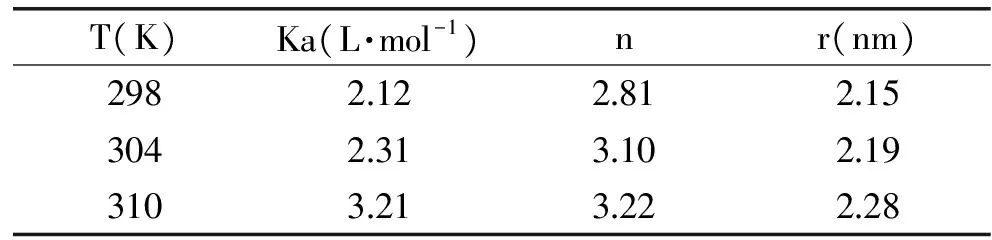
图3为BSA的荧光光谱和ACN的吸收光谱的重叠图,根据Förster能量转移理论公式可以确定J=3.69×10-154cm3·mol-1,R0=3.17nm,E=0.57。进一步可以得到r=4.02nm。
当供体蛋白的荧光发射光谱与受体小分子的吸收光谱存在一定程度的重叠,且二者间的结合距离小于7nm时,二者之间将会发生非辐射能量转移现象,从而供体蛋白发生荧光猝灭[16]。由于r<7 nm,0.5R0 图3 ACN的吸收光谱和BSA的荧光光谱Fig.3 UV-Vis absorption spectrum of Anthocyanin and fluorescence emission spectrum of BSA注:BSA:1.5×10-5mol·L-1, ACN:1.5×10-5 mol·L-1,T=298K。 2.5 不同计算公式探究ACN与BSA的相互作用 2.5.1 探究荧光猝灭机理及猝灭常数KSV根据Stern-Volmer作出F0/F-[Q]关系图并计算出不同温度下的动态猝灭常数KSV(图4和表2)。 图4 ACN与BSA作用的Stern-Volmer图Fig.4 Stern-Volmer graph of ACN with BSA at different temperatures注:F0和F分别为BSA和BSA-ACN的荧光强度; [Q]为ACN的浓度:1.5×10-5,3.0×10-5,6.0×10-5, 9.0×10-5,12.0×10-5,15.0×10-5,18.0×10-5mol·L-1。 表2 ACN-BSA的Stern-Volmer猝灭常数Table 2 Stern-Volmer constants of interaction between ACN and BSA 注:BSA:1.5×10-5mol·L-1;ACN:1.5×10-5、3.0×10-5、6.0×10-5、9×10-5、12×10-5、15×10-5、18×10-5mol/L。 表3 不同温度下ACN与BSA作用的n和KaTable 3 Then and Ka of BSA-anthocyanin system at different temperature 注:BSA:1.5×10-5mol·L-1;ACN:1.5×10-5、3.0×10-5、6.0×10-5、9×10-5、12×10-5、15×10-5、18×10-5mol/L。 从表2的数据看出,随着温度的升高,ACN与BSA相互作用的动态猝灭常数KSV值在减小,表明该猝灭机理为静态猝灭[18]。然而Tachiya模型不能对二者的荧光数据进行猝灭机理的研究。 2. 5.2 探究结合常数Ka、结合位点数n及结合距离r 2.5.2.1 结合参数(Ka、n、r)的确定 图5中直线的斜率即n,截距即lgKa,根据斜率和截距即可计算出不同温度下的Ka(见表3)。 图5 ACN-BSA体系的 lg[(F0-F)/F]对lg[Q]图Fig.5 Plots of lg[([(F0-F)/F]-lg[Q] for ACN-BSA system at different temperatures注:F0和F分别为BSA和BSA-ACN的荧光强度; [Q]为ACN的浓度:1.5×10-5,3.0×10-5,6.0×10-5, 9.0×10-5,12.0×10-5,15.0×10-5,18.0×10-5mol·L-1。 由表3的数据看出,ACN与BSA相互作用的Ka随着温度的升高而降低。这是因为升高温度后ACN与BSA的结合能力减弱了;而二者的n几乎不随温度的变化而变化,且接近于1,表明ACN与BSA相互作用后形成1∶1的静态配合物[19]。 2.5.2.2 结合参数(Ka、n、r)的确定 通过Tachiya模型可知,当[Q]足够低时,F/F0与[Q]成比例,且Ka、r和[M]决定其比例系数。因此通过测量两个不同[M]值时的F/F0与[Q]的曲线,可以确定Ka、r的值。 由图6得到BSA与ACN相互作用的Ka、n如表4所示: 图6 不同温度时的Q-F0/F关系图 Fig.6 Curves of F/F0 versus concentration of ACN at different temperatures注:A.298K,B.303K,C.308K。 由表4可知:由Tachiya模型得到的Ka、n均随温度的升高而增大。 结果表明,在Stern-Volmer和Tachiya模型得到的r均小于7nm,表明小分子的部分片段能够插入BSA分子内部[20],因此非辐射能量转移是引起荧光猝灭的原因之一。通过Tachiya计算所得的Ka随温度的升高而增大,而Stern-Volmer得到的Ka随温度的升高而降低;Stern-Volmer得到的n几乎不随温度的变化而变化,但Tachiya所得n随温度的升高而增大。因此使用两个模型计算所得结合参数(Ka、n)有明显差别。 表4 Tachiya模型得到ACN-BSA相互作用的KaTable 4 The binding parameters of ACN-BSA system by Tachiya model 这主要是Tachiya模型考虑到了理论结合位点数m与实际结合位点数n的差异,当猝灭剂浓度[Q]达到饱和状态时,荧光生物大分子(P)上的所有结合位点都已被猝灭剂占用,再增加[Q]也不会增加结合数[21];而当[Q]极低时,与 P结合的平均数很小,这两种情况下得到的荧光强度是不同的,而Stern-Volmer则假定m即是小分子实际结合在蛋白质上的数量n,只能采用相同的荧光强度,这可能并不符合实际情况。因此Tachiya模型更符合生物大分子与小分子相互作用的实际情况[22]。 花青素对牛血清白蛋白的荧光存在较强的静态猝灭作用,静电引力是其主要作用力,二者的结合位点更接近于色氨酸残基。根据Stern-Volmer和Tachiya模型所得结合距离r均小于7nm,而结合常数(Ka、n)与温度的关系却有很大的差异。Stern-Volmer得到的n几乎不随温度的变化而变化,但Tachiya所得n随温度的升高而增大。这主要是由于两种理论模型对理论结合位点数m与实际结合位点数n进行了不同处理分析,Tachiya模型将理论结合位点数m与实际结合位点数n进行了区别比较分析。而Stern-Volmer方程则假定m即是小分子实际结合在蛋白质上的数量n,这可能并不符合实际情况。因此Tachiya模型更符合小分子与生物大分子相互作用的实际情况。 [1]Rao AV,Snyder DM. Raspberries and human health:A review[J]. Journal of Agricultural and Food Chemistry,2010,58:3871-3883. [2]Satue-Gracia MT,Heinonen M,Frankel EN. Anthocyanins as antioxidantson human low-density lipoproteinand lecithin-liposome systems[J].Journal of Agricultural and Food Chemistry,1997,45(9):3362-3367. [3]Betz M,Kulozik U. Microencapsulation of bioactive bilberry anthocyanin by means of whey protein gels[J]. International Dairy Journal,2011,21:703-710. [4]俞天智,杨汝栋.芦丁与血清白蛋白的作用研究[J].光谱学与光谱分析,2003,23(4):763-765. [5]Qin Y,Zhang Y X,Yan S L,etal. A comparison study on the interaction of hyperacid and bovine serum albumin with Tachiya mod and Stern-Volmer equation[J].Spectrochim Acta A,2010,75(5):1506-1510. [6]尚永辉,李华,孙家娟.荧光光谱法研究木犀草素,芹菜素或葛根素与牛血清白蛋白的相互作用机理[J].理化检验-化学分册,2011,47(2):186-190. [7]李蔚博,张国文,潘军辉,等. 呋喃唑酮与牛血清白蛋白相互作用的荧光光谱[J]. 南昌大学学报:理科版,2010,34(6):566-570. [8]柳全文,徐慧,李桂华,等. 咖啡酸与牛血清白蛋白相互作用的荧光光谱法研究[J].食品科学,2010,31(1):24-28. [9]方茹,冷小京,吴夏.三种蛋白和黄酮结合物中氢键与黄酮稳定性相关性分析的研究[J].光谱学与光谱分析,2012,32(1):108-112. [10]姚慧芳.牛血清白蛋白与花青素相互作用机理及其自组装形成纳米颗粒的特性研究[D].北京:中国农业大学,2012. [11]刘雪峰,夏咏梅,方云,等. 三种香豆素类重要小分子与牛血清白蛋白的相互作用[J]. 化学学报,2004,62(16):1484-1490. [12]Tian J,Zhao Y,Liu X,etal.A steady-state and time-resolved fluorescence,circular dichroic study on the binding of myricetin tobovine serum albumin[J]. Luminescence,2009,24:386-393. [13]Zhang M,LiF,Wang J,etal. Spectroscopic and electrochemical studies on the interaction of an inclusion complex of β-cyclodextrin/fullerene with bovine serum albumin in aqueous solution[J]. Journal of Photochemical and Photobiology A:Chemistry,2012,1(15):28-37. [14]ChenX,Sun ZF,Yao XJ.Fluorescence study on the interaction of human serum albumin with loureirin[J]. Spectroscopy,2010,24:547-557. [15]Ross PD,Subramanian S. Thermodynamics of protein association reactions:forces contributing to stability[J]. Biochemistry,1981,20(11):3096-3102. [16]田建袅,谢余寰,赵彦春,等. 光谱法研究迷迭香酸和牛血清白蛋白的相互作用[J].化学试剂,2010,32(4):311-314. [17]王宁,刘忠英,胡秀丽,等.黄岑类药物与人血清白蛋白的相互作用[J].高等学校化学学报,2011,32(2):241-245. [18]Chen C,Ma M,Zhang J,etal. Spectroscopic investigation of the interaction of bovine serum albumin with a novel cardiac agent V-09[J]. Spectroscopy,2008,22(1):43-50. [19]梁彦秋,臧树良,赵雪,等.领苯二酚与牛血清白蛋白的相互作用[J].化学研究与应用,2009,2(21):155-158. [20]张冰卫,李博,夏文水.用荧光光谱法研究分子间结合常数和结合位点数时公式选择[J].药学进展,2011,35(7):296-303. [21]陶慧琳,黎舒怀,徐铭泽,等. 山奈素与牛血清白蛋白相互作用:Tachiya模型与Stern-Volmer方程的对比研究[J]. 分析测试学报,2013,32(2):186-192. [22]Qin Y,Zhang YX,etal. A comparison study on the interaction of hyperoside and bovine serum albuminwith Tachiya model and Stern-Volmer equation,2010,75:1506-1510. Study on the Anthocyanin and Bovine Serum Albumin interactionbased on Stern-Volmer Equation and Tachiya model SONG Lan-lan,ZHOU Rui,JING Hao* (College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China) The spectroscopic characteristics of BSA and ACN interaction with the different temperatures(25,30,35℃)in water system was investigated,using the fluorescence,synchronous fluorescence and UVvisible spectroscopy. The thermodynamic and the binding parameters(binding constants,binding distance and number of binding sites)of BSA and ACN interaction under different temperature were obtained from the Tachiya model and Stern-Volmer equation,respectively. The results showed that the intrinsicfluorescence intensity of BSA was quenched by CAN and the quenching type was static quenching. The magnitude of thermodynamic parameters ΔH,ΔS for the interaction at different temperatures indicated that the electrostatic interactions played a main role in the binding of ACN to BSA. The synchronous fluorescence spectra of BSA showed that the maximum absorption wavelength of tryptophan residue shifted toward the short wavelength direction caused by the addition of ACN,indicating that the two binding sites closer to the tryptophan residues. According to Stern-Volmer equation,the binding constant decreased as the temperature increased. The number of binding siteswas not affected by temperature. Based on the Tachiya model,the binding constant and binding sites would increase with the increase of temperature.Therefore,the number of binding sitesis hardlychanges with the temperature obtained by Stern-Volmer,butthe actualnumber of binding sites increased with the increase of temperature obtained by Tachiya. So the Tachiya model could be more in line with the actual situation of the interaction between small molecule and biological macromolecule. Anthocyanin;Bovine serum albumin;Tachiya model;Stern-Volmer equation;Interaction 2014-04-2 宋兰兰(1989-),女,硕士研究生,研究方向:蛋白与活性小分子物质的相互作用。 *通讯作者:景浩(1957-),男,博士,教授,研究方向:分子营养与食品安全。 国家自然科学基金项目(31171676)。 TS201.2 A 1002-0306(2015)03-0099-06 10.13386/j.issn1002-0306.2015.03.012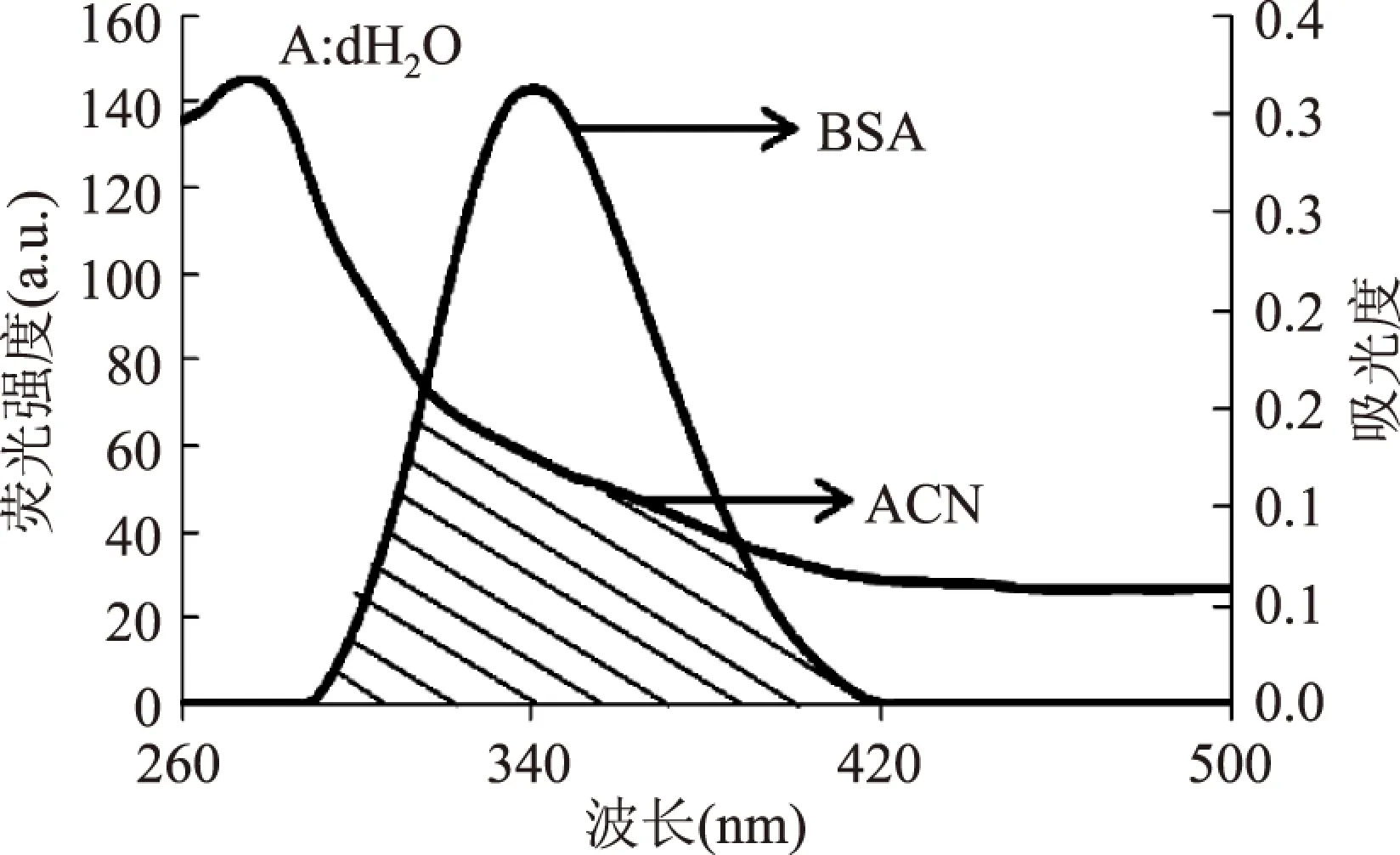

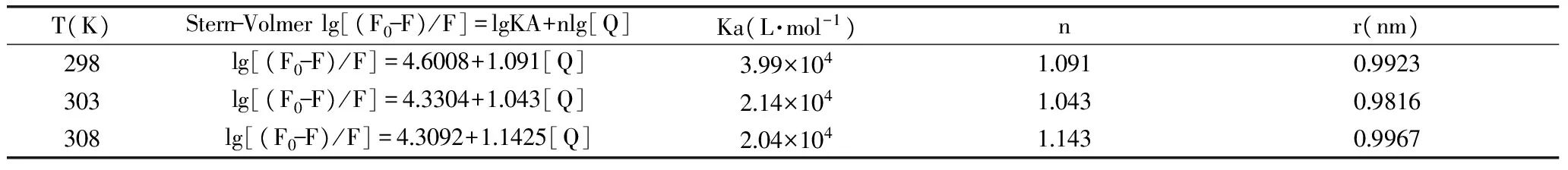
3 讨论
4 结论
