Prohibitin2在脊髓损伤过程中的表达变化*
2015-05-20王玲玲崔志明徐冠华保国锋孙郁雨张金龙
王玲玲,崔志明,徐冠华,保国锋,孙郁雨,张金龙
(南通大学第二附属医院脊柱外科,江苏226001)
Prohibitin2(PHB2)是一种在真核细胞中广泛表达并且在进化过程中高度保守的蛋白,研究显示PHB2参与细胞周期调节、细胞生存、转录调节、细胞凋亡、线粒体形态形成、信号转导等多种过程[1]。目前对PHB2蛋白的研究主要集中在与肿瘤发生发展的关系方面,而它在中枢神经系统损伤及修复过程中是否发挥作用,鲜有报道。本研究通过建立大鼠脊髓损伤模型,检测PHB2蛋白在脊髓损伤过程中表达变化,以探讨其在脊髓损伤过程中的可能作用。
1 材料和方法
1.1 动物模型 56只雌性SD大鼠,体重220~250g,随机分为1个正常对照组和6个实验组,每组各8只。采用10%水合氯醛(200mg/kg)腹腔注射麻醉,暴露T12节段脊髓。实验组按Allen打击法,以一根光滑金属棒(直径4mm,重10g)从距脊髓表面10cm高处自由下落,撞击脊髓致大鼠下肢完全瘫痪,缝合皮肤。术后维持室温20℃~28℃,每天挤压膀胱排尿两次直至恢复自主排尿,饮水、饲料及光照不限。对照组只暴露T12节段脊髓而不致伤脊髓,其余处理与实验组相同。
1.2 主要试剂 兔抗鼠Prohibitin2抗体(Sc-67045,Santa Cruz),DAB 显色剂(北京中山生物技术有限公司)。β-actin单抗、HRP标记的山羊抗兔IgG以及HRP标记的山羊抗小鼠IgG(均Sigma公司)。
1.3 组织固定、取材和切片 伤后6h、1d、3d、5d、7d和14d分别用同样方法将将实验组大鼠麻醉后,生理盐水心内灌流后用4%多聚甲醛灌注,以损伤脊髓节段为中心,取长约10mm标本。对照组均在脊髓暴露24h后经灌注固定,取同样长度脊髓标本。所有取出脊髓组织均用4%多聚甲醛固定4h,之后置于30%蔗糖PBS溶液,待组织下沉后做10μm厚的冰冻切片待用。
1.4 Western blot提取脊髓蛋白质样品,在10%SDS0PAGE凝胶中电泳分离,将蛋白质转移至PVDF膜后置于含5%脱脂奶粉的TBST缓冲液,37℃条件下封闭2h,加入一抗(兔抗人Prohibitin2抗体或者β-actin单抗),4℃孵育过夜,二抗(辣根过氧化物酶标记的羊抗兔IgG),37℃作用2h,然后行化学荧光法(ECL)显色并观察。
1.5 免疫组织化学 取受伤后1d、3d和14d三个时间点,损伤脊髓组织头端和尾端2mm处组织进行免疫组织化学染色。将取出的脊髓组织依次放入20%及30%蔗糖溶液内梯度脱水,制成14μm厚的冰冻切片。将切片置于3%甲醇-H2O2溶液,37℃条件下孵育30min,然后用PBS洗3次,置于二抗血清封闭液中室温孵育2h,吸除多余封闭液,滴加一抗后室温孵育1h,接着4℃下过夜,再滴加二抗,37℃下孵育1h后滴加卵白素-生物素-过氧化物酶复合物,继续37℃下孵育40min,DAB显色。最后用苏木素进行复染,脱水、透明、封片。以PBS代替一抗作为阴性对照。光镜下进行阳性细胞计数,具有强和中等棕褐色着色的细胞记为阳性。
1.6 统计学处理 采用SPSS 13.0统计软件对数据进行分析,采用t检验对免疫组化阳性细胞数进行组间差异性比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 脊髓损伤后Prohibitin2蛋白表达变化 取对照组和实验组脊髓组织,进行蛋白表达检测。Western blot结果显示,脊髓损伤后,PHB2蛋白表达从6h开始迅速下降,持续至3d,之后逐渐上升,于14d后接近正常水平(图1)。
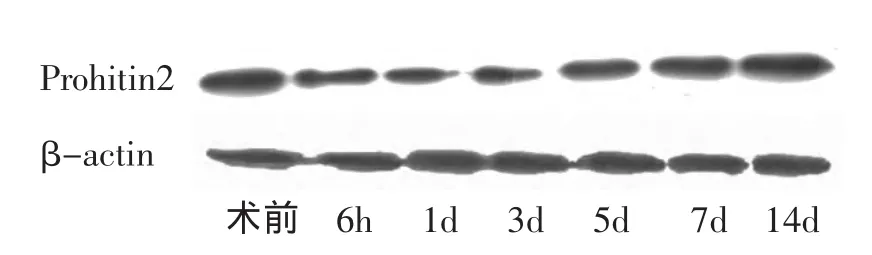
图1 prohibitin2的表达变化
2.2 免疫组织化学分析 结果显示,PHB2在正常脊髓灰质和白质中均有表达,且分布较为均匀。挫伤后第1d,PHB2阳性细胞数的表达在灰质和白质中的表达均有下降,伤后3d,阳性细胞数在脊髓灰质和白质中的表达均明显下降。挫伤后第14d,阳性细胞数在脊髓灰质和白质中均有明显恢复(图2、3),阳性细胞数伤后1d及3d与对照组相比差异均有统计学意义(P<0.05)。

图2 prohibitin2免疫组化

图3 不同时间阳性细胞计数直方图
3 讨 论
脊髓急性损伤后,损伤区髓鞘和轴突崩解破坏,胶质细胞增生活跃,疤痕增生。随后损伤近段的轴突出芽、延伸,在这个神经纤维再生修复的过程中,会涉及到细胞的再生及再生过程中一些细胞周期蛋白的调节作用[2]。
PHB2是细胞的一种多功能蛋白质,是在真核细胞中广泛表达并且在进化过程中高度保守的蛋白,参与细胞的多种生命活动,它最初做为与鼠的B淋巴细胞的IgM受体相互作用蛋白而被Terashima及其同事们发现。研究发现,PHB2蛋白是以复合物的形式定位于线粒体[3]。同时,PHB2被发现可以借助其羧基端的结构域定位在细胞核内,所以PHB2蛋白被认为很有可能是活动于线粒体与细胞核之间的一种蛋白[4-5]。研究显示PHB2参与细胞周期调节、细胞生存、转录调节、细胞凋亡、线粒体形态形成、信号转导等多种过程[6-8]。主要表现在PHB2能抑制细胞增殖,这种作用是细胞周期特异性的,主要在G期-S期之间发挥检查点的作用,抑制核转录因子E2F的转录活性[9]。然而,又有研究表明,PHB2是胚胎发育所必须的。敲除大鼠PHB2导致PHB1和PHB2蛋白同时缺失,会损害大鼠的胚胎成纤维细胞增殖[10]。
本实验结果显示:PHB2在脊髓灰质和白质中均匀分布,在脊髓损伤后后,PHB2的表达先降低,3d后降至最低点,后又逐渐上升,14d时接近于正常水平,而在脊髓白质和灰质中的分布也均体现了相一致的变化,即在急性脊髓损伤后,PHB2的表达出现一定的时空变化特点,从而提示其可能参与了脊髓损伤和修复过程,也就是可能通过调节相应细胞的凋亡和增殖发挥了一定作用。但具体PHB2定位于脊髓组织中何种细胞,通过何种机制发挥作用,这些是需要进一步研究的内容。
[1]Theiss AL,Sitaraman SV.The role and therapeutic potential of prohibitin in disease[J].Biochim Biophys Acta,2011,1813(6):1137-1143.
[2]Coates PJ,Nenutil R,McGregor A,et al.Mammalian prohibitin proteins respond tomitochondrial stress and decrease during cellular senescence[J].Exp Cell Res,2001,265(2):262-273.
[3]Matsuyama S,Nakano Y,Nakamura M,et al.Cloning and expression analysis of prohibitin mRNA in canine mammary tumors[J].JVetMed Sci,2015,77(1):101-104.
[4]Jia L,Yi XF,Zhang ZB,et al.Prohibitin as a novel target protein of luteinizing hormone in ovarian epithelial carcinogenesis[J].Neoplasma,2011,58(2):104-109.
[5]Artal-Sanz M,Tavernarakis N.Opposing function of mitochondrial prohibitin in aging[J].Aging(Albany NY),2010,2(12):1004-1011.
[6]Sievers C,Billig G,Gottschalk K,et al.Prohibitins are required for cancer cell proliferation and adhesion[J].PLoS One,2010,5(9):e12735.
[7]Fu P,Yang Z,Bach LA.Prohibitin-2 binding modulates insulin-like growth factor-binding protein-6 (IGFBP-6)-induced rhabdomyosarcoma cell migration[J].J Biol Chem,2013,288(41):29890-29900.
[8]Rossi L,Bonuccelli L,Iacopetti P,et al.Prohibitin 2 regulates cell proliferation and mitochondrial cristaemorphogenesis in planarian stem cells[J].Stem Cell Rev,2014,10(6):871-887.
[9]Theiss AL,Vijay-Kumar M,Obertone TS,et al.Prohibitin is a novel regulator of antioxidant response that attenuates colonic inflammation in mice[J].Gastroenterology,2009,137(1):199-208.
[10]Kasashima K,Ohta E,Kagawa Y,et al.Mitochondrial functions and estrogen receptor-dependent nuclear translocation of pleiotropic human prohibitin 2[J].JBiol Chem,2006,281(47):36401-36410.
