全脑缺血再灌注后海马EphA受体基因表达的变化特点
2015-05-20杨锦珊龙根徐莉谢敏杰王伟
杨锦珊,龙根,徐莉,谢敏杰,王伟
全脑缺血再灌注后海马EphA受体基因表达的变化特点
杨锦珊1,2,龙根1,徐莉1,谢敏杰1,王伟1
目的:观察EphA受体在海马全脑缺血再灌注后基因表达的改变。方法:SD大鼠50只随机分为假手术组10只及全脑缺血再灌注组40只,Pulsinelli四血管阻断法建立全脑缺血再灌注模型,采用半定量RT-PCR观察假手术组及缺血组在缺血后不同时间点(6 h、1 d、3 d、7d)EphA受体mRNA含量变化的情况,免疫荧光双标法检测EphA4受体在海马的细胞定位。结果:EphA1-A8及EphA10 RNA在正常海马组织均有表达,EphA4受体含量多。在缺血状态下,EphA1、EphA2、EphA3、EphA6、EphA7及EphA8的mRNA表达水平一过性上调,EphA4、EphA5和EphA10的mRNA表达水平逐步上调;EphA4受体亦是缺血后变化最显著的EphA受体。免疫荧光双标显示EphA4主要分布于海马CA1-CA3区及DG区NeuN阳性锥体神经元。结论:在海马不同的EphA受体对缺血呈现出不同的应答模式,EphA4是海马正常条件下表达最为丰富的EphA受体并且在缺血条件下出现最为显著地表达变化。EphA4受体主要分布于海马CA1-CA3区以及DG区NeuN阳性锥体神经元。
EphA受体;短暂性全脑缺血模型;海马;EphA4受体;锥体神经元
Eph受体家族是目前已知最大的受体蛋白酪氨酸激酶家族,目前在哺乳动物中发现表达的有14种,根据其序列同源性及与配体亲和力分为2个亚家族:EphA(EphA1~EphA8,EphA10)和EphB(EphB1~EphB4,EphB6)。其中EphA主要与依靠GPI锚定于细胞表面蛋白ephrin-A(ephrinA1-A5)结合,而EphB主要与跨膜蛋白ephrin(ephrinB1-B3)结合[1,2]。Eph受体及其配体ephrin构成的信号系统的特殊性在于两者之间的相互作用能同时起始双向的信号传递[3]。既往研究主要聚焦于Eph/ephrin信号系统在胚胎期中枢神经系统内的作用,新近研究发现EphA/ephrin-A信号系统在成年后也持续表达于中枢神经系统,并参与介导调节细胞增殖、迁移、轴突导向、血管生成、突触可塑性及神经再生等病理生理过程[4-6]。此外,Eph受体的表达因不同的组织而异,并随着不同的病理生理过程发生动态改变。
本研究建立全脑缺血再灌注模型,半定量RT-PCR观察缺血后不同时间点EphA受体mRNA表达水平变化的情况,免疫荧光双标法观察EphA4在海马的定位。为进一步探索EphA4在缺血后的病理过程中所扮演的角色提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物雄性SD大鼠50只,体质量260~310 g,由华中科技大学同济医学院动物实验中心提供。
1.1.2 主要试剂与材料甲苯胺蓝购自美国Amresco公司,TrizoL RNA抽提剂购自美国Invitrogen公司,DEPC处理水购自美国Amresco公司,PCR引物合成自上海生工生物工程有限公司,RT-PCR试剂盒及DNA marker购自美国Fermentas公司,GelRed核酸染料购自美国Biotium公司。小鼠抗大鼠NeuN抗体购自美国Millipore公司,兔抗大鼠EphA4抗体购自美国Abcam公司,山羊抗兔Cy3,山羊抗小鼠FITC购自美国Jackson ImmunoResearch公司。化学试剂均购自中国国药集团化学试剂有限公司。1-FR型动物手术显微镜购于日本Zeiss公司,激光多普勒血流仪购自英国Moor Instrument公司,台式低温离心机、分光光度计购自德国Eppendorf公司,RT-PCR使用美国Bio-Rad PCR仪,琼脂糖凝胶电泳使用美国Bio-Rad电泳仪,Gene Genius Bio-Imaging system凝胶成像仪购于美国Syngene公司,BX51荧光显微镜购于日本奥林巴斯公司。
1.2 方法
1.2.1 分组及全脑缺血再灌注模型的建立大鼠随机分为假手术组10只及缺血组40只,其中缺血组按照缺血再灌注后留取标本的时间进一步分为6 h、1 d、3 d、7 d 4个亚组,各亚组10只。参考Pulsinelli等[7]的4血管阻断法建立全脑缺血再灌注模型。6%水合氯醛腹腔麻醉(0.5 mL/100g)大鼠后做颈部正中切口,分离颈总动脉并带线,缝合颈前部切口。随后于枕骨下缘,第1~2椎骨表面做2 cm正中切口,分离椎旁肌暴露双侧翼状孔,以电凝针伸入翼状孔凝闭椎动脉,缝合颈后部切口后大鼠于短时间内清醒并能正常活动及进食。24h后再次麻醉大鼠,暴露颈前部切口以动脉夹夹闭双侧颈总动脉形成全脑缺血模型,25 min后移除动脉夹进行再灌注并缝合颈前部切口。假手术组仅切开皮肤并缝合,不做其他处理。
1.2.2 动物行为学清醒状态下夹闭双侧颈动脉,观察大鼠意识变化,眼球血色,双侧瞳孔直径、对光反射,呼吸频率及节律及翻正反射。以判断是否造模成功。
1.2.3 激光多普勒血流监测大鼠麻醉后固定于大鼠脑立体定位仪,颅顶做1 cm正中切口,暴露颅骨,前囟旁开3 mm并向后5 mm处为监测点,以牙科钻稍磨薄骨面后将激光多普勒血流仪探头置于监测点,检测局部脑血流量(regional cerebral blood flow,rCBF),调整探头位置,保证基线血流稳定并>800 PU后以速干胶固定探头。全脑缺血及再灌注全程使用激光多普勒血流仪对大鼠脑皮质血流进行监测。夹闭颈总动脉后皮质血流量下降>80%,为造模成功,数据纳入分析,否则剔除出组。
1.2.4 尼氏染色尼氏染色用于确定海马神经元丢失的情况。全脑缺血再灌注后第7天取脑,制备海马冠状位冰冻切片(厚度10 μm),各组标本取相同位置的海马切片进行尼氏染色。冰冻切片充分晾干,4%多聚甲醛后固定15 min,PBS漂洗3遍,双蒸水漂洗1遍,1%甲苯胺蓝56℃染色20 min,双蒸水冲洗终止染色,75%/ 95%/100%梯度乙醇脱水各2 min,100%乙醇分色,二甲苯透明5 min×2次,中性树胶封片。光镜下每张切片取400倍放大倍数,双侧海马总计4个视野,计数海马CA1区神经元数目。
1.2.5 半定量RT-PCR全脑缺血再灌注后各时间点处死大鼠后分离双侧海马,Trizol抽提总RNA后行RT-PCR,PCR引物序列及其扩增条件见表1。RT-PCR反应体系25 μL,操作流程参照RT-PCR试剂盒的操作手册。1.5%GelRed预染的琼脂糖凝胶用于PCR产物电泳,凝胶成像仪显像并拍照。
1.2.6 免疫荧光双标染色取海马冰冻切片充分晾干,4%多聚甲醛4℃后固定15 min,0.25%Triton-X100/PBS破膜液室温孵育15 min,10%BSA/PBS封闭1 h,4℃孵育混合一抗(兔抗大鼠EphA4抗体和小鼠抗大鼠NeuN抗体)过夜,PBS漂洗后避光孵育混合荧光二抗(FITC标记羊抗小鼠抗体和Cy3标记的羊抗兔抗体)1 h,PBS漂洗后以50%甘油封片,荧光显微镜下观察。

表1 PCR引物序列及其扩增条件
1.3 统计学处理
2 结果
2.1 全脑缺血再灌注模型的成功建立
2.1.1 动物行为学47只大鼠在双侧颈动脉夹闭后1 min内意识丧失;眼球血色减退,双侧瞳孔散大,对光反射减弱或消失;呼吸加快;翻正反射消失,造模成功。在缺血及再灌注期间出现全身强直、抽搐、瘫痪、死亡共3只,排除出组。
2.1.2 激光多普勒血流测定42只大鼠夹闭颈总动脉后皮质血流量下降>80%,为造模成功,数据纳入分析。
2.1.3 尼氏染色全脑缺血再灌注后第7天,假手术组海马CA1区神经元(80.60± 1.81)个,缺血7 d亚组海马CA1区神经元(53.20±4.43)个,差异有统计学意义(n=5,P<0.01),见图1。
2.2 假手术组海马EphA受体家族mRNA表达量
EphA1-A8及EphA10 RNA在正常的海马组织均有表达,EphA4含量高于其他受体(P<0.01);其后依次为EphA5、EphA1、EphA7及EphA8,而EphA2、EphA3、EphA6及EphA10在正常海马表达相对较低,见图2。
2.3 缺血组海马EphA受体mRNA表达量
在缺血再灌注后,EphA1-A8及EphA10的mRNA表达呈现出不同变化模式,其中EphA1、EphA2、EphA3、EphA6、EphA7及EphA8的mRNA表达在缺血再灌注后的6 h即开始出现上调,1或3 d表达到达顶峰后逐渐下降,见图3A、B;而EphA4、EphA5和EphA10的表达自缺血再灌注后6 h~7 d,其mRNA水平始终保持上升趋势,见图3A、C。
2.4 EphA4受体在海马的细胞定位
免疫荧光双标结果显示假手术组大鼠海马EphA4受体主要表达于NeuN阳性神经元,CA1-CA3区以及DG区锥体神经元表达尤为丰富,见图4。

图1 假手术组(A1-A3)及缺血7 d亚组(B1-B3)大鼠海马尼氏染色结果(光学显微镜,×40,×200,×400)
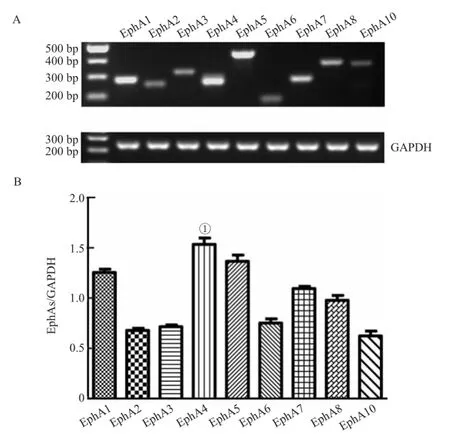
图2 假手术组海马EphA受体家族mRNA表达量
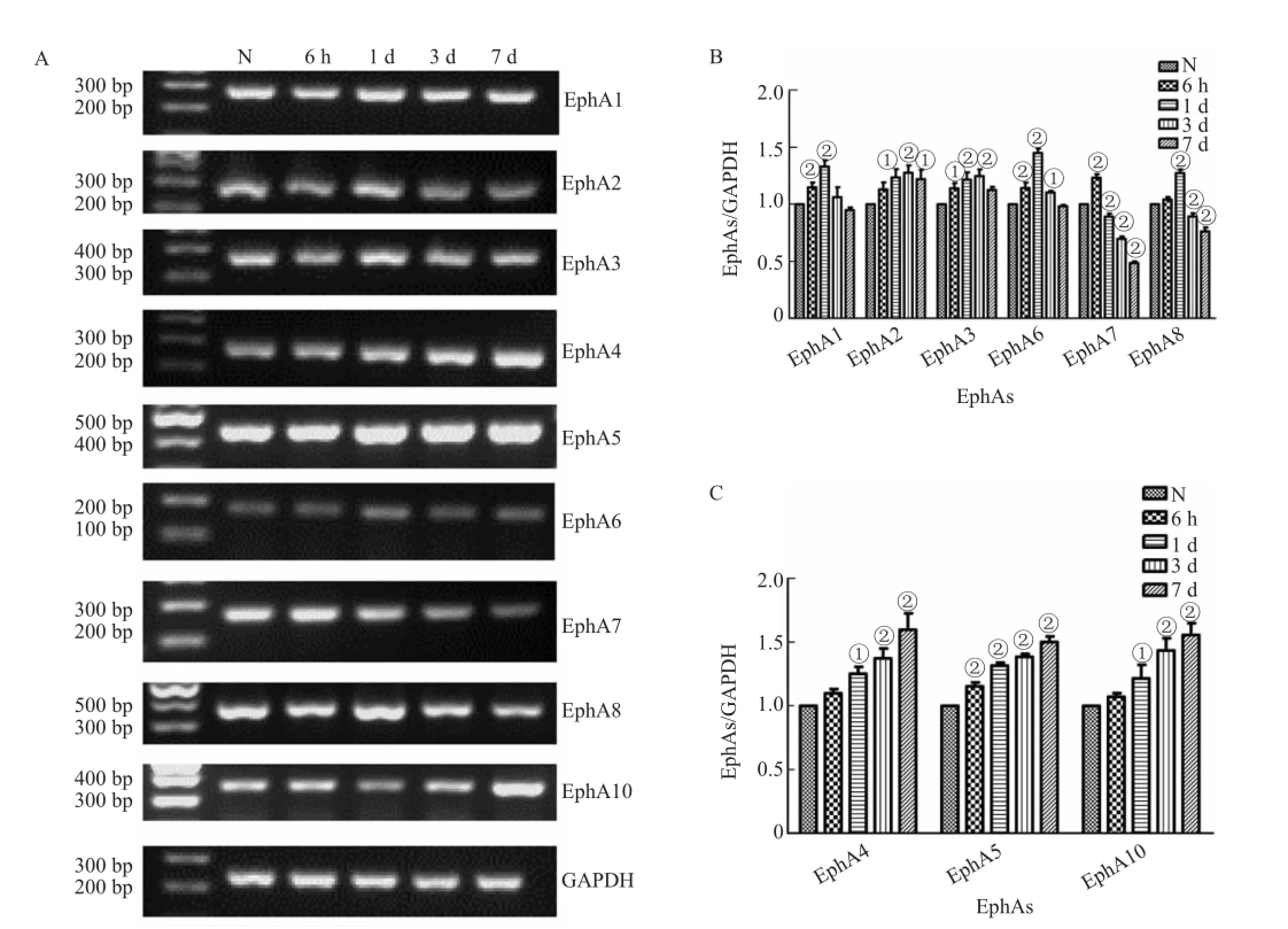
图3 缺血组海马EphA受体家族mRNA表达水平变化

图4 EphA4在正常海马的细胞定位(荧光显微镜,×40,×400)
3 讨论
Eph/ephrin的双向信号系统与传统的单向传递信号不同之处在于,ephrin配体结合于Eph受体传递经受体酪氨酸蛋白激酶途径的正向信号传导的同时,能接受来自于Eph受体向ephrin所在的细胞传导的逆向通路信号[8]。既往大部分研究将目光聚焦于Eph/ephrin在生长发育中所扮演的角色,因为这个阶段Eph受体及其配体ephrin的表达发生着显著的变化,然而在成年阶段Eph及ephrin的表达虽然显著低于生长发育期,它们仍然在中枢神经系统有着持续的表达。Eph受体及其配体ephrin表达于成年中枢神经系统的大部分区域和大部分细胞类型。虽然成年期大部分脑区Eph/ephrin的表达较生长发育期有所下调,但在部分具有高度可塑性的脑区例如杏仁核和海马Eph/ephrin的表达反而有所增加[9]。既往研究发现,Eph受体及其配体ephrin对维持中枢神经系统的细胞间联系至关重要,例如突触的形成及突触可塑性的调节[10-12],包括海马可塑性的调节[13]及脊髓疼痛过程的处理[14]。另有证据表明,表达于侧脑室室管膜下区和海马齿状回颗粒下层Eph受体及其配体ephrin通过Eph/ephrin双向信号通路对神经前体细胞的增殖与分化进行调控[15-18]。Eph/ephrin信号通路还被发现在中枢神经系统血管生成中占有一席之地[19,20]。
而在损伤后的中枢神经系统,不同的Eph受体及其相应的ephrin配体对损伤呈现出不同的应答模式,揭示了不同的Eph/ephrin在损伤后的病理生理过程中可能扮演不同角色[21-25]。
在此研究中我们观察了EphA受体家族在正常及缺血后海马组织的表达,发现EphA4是正常海马组织表达量最为丰富的EphA受体,在海马缺血后EphA4的表达改变相对于其他EphA受体亦是最显著的。
既往的研究发现,在海马,表达于神经元的EphA4与表达于星形胶质细胞的ephrin-A3所介导的神经元-胶质细胞间双向通讯一方面通过EphA4正向通路直接调节树突棘形态[13],另一方面通过ephrin-A3逆向通路对星形胶质细胞谷氨酸转运体进行调节,进而影响突触的功能和可塑性[26]。另一方面通过ephrin-A3逆向通路对星形胶质细胞谷氨酸转运体进行调节,进而影响突触的功能和可塑性。笔者此前的研究发现EphA4受体的高亲和力配体ephrin-A3是海马表达含量最为丰富的ephrin-A配体,并且神经元EphA4介导的星形胶质细胞ephrin-A3逆向通路可通过调节星形胶质细胞谷氨酸转运体的表达和星形胶质细胞谷氨酸摄取能力而影响全脑缺血再灌注后海马神经元(CA1区尤甚)的死亡,及海马依赖性空间记忆[27,28]。
此外另有研究表明,ephrin-A3介导的EphA4正向通路可通过抑制Wnt通路从而控制细胞增殖潜力[29]。因此,在今后的实验中可进一步对ephrin-A3介导的EphA4正向通路在缺血性脑血管病后损伤和修复中所起的作用进行研究。
综上所述,本研究结果描述了EphA受体在正常及缺血后海马组织的表达,发现EphA4受体海马正常及缺血状态下表达均最为丰富,为进一步研究EphA4受体及相关信号通路在海马缺血后的病理过程所扮演的角色打下基础。
[1]Murai KK,Pasquale EB.‘Eph’ective signaling:forward,reverse and crosstalk[J].J Cell Sci,2003,116:2823-2832.
[2]Klein R.Bidirectional modulation of synaptic functions by Eph/ephrin signaling[J].Nat Neurosci,2009,12:15-20.
[3]Aoto J,Chen L.Bidirectional ephrin/Eph signaling in synaptic functions[J].Brain Res, 2007,1184:72-80.
[4]FlanaganJG,VanderhaeghenP.The ephrins and Eph receptors in neural development [J].Annu Rev Neurosci,1998,21:309-345.
[5]O’Leary DD,Wilkinson DG.Eph receptors and ephrins in neural development[J].Curr Opin Neurobiol,1999,9:65-73.
[6]Wilkinson DG.Multiple roles of EPH receptors and ephrins in neural development[J]. Nat Rev Neurosci,2001,2:155-164.
[7]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10:267-272.
[8]Kullander K,Klein R.Mechanisms and functions of Eph and ephrin signalling[J].Nat Rev Mol Cell Biol,2002,3:475-486.
[9]Liebl DJ,Morris CJ,Henkemeyer M,et al. mRNA expression of ephrins and Eph receptor tyrosine kinases in the neonatal and adult mouse central nervous system[J].J Neurosci Res,2003, 71:7-22.
[10]Olivieri G,Miescher GC.Immunohistochemical localization of EphA5 in the adult human central nervous system[J].J Histochem Cytochem,1999,47:855-861.
[11]Murai KK,Pasquale EB.Can Eph receptors stimulate the mind?[J].Neuron,2002,33: 159-162.
[12]Takasu MA,Dalva MB,Zigmond RE,et al. Modulation of NMDA receptor-dependent calcium influx and gene expression through EphB receptors[J].Science,2002,295:491-495.
[13]Murai KK,Nguyen LN,Irie F,et al.Control ofhippocampaldendriticspinemorphology through ephrin-A3/EphA4 signaling[J].Nat Neurosci,2003,6:153-160.
[14]Battaglia AA,Sehayek K,Grist J,et al. EphB receptors and ephrin-B ligands regulate spinal sensory connectivity and modulate pain processing[J].Nat Neurosci,2003,6:339-340.
[15]Ricard J,Salinas J,Garcia L,etal. EphrinB3 regulates cell proliferation and survival in adult neurogenesis[J].Mol Cell Neurosci, 2006,31:713-722.
[16]Theus MH,Ricard J,Bethea JR,et al. EphB3 limits the expansion of neural progenitor cells in the subventricular zone by regulating p53 during homeostasis and following traumatic brain injury[J].Stem Cells,2010,28:1231-1242.
[17]del Valle K,Theus MH,Bethea JR,et al. Neural progenitors proliferation is inhibited by EphB3 in the developing subventricular zone[J]. Int J Dev Neurosci,2011,29:9-14.
[18]Baumann G,Travieso L,Liebl DJ,et al. Pronounced hypoxia in the subventricular zone following traumatic brain injury and the neural stem/progenitor cell response[J].Exp Biol Med (Maywood),2013,238:830-841.
[19]Zhou N,Zhao WD,Liu DX,et al.Inactivation of EphA2 promotes tight junction formation and impairs angiogenesis in brain endothelial cells[J].Microvasc Res,2011,82:113-121.
[20]JingX,MiwaH,SawadaT,etal. Ephrin-A1-mediated dopaminergic neurogenesis and angiogenesis in a rat model of Parkinson's disease[J].PLoS One,2012,7:e32019.
[21]Miranda JD,White LA,Marcillo AE,et al. Induction of Eph B3 after spinal cord injury[J]. Exp Neurol,1999,156:218-222.
[22]Moreno-Flores MT,Wandosell F.Up-regulation of Eph tyrosine kinase receptors after excitotoxic injury in adult hippocampus[J].Neuroscience,1999,91:193-201.
[23]Rodger J,Lindsey KA,Leaver SG,et al. Expression of ephrin-A2 in the superior colliculus and EphA5 in the retina following optic nerve section in adult rat[J].Eur J Neurosci,2001,14: 1929-1936.
[24]Willson CA,Irizarry-Ramirez M,Gaskins HE,et al.Upregulation of EphA receptor expression in the injured adult rat spinal cord[J].Cell Transplant,2002,11:229-239.
[25]Bundesen LQ,Scheel TA,Bregman BS,et al.Ephrin-B2 and EphB2 regulation of astrocyte-meningeal fibroblast interactions in response to spinal cord lesions in adult rats[J].J Neurosci, 2003,23:7789-7800.
[26]Filosa A,Paixao S,Honsek SD,et al.Neuron-glia communication via EphA4/ephrin-A3 modulates LTP through glial glutamate transport [J].Nat Neurosci,2009,12:1285-1292.
[27]Yang J,Luo X,Huang X,et al.Ephrin-A3 reverse signaling regulates hippocampal neuronal damage and astrocytic glutamate transport after transient global ischemia[J].J Neurochem,2014, 131:383-394.
[28]张强,王伟.迟发性神经元死亡的研究进展[J].神经损伤与功能重建,2007,2:79-84.
[29]Fang Y,ChoKS,Tchedre K,etal. Ephrin-A3 suppresses Wnt signaling to control retinal stem cell potency[J].Stem Cells,2013, 31:349-359.
(本文编辑:唐颖馨)
Gene Expression of EphA Receptors in Hippocampus of Rats after Transient Global Ischemia
YANG Jin-shan,LONG Gen,XU Li,XIE Min-jie,WANG Wei.Department of Neurology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective:To observe the gene expression of EphA receptors in the normal and ischemic hippocampus in rats.Methods:Fifty SD rats were randomly divided into two groups:sham group(n=10)and ischemia group (n=40).The Pulsinelli four-vessel occlusion model was used to induce transient global ischemia.Semi-quantitative RT-PCR was applied to measure gene expressions of EphA receptors in hippocampus at different time points(6h, 1d,3d,7d).To detect the cellular location of EphA4 receptors in the hippocampus,dual immunofluorescence was employed.Results:All EphA receptors including EphA1-A8 and EphA10 were expressed in normal hippocampus, and EphA4 the most abundantly expressed in normal hippocampus.EphA receptors exhibited different change patterns of RNA expressions in the hippocampus after transient global ischemia.EphA1,EphA2,EphA3,EphA6, EphA7 and EphA8 presented a transient up-regulation of RNA expression.However,EphA4,EphA5 and EphA10 expressed in persisted up-regulation of RNA since transient global ischemia.EphA4 also the most significantly expressed in the ischemic hippocampus.Immunofluorescence study showed that EphA4 was mainly distributed in the NeuN-positive pyramidal neurons in the hippocampus,especially in the CA1-CA3 and DG regions.Conclusion: EphA receptors exhibited different patterns in RNA expression in the hippocampus after ischemia.EphA4 receptor, the most abundantly expressed in normal hippocampus,experienced dramatic change in the ischemic hippocampus. EphA4 was mainly located in the NeuN-positive pyramidal neurons in the hippocampus,especially in the CA1-CA3 and DG regions.
EphA receptors;transient global ischemia model;hippocampus;EphA4 receptor;pyramidal neuron
R741;R741.02
ADOI10.3870/sjsscj.2015.02.003
1.华中科技大学同济医学院附属同济医院神经内科
武汉430030
2.福建医科大学附属第一医院神经内科
福州350000
国家自然科学基金重点项目
(No.81030021)
2014-12-17
王伟
wwang@vip.126. com
