剂量分割模式对肝癌放射治疗预后影响的探讨
2015-05-16黄尚校梁世雄
黄 橙 黄尚校 梁世雄
(广西医科大学附属肿瘤医院放疗科,南宁市 530021)
肝癌(liver cancer)是指发生于肝脏的恶性肿瘤,包括原发性肝癌和转移性肝癌,本文中的肝癌是指原发性肝癌。我国是肝癌高发地区,根据2012年统计,我国肝癌发病率为28.71/10万,居恶性肿瘤的第四位[1]。目前,针对肝癌的治疗方法较多,但手术治疗仍是肝癌首选和最有效的方法,肝癌切除术后5年生存率为30%~40%,其他治疗方法包括放射治疗、化学药物治疗、射频消融、动脉化疗栓塞、无水酒精注射等,主要用于不能接受手术治疗的患者。
由于过去认为肝脏对放射有抗拒性,普通模拟机下定位也很难准确,常规放射治疗会造成肝脏和肝周围重要器官的损伤,所以肝癌放射治疗受到限制。近来的研究证实,肝癌属放射敏感性肿瘤,且随着三维适形放射治疗(3-dimensional conformal radiation therapy,3DCRT)、调强适形放射治疗(intensity modulated radiation therapy,IMRT)和立体定向放射治疗(stereotactic radiotherapy,SBRT)等放射治疗技术的日益成熟和广泛应用,放疗为肝癌患者提供了新的机会。
曾昭冲教授提出“不主张对肝细胞癌患者进行低分割放射治疗”,并且用低分割放射治疗产生的肝损伤远大于常规分割的临床数据来支持自己的论点[2]。按照4R理论中的细胞增殖和细胞损伤修复理论来看待剂量分割方式,对于肿瘤组织来说其细胞在照射后会增殖,提高分割剂量有助于抑制肿瘤细胞的增殖;而对属于晚反应的正常组织来说,其细胞照射后需要修复,提高分割剂量对这些组织的修复又是不利的。可见,分割剂量是一把双刃剑,采用常规分割和低分割均有利有弊。因此,无论是肝癌还是其他肿瘤,我们都应根据具体情况综合考虑,在不产生严重并发症的条件下,采用合适的放射治疗技术和分割剂量,从而获得好的疗效。
近年来,我们结合肝癌的分期系统及预后相关因素,分析其预后影响因素,并探讨剂量分割模式与预后的关系,以期指导肝癌的个体化治疗。
1 材料与方法
1.1 病例特征1999年6月至2012年12月广西医科大学附属肿瘤医院行放射治疗Child-Pugh A或Child-PughB分级的肝癌病例共287例(均未行肝癌切除手术治疗)。肝癌的诊断参照中国抗癌协会肝癌专业委员会1999年提供的临床诊断标准[3]。按最大肿瘤直径(GTD)判断肝癌放射治疗预后最佳界值(7.75cm)[4],将GTD划分为≤7.75cm与>7.75cm组,GTD≤7.75cm组128例,GTD>7.75cm组159例;按大体肿瘤体积(GTV)判断肝癌放射治疗预后最佳界值(251.5cm3),将GTV划分为≤251.5cm3与>251.5cm3组,GTV≤251.5cm3100例,>251.5cm3187例;其中男性253例,女性34例;年龄23~82岁,中位年龄为48岁。HBV阳性241例,阴性46例;合并门脉癌栓(PVTT)88例。根据肝硬化Child-Pugh分级标准,A级260例,B级27例。本研究的肝癌评分采用CUPI评分系统[5],低危组181例,中危组99例,高危组7例,CUPI评分系统诊断标准见表1,所有入组病例的临床特征见表2。
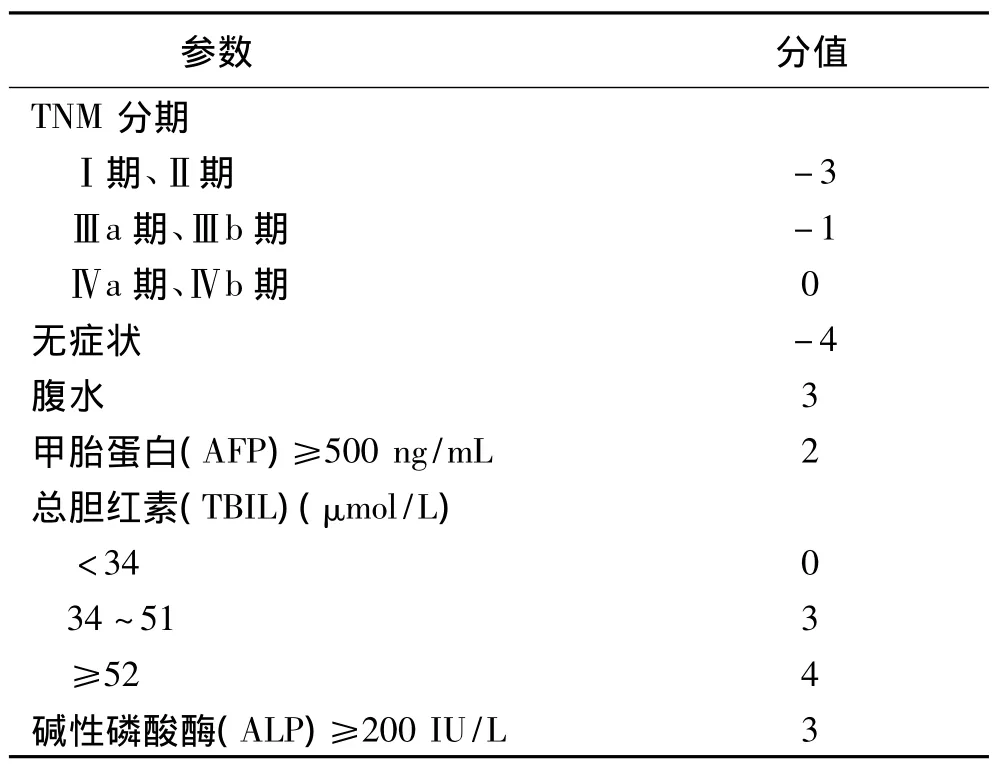
表1 香港中文大学肝癌诊断评分标准(CUPI)
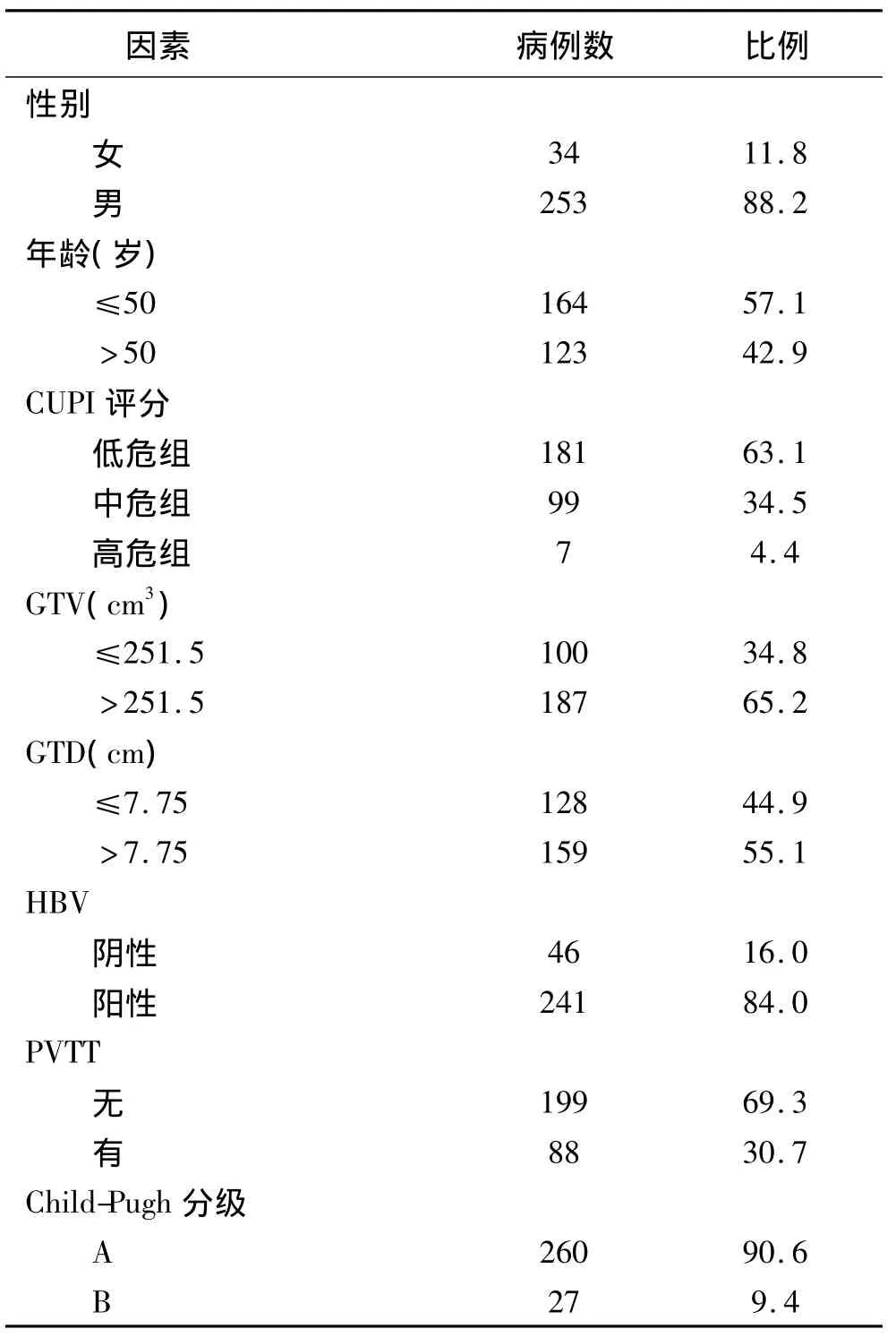
表2 287例肝癌患者的基本特征
1.2 预后因素选择 本研究选择的基础性预后因素包括:CUPI评分、性别、年龄、大体肿瘤体积(GTV)、最大肿瘤直径(GTD)、HBV感染、门脉癌栓(PVTT)、肝功能Child-Pugh分级等。治疗性预后因素包括经皮肝动脉化学栓塞(TACE)、放射治疗的总剂量、分割剂量。
1.3 治疗方法 使用Philips直线加速器8MV-X射线及上海拓能(Topslane)医疗器械有限公司生产的三维治疗计划系统或医科达Precise直线加速器6MV-X线进行肝癌放射治疗。GTV为大体肿瘤体积,(482.83±392.05)cm3,中位值400cm3;PTV为大体肿瘤体积(GTV)外扩0.5~2cm。90%处方剂量曲线覆盖100%PTV,通过剂量体积直方图(DVH图)对放射治疗计划进行评估[6]。放射治疗的总剂量为(51.60±7.19)Gy,中位52Gy,按照L-Q模式,肿瘤组织(早反应组织)取α/β=10,BED为16.8~100.8Gy(75.18±9.36)Gy[7]。分割剂量(4.54±1.02)Gy,中位4.50Gy,照射次数(12.10±4.19)次,中位次数12次,每周3~5次,每日或隔日1次。肝动脉化疗栓塞治疗(TACE):在放射治疗之前有103例接受了肝动脉化疗栓塞治疗。护肝治疗:放射治疗前和治疗期间使用护肝药护肝治疗,在放射治疗后不定期予护肝治疗。
1.4 随访 按WHO实体瘤的疗效评价标准评定,在放射治疗结束后3~4个月行腹部CT扫描评价,肿瘤完全消失者为CR;肿瘤最大垂直径乘积缩小≥50%者为PR;缩小<50%、增大<25%为NC;≥25%或发现新病灶为PD。治疗后1年内每3个月复查1次,1年后每6个月复查1次。治疗结束后对所有患者定期进行随访,随访截止日期为2014年8月。从放射治疗第一天开始计算生存时间。
1.5 统计学分析 采用统计学软件对各种预后相关因素进行统计分析,对生存率分析用Kaplan-Meier法,差别比较用Log-rank检验,P<0.05为差异有统计学意义。采用Cox回归(比例风险模型)方法对可能影响疗效和预后的临床相关因素进行多因素分析。运用ROC曲线评估剂量分割模式预测放射治疗后5年内死亡的准确性。
2 结 果
2.1 肝癌放射治疗的疗效及毒副反应 本组287例中,完全消退(CR)22例,部分消退(PR)114例,稳定(NC)108例,进展(PD)43例,总有效率(CR+PR)为47.39%(136/287)。至2014年8月,全组死亡275例,1、3、5 年总生存率分别为54.4%、29.2%、14.2%,中位生存期为15个月。生存曲线图见图1。
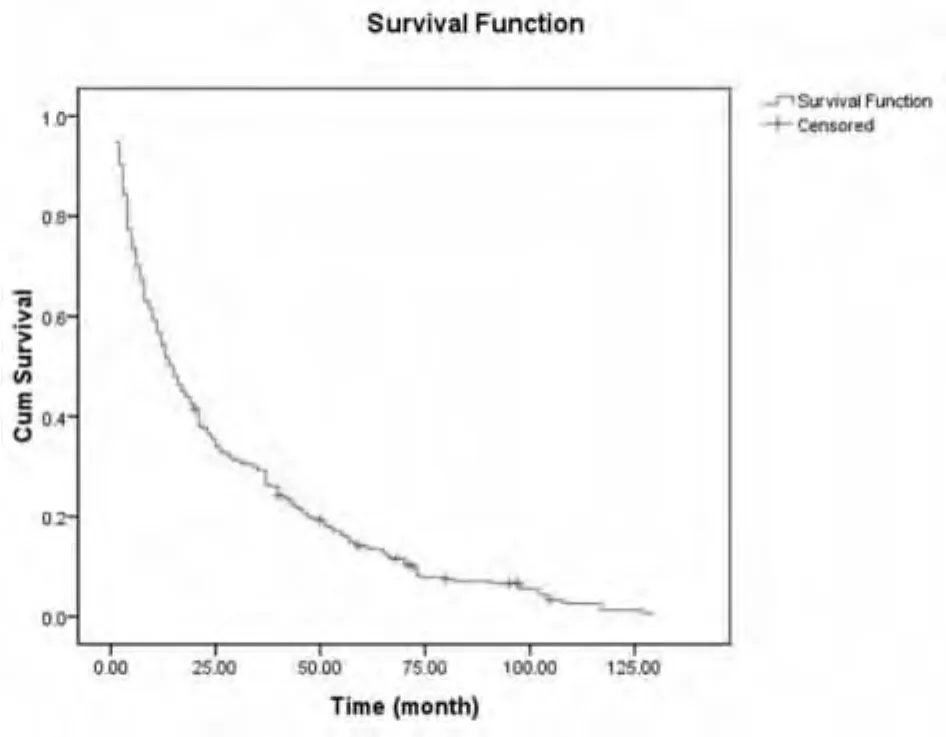
图1 287例肝癌患者的生存曲线
2.2 基础性预后因素的单因素分析 基础性的预后因素包括CUPI评分、性别、年龄、GTV、GTD、HBV感染、PVTT、肝功能Child-Pugh分级等。对各个因素进行单因素分析,结果详见表3。
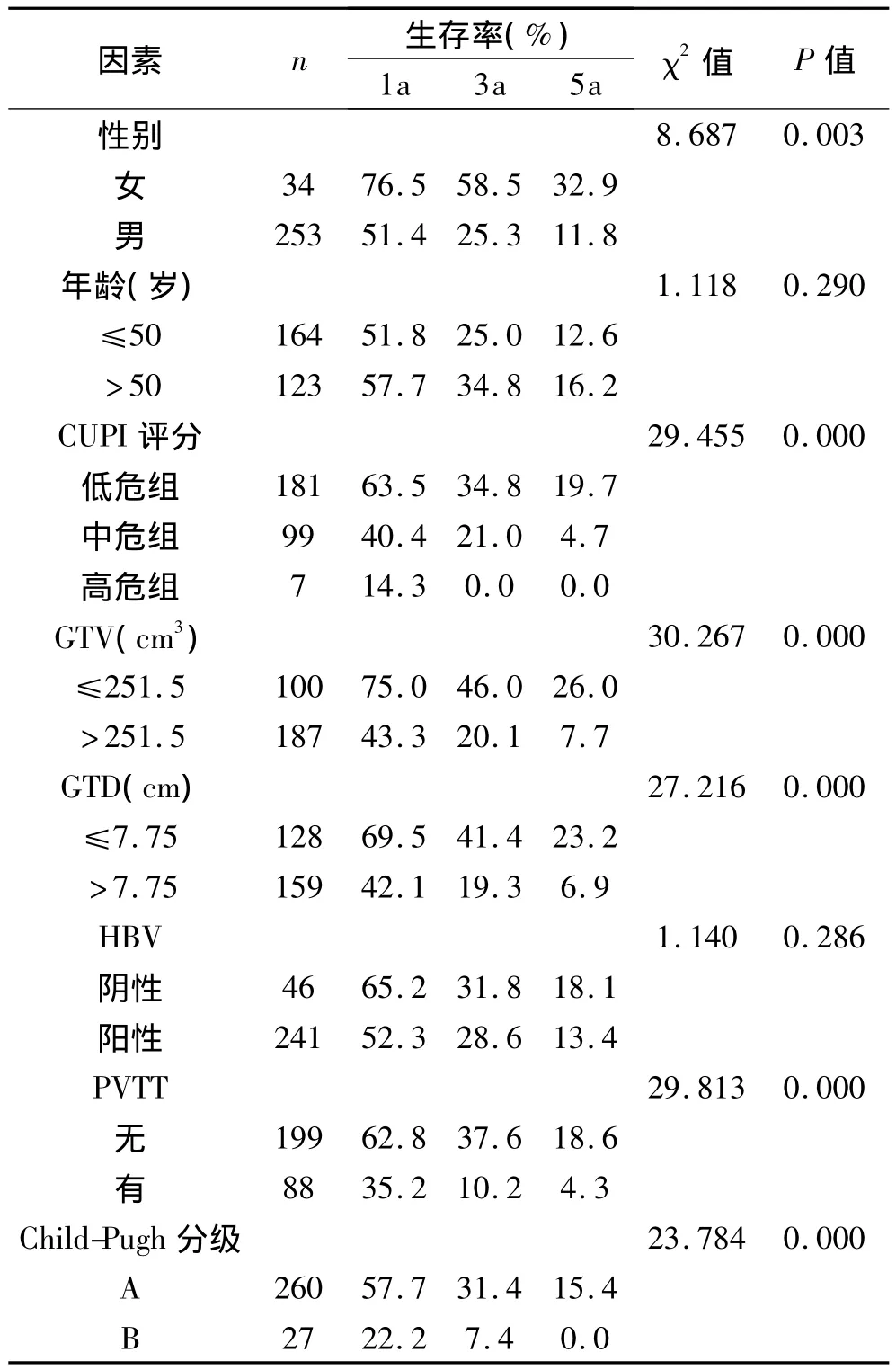
表3 287例肝癌患者放射治疗的预后单因素分析
经Kaplan-Meier分析和Log-rank检验,性别、CUPI评分、GTV、GTD、PVTT和Child-Pugh分级等基础性预后因素对肝癌放射治疗预后有影响,差异有统计学意义(P均<0.05)。
2.3 治疗性预后因素的单因素分析 治疗性预后因素包括经皮肝动脉化学栓塞(TACE)、放射治疗的总剂量、分割剂量。287例患者中有103例在放射治疗之前接受了肝动脉化疗栓塞治疗。放射治疗的总剂量(51.60±7.19)Gy,中位52Gy,将放射治疗的总剂量按四分位法分为四个组,<49Gy组72例,49Gy~52Gy组38例,52Gy~56Gy组115例,>56Gy组62例。分割剂量(4.54±1.02)Gy,中位4.50Gy,将分割剂量按四分位法可分为4个组,其中分割剂量≤3.99Gy组34例,3.99Gy<分割剂量≤4.55Gy组113例,4.55Gy<分割剂量≤5.14Gy组56例和分割剂量≥5.14Gy组84例。对上述因素进行单因素分析,结果详见表4。
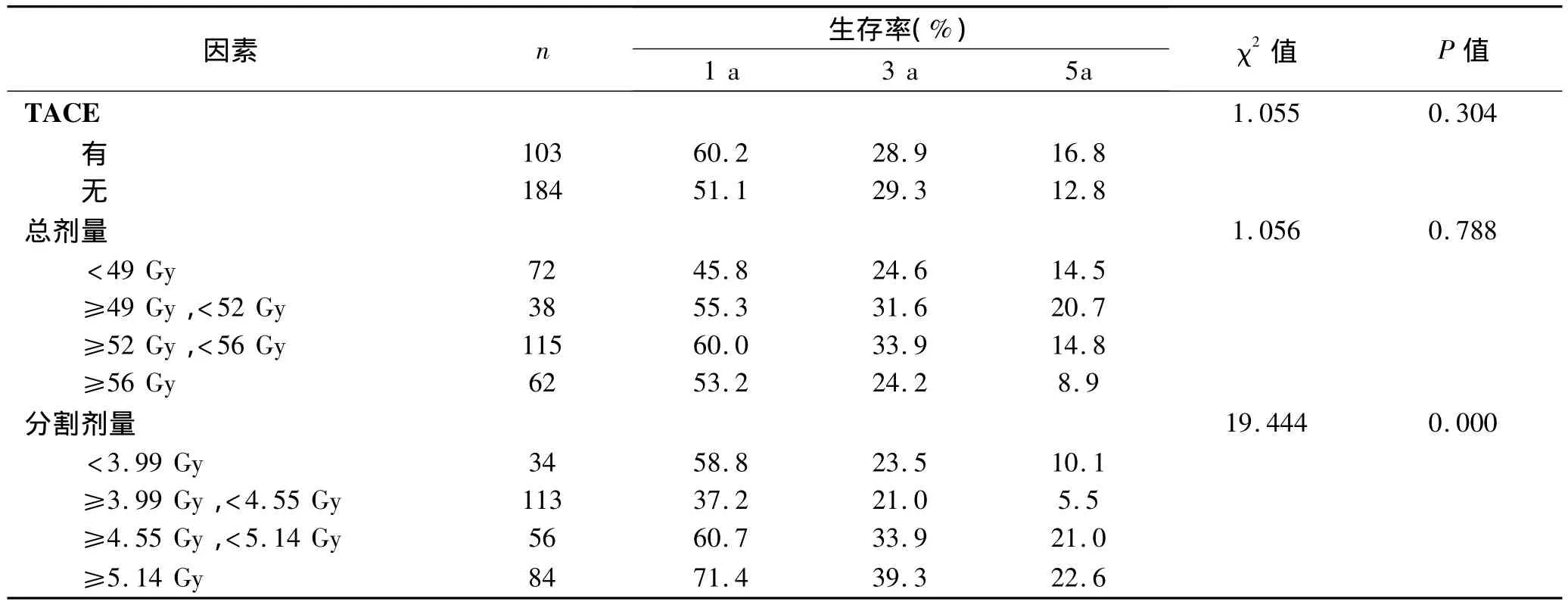
表4 治疗性因素对肝癌放射治疗预后影响的单因素分析
2.4 影响肝癌放射治疗预后因素的多因素分析 将上述有统计学意义的所有预后因素,包括CUPI评分、性别、GTV、GTD、PVTT和Child-Pugh分级及剂量分割模式进行Cox回归分析。结果显示,CUPI评分、性别、GTV、PVTT、Child-Pugh分级和剂量分割模式对预后的影响有统计学意义(P<0.05),是肝癌放射治疗的独立预后因素。
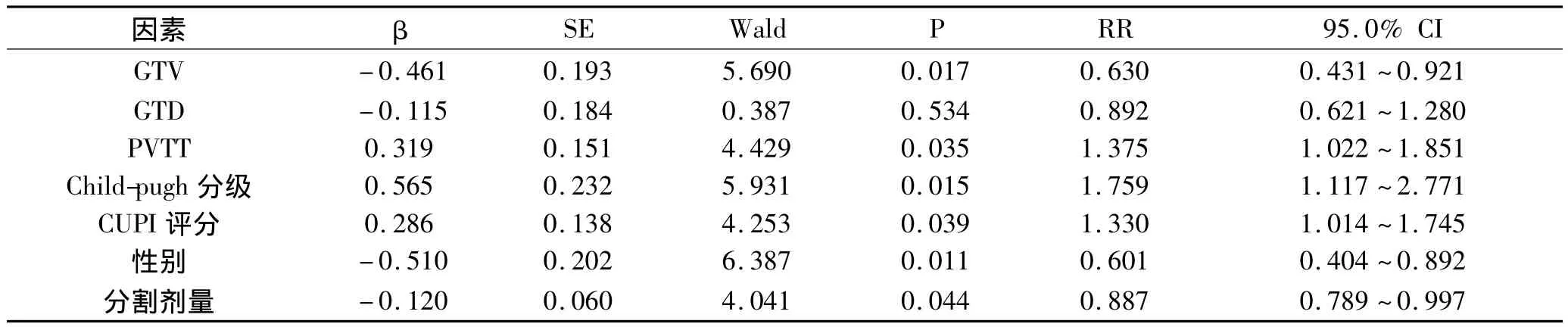
表5 肝癌放射治疗预后影响因素的Cox回归分析
2.5 ROC曲线法确定分割剂量最佳判断界值本研究进一步探讨剂量分割模式与肝癌放射治疗预后的关系,以患者放射治疗后5年内死亡与否为金标准,对287例患者绘制ROC曲线。以分割剂量预测肝癌患者放射治疗预后的ROC曲线下面积为0.661(95%CI:0.568~0.754),根据ROC曲线上Youden指数最大的切点,确定分割剂量最佳判断界值为4.75 Gy,敏感度=76.3%,特异度=64.3%。见图2。
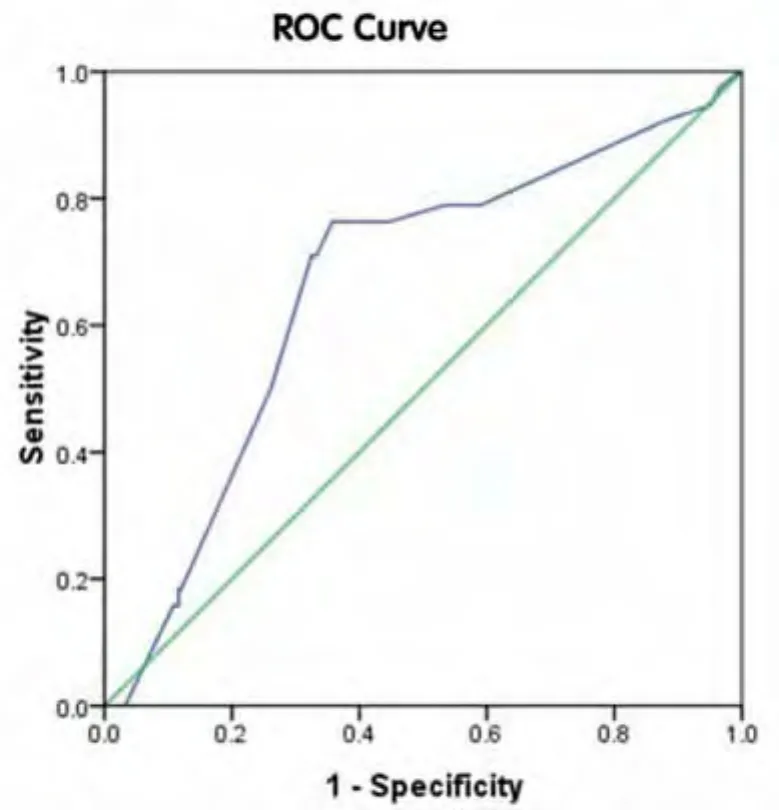
图2 分割剂量预测肝癌患者放射治疗预后的ROC曲线
2.6 分割剂量按最佳判断界值分组的预后分析 按分割剂量最佳判断界值(4.75 Gy)将分割剂量进行分组,分割剂量<4.75 Gy组169例,分割剂量≥4.75 Gy组118例,经Kaplan-Meier分析和 Log-rank检验,P<0.05;中位生存期分别为10个月和23个月,1、3、5年生存率分别为42.0%、19.9%、5.6%和 72%、42.4%、26.1%,预后的差异有统计学意义(P<0.05)。详见表6、图3。
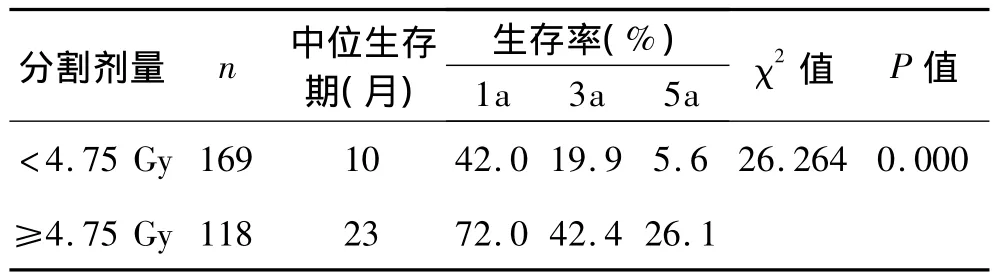
表6 按分割剂量最佳判断界值(4.75 Gy)分组的预后分析
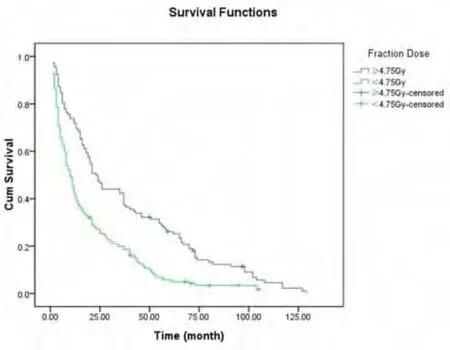
图3 分割剂量<4.75Gy组与≥4.75Gy组患者的生存曲线比较图
在分割剂量≥4.75Gy的分组中,(49.85±4.37)Gy/4.75~6.0Gy/次,分8~11次2.5~3.5 周完成的有110例,分割剂量>6.0Gy的有8例,(49.85±4.37)Gy/4.75 Gy~6.0Gy/次2.5~3.5 周完成的剂量分割模式占绝大多数,中位生存期为23个月,1、3、5年生存率分别为72%、43.6%及28%。
3 讨 论
肝癌的放射治疗在临床上已经进行了几十年的实践,但是早期的肝癌放疗总剂量较低[8,9],因为放疗导致的肝脏毒性和疗效差,以致于一段时期内临床上对肝癌的治疗不考虑使用放疗。随着放疗技术、影像设备的不断更新进步,放射治疗在肝癌治疗中的地位逐渐上升。近些年来,陆续有学者报道高剂量的放射治疗是安全、有效的[10,11]。肝癌放疗广泛应用的放射治疗技术主要有三维适形放疗(3DCRT)和调强适形放疗(IMRT)。现代放疗技术定位准确、肿瘤边缘剂量梯度大,射线高剂量区的剂量分布在三维方向上与靶区实际形状相适配,可以最大程度保护周围正常组织,同时可明显提高肿瘤的放射剂量和疗效[12,13]。因此,放疗可以作为无手术适应证或拒绝手术的早期原发性肝癌患者可供选择的治疗手段。
许多资料显示[14~16],肝癌的预后因素包括肿瘤大小、肿瘤类型、肿瘤分期、门脉癌栓、血清AFP水平以及肝功能相关的血清学指标。在本组研究中,CUPI评分、性别、GTV、PVTT和Child-Pugh分级及剂量分割模式是肝癌放射治疗的独立预后因素。其他因素如年龄、HBV有无感染、TACE和放疗总剂量对肝癌放疗预后无明显影响。临床上,大部分接受肝脏放疗的患者已属肝癌中晚期,身体基本状况较差,失去手术机会,CUPI评分、性别、GTV、PVTT和Child-Pugh分级及剂量分割模式作为影响肝癌放疗预后的重要因素,在放射治疗过程中应加以重视。
因目前肝癌放射治疗没有统一的剂量分割模式,国外多采用常规分割剂量,而国内较多的单位使用低分割放射治疗。本研究的主要目的是探讨剂量分割模式与预后的关系,以期指导肝癌的个体化治疗。根据生物效应剂量计算公式:BED=nd×[1+d/(α/β)];其中 BED为生物效应剂量,n为分次次数,d为分次剂量,α/β为L-Q模型中α参数和β参数之比。本研究中,肿瘤组织(早反应组织)取α/β=10,分割剂量≥4.75 Gy组的生物效应剂量为(76.98±6.74)Gy,分割剂量<4.75 Gy组的生物效应剂量为(73.92±10.66)Gy,经t检验分析,分割剂量≥4.75 Gy组与分割剂量<4.75 Gy组的生物效应剂量差异有统计学意义(P<0.05),分割剂量≥4.75 Gy组的生物效应剂量较高,说明较高的生物效应剂量对提高生存率有一定的优势。
Rim CH等[17]对45例原发性肝癌合并门静脉癌栓形成的患者采用三维适形放疗,剂量38~65 Gy(中位61.2 Gy),1.8~2.5 Gy/次。结果有3例(6.7%)达到CR,25例(55.6%)达到 PR,14例(31%)病情稳定,3例(6.7%)出现扩散转移,达到CR和PR患者中位生存期为16.7个月,1年生存率为63.7%;其余患者的中位生存期为8个月,1年生存率为28.2%(P=0.003)。结论是3-DCRT对原发性肝癌合并门静脉癌栓患者是安全、有效的治疗方法,可以延长患者的生存期。也有文献报道采取大分割照射(4~12Gy/次,2~3次/周)治疗原发性肝癌取得了较好的疗效[18]。本研究结果显示分割剂量是肝癌放射治疗的独立预后因素,以分割剂量预测肝癌患者放射治疗预后的ROC曲线下面积为0.661(95%CI:0.568~0.754),确定分割剂量最佳判断界值为4.75 Gy。按分割剂量最佳判断界值(4.75 Gy)将分割剂量进行分组,分割剂量<4.75 Gy组169例,分割剂量≥4.75 Gy组118例,中位生存期分别为10个月和23 个月,1、3、5 年生存率分别为42.0%、19.9%、5.6%和72%、42.4%、26.1%,预后的差异有统计学意义(P<0.05)。而在分割剂量≥4.75 Gy的分组中,(49.85±4.37)Gy/4.75~6.0Gy/次,分8~11次2.5周~3.5周完成的有110例,分割剂量>6.0Gy的有8例,(49.85±4.37)Gy/4.75Gy~6.0Gy/次2.5~3.5周完成的剂量分割模式占绝大多数,中位生存期为23个月,1、3、5年生存率分别为72%、43.6%、28%。据此可以推断,肝癌放射治疗采用(49.85±4.37)Gy/4.75Gy~6.0Gy/次2.5~3.5周完成的剂量分割模式可以获得更高的生存率。但因本研究属于回顾性研究,样本量仍较少,肝癌放射治疗采用何种分割剂量还需大样本随机对照临床研究来验证。
综上所述,CUPI评分、性别、GTV、PVTT、Child-Pugh分级和剂量分割模式是影响肝癌放射治疗独立的预后因素。对于肝癌患者,采用合适剂量分割模式的放疗可以获得更高的生存率。
[1]赫 捷,赵 平,陈万青.2011中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:1.
[2]曾昭冲.肝细胞癌的放射治疗[J].实用肿瘤杂志,2007,22(5):380-384.
[3]原发性肝癌诊断标准[J].中华肝脏病杂志,2000,8(3):135.
[4]李业飞,梁世雄,黄华忠,等.大体肿瘤体积评估原发性肝癌放疗预后的价值及其截断值的获取[J].中国癌症杂志,2010,20(10):775-781.
[5]Leung TW,Tang AM,Zee B,et al.Construction of the Chinese University Prognostic Index for hepatocellular carcinoma and comparison with the TNM staging system,the Okuda staging system,and the Cancer of the Liver Italian Program staging system:a study based on 926 patients[J].Cancer,2002,94(6):1760-1769.
[6]Liang SX,Zhu XD,Lu HJ,et al.Hyp of ractionated three-dimensional conformal radiation therapy(3dcrt)for primary liver carcinoma[J].Cancer,2005,103(10):2181-2188.
[7]梁世雄,蒋国梁,朱小东,等.原发性肝癌大分割三维适形放疗的预后因素分析[J].中华肿瘤杂志,2005,27(10):613-615.
[8]Cochrane AM,Murray-lyon IM,Brinkley DM,et al.quadruple chemotherapy versus radiotherapy in treatment of primary hepatocellular carcinoma[J].Cancer,1977,40(2):609-614.
[9]Stillwagon GB,Order SE,Guse C,et al.194 hepatocellular cancers treated by radiation and chemotherapy combinations:toxicity and response:a Radiation Therapy Oncology Group Study[J].Int J Radiat Oncol Biol Phys,1989,17(6):1223-1229.
[10]Seong J,Keum KC,Han KH,et al.Combined transcatheter arterial chemoembolization and local radiotherapy of unresectable hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,1999,43(2):393-397.
[11]Seong J,Park HC,Han KH,et al.Local Radiotherapy for Unresectable Hepatocellular Carcinoma PatientsWho Failed with Transcatheter Arterial Chemoembolization[J].Int J Radiat Oncol,Biology,Physics,2000,47(5):1331-1335.
[12]Zeng ZC,Tang ZY,Yang BH,et al.Comparison between radioimmunotherapy and external beam radiation therapy for patients with hepatocellular carcinoma[J].Eur J of Nucl Med Mol Imaging,2002,29(12):1657-1668.
[13]Zeng ZC,Tang ZY,Wu ZQ,et al.Phase I clinical trial of oral furtulon and combined hepatic arterial chemoembolization and radiotherapy in unresectable primary liver cancers,including clinicopathologic study[J].Am J Clin Oncol,2000,23(5):449-454.
[14]Stuart KE,Anand AJ,Jenkins RL.Hepatocellular carcinoma in the United States:Prognostic features,treatmentoutcome,and survival[J].Cancer,1996,77(11):2217-2222.
[15]Okuda K,Ohtsuki T,Obata H,et al.Natural history of hepatocellular carcinoma and prognosis in relation to treatment.Study of 850patients[J].Cancer,1985,56(4):918-928.
[16]Chlebowski RT,Tong M,Weissman J,et al.Hepatocellular carcinoma.Diagnostic and prognostic features in North A-merican patients[J].Cancer,1984,53(12):2701-2706.
[17]Rim CH,Yang DS,Park YJ,et al.Effectiveness of high-dose three-dimensional conformal radiotherapy in hepatocellular carcinoma with portal vein thrombosis[J].Jpn J of Clin Oncol,2012,42(8):721-729.
[18]Wada H,Nemoto K,Majima K,et al.[Computed tomography appearance of high-dose-irradiated hepatic parenchyma surrounding small tumors after stereotactic radiotherapy][J].Nippon Igaku Hoshasen Gakkai Zasshi,2002,62(10):549-556.
