饲料中添加表面活性素对吉富罗非鱼生长性能、血清生化指标及脂肪代谢的影响
2015-05-09翟少伟孙秀文
翟少伟 李 剑 孙秀文
(集美大学水产学院,厦门361021)
饲料中添加表面活性素对吉富罗非鱼生长性能、血清生化指标及脂肪代谢的影响
翟少伟 李 剑 孙秀文
(集美大学水产学院,厦门361021)
本试验旨在研究饲料中添加表面活性素对吉富罗非鱼生长性能、血清生化指标及脂肪代谢的影响。将240尾吉富罗非鱼[平均体重为(12.0±0.1) g],随机分为4组,每组4个重复,每个重复15尾鱼,分别投喂表面活性素添加水平为0(对照组)、50、100和200 mg/kg的试验饲料7周。结果表明:饲料中添加表面活性素显著提高吉富罗非鱼的终末体重、增重率和特定生长率(P<0.05),且上述指标50 mg/kg添加组显著高于200 mg/kg添加组(P<0.05),同时显著降低饲料系数(P<0.05),但对摄食率和存活率无显著影响(P>0.05)。饲料中添加表面活性素显著提高肠道脂肪酶(50 mg/kg添加组除外)活性(P<0.05),对淀粉酶和蛋白酶活性无显著影响(P>0.05)。饲料中添加表面活性素后血清尿素氮水平降低,但仅50 mg/kg添加组与对照组有显著差异(P<0.05);各添加组血清白蛋白和游离脂肪酸水平显著高于对照组(P<0.05),总胆固醇(200 mg/kg添加组除外)、甘油三酯水平显著低于对照组(P<0.05);各组间血清酸性磷酸酶和碱性磷酸酶活性无显著差异(P>0.05);各添加组血清溶菌酶活性显著高于对照组(P<0.05),其中以50 mg/kg添加组活性最高。饲料中添加表面活性素显著提高肝胰脏脂肪酸合成酶水平(P<0.05),对肝胰脏乙酰辅酶A羧化酶水平无显著影响(P>0.05);各添加组肝胰脏肝脂酶和脂蛋白脂酶活性显著高于对照组(P<0.05),但各添加组之间2种酶活性无显著差异(P>0.05)。由此可见,饲料中添加表面活性素可提高吉富罗非鱼肠道脂肪酶活性、改善血清生化指标、调节脂肪代谢酶水平或活性,进而促进其生长。本试验条件下,建议吉富罗非鱼饲料中表面活性素添加水平为50 mg/kg。
表面活性素;吉富罗非鱼;生长性能;脂肪代谢
鱼类可以有效利用脂肪,具有节约蛋白质的效应。适当提高饲料中油脂水平,可一定程度减少蛋白质作为能量的消耗。但饲料中添加过多的油脂会导致鱼体脂肪沉积过多,影响鱼类健康和产品品质[1-3]。饲料中添加具有表面活性作用的乳化剂,能够使进入动物肠道的油脂分散形成乳糜微粒,扩大油脂与脂肪酶的接触面积,从而提高油脂的消化吸收[4]。水产饲料中常用的乳化剂有胆汁酸盐类、磷脂类和糖苷酯类等单一或复合的乳化剂,这些乳化剂多为动、植物直接提取或化学合成而来[5-7]。而微生物源的乳化剂在饲料中的应用还鲜见报道。近年来,枯草芽孢杆菌分泌的表面活性物质——表面活性素(surfactin)成为表面活性剂领域的研究热点。它具有特殊的两亲性化学结构,其表面活性强于常见的乳化剂,是最强的生物表面活性剂之一[8-9]。表面活性素不仅具有广谱高效的抗菌活性,而且对病毒、支原体和原虫等也具有显著的抑制效果,又被称为抗菌脂肽[9-10]。目前,表面活性素在动物饲料中的应用还处于初步阶段,以往研究主要关注表面活性素的抗菌活性方面。研究表明,表面活性素适量添加到饲料中可提高爱拔益加(AA)肉鸡、断奶仔猪对脂肪的利用效率,促进蛋白质的沉积和动物生长[11-12]。而表面活性素在水产动物方面,仅有含表面活性素的复合物添加在点带石斑鱼(Epinepheluscoioides)[13]和凡纳滨对虾(Litopenaeusvannamei)[14]饲料中的报道,以及表面活性素添加在吉富罗非鱼饲料中的初步研究[15]。鉴于此,本文拟通过研究在饲料中添加不同水平的表面活性素对吉富罗非鱼(genetically improved farmed tilapia,GIFT,Oreochromisniloticus)生长性能、血清生化指标及脂肪代谢的影响,探讨表面活性素的促生长效果以及对脂肪代谢的影响,为表面活性素作为新型水产饲料乳化剂的应用提供依据。
1 材料与方法
1.1 试验动物与试验设计
饲养试验在集美大学水产学院生态实验室进行。吉富罗非鱼购买于漳州市水产开发中心,饲喂基础饲料暂养驯化15 d之后,选取240尾体格健壮、规格均一、平均体重为(12.0±0.1) g的试验鱼,随机分成4组,分别投喂在基础饲料中添加0(对照组)、50、100和200 mg/kg表面活性素(由福建正源饲料有限公司提供,有效含量为80%)的试验饲料。每组4个重复,每个重复15尾鱼。试验期为7周。
1.2 基础饲料组成与饲养管理
基础饲料配方根据SC/T 1025—2004《罗非鱼配合饲料》配制,其组成及营养水平见表1。
饲料原料粉碎过60目筛,各原料混合均匀后,分别添加0、50、100和200 mg/kg表面活性素,用双螺杆制粒机(CD4×1TS型,华南理工大学科技实业总厂)常温加工成直径为2.5 mm的颗粒饲料,自然风干后置于已编号的自封袋中,于-20 ℃冷藏保存备用。
试验鱼养殖于室内具有循环水的水族箱(75 cm×55 cm×60 cm,加水量约为120 L)中。每天08:30和17:30定时投喂,达表观饱食,记录每箱饲料投喂量。投喂0.5 h后吸出残料和粪便,并记录残饵量。试验用水为曝气自来水,每天换水2次,每次换水量约30%。光照为自然光源,增氧机24 h持续增氧。试验期间维持水温(27±2) ℃,pH 7.3±0.2,溶氧浓度高于6.0 mg/L,氨氮浓度低于0.2 mg/L。
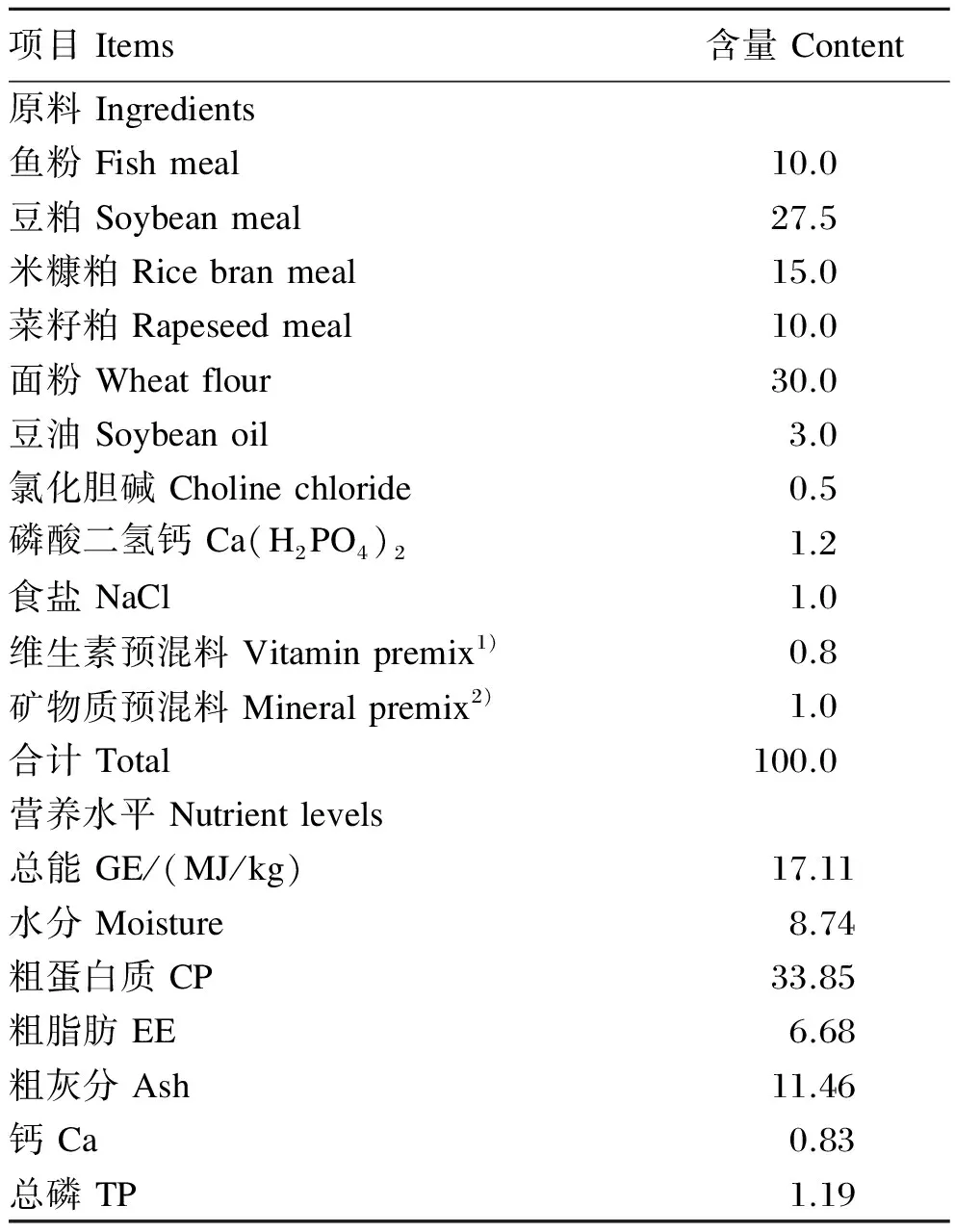
表1 基础饲料组成及营养水平(风干基础)
1)维生素预混料为每千克饲料提供Vitamin premix provided the following per kg of the diet:VA 25 000 IU,VD33 500 IU,VE 20 mg,VK 5 mg,VB12.5 mg,VB22.5 mg,VB31.0 mg,VB60.2 mg,生物素 biotin 0.03 mg,叶酸 folic acid 0.75 mg,VB120.05 mg,VC 5 mg,泛酸钙 calcium pantothenate 10 mg,肌醇 inositol 100 mg。
2)矿物质预混料为每千克饲料提供Mineral premix provided the following per kg of the diet:NaCl 50 mg,MgSO4·7H2O 25 mg,NaH2PO4·2H2O 25 mg,KH2PO432 mg,Ca(H2PO4)2·H2O 20 mg,FeSO4250 mg,Ca(C3H5O3)235 mg,ZnSO4·7H2O 3.5 mg,MnSO4·4H2O 16 mg,CuSO4·5H2O 3 mg,CoCl2·6H2O 5 mg,KIO30.3 mg。
1.3 样品采集与组织匀浆液的制备
饲养试验结束后,试验鱼禁食24 h,称量每个水族箱中全部试验鱼总重,随机取规格相近6尾鱼,用60 mg/L丁香酚进行麻醉处理,测量体重,尾静脉取血,4 ℃静置30 min后离心(3 000 r/min,10 min)取血清,保存于-80 ℃冰箱,待测血清生化指标。采血后的试验鱼解剖,分离出肝胰脏和肠道,保存于-80 ℃冰箱,待测消化酶、脂肪代谢关键酶的水平或活性。
组织匀浆液制备时,将冷冻于-80 ℃的吉富罗非鱼肝胰脏和肠道组织取出,先放入4 ℃冰箱中解冻,然后在冰浴的0.86%生理盐水中漂洗,去除血液,滤纸拭干,称重,按组织重(g)与0.86%生理盐水体积(mL)比(m/v)=1∶9在冰浴条件下制成10%的组织匀浆液(匀浆时间10 s/次,间隙20 s,连续5~7次),再将10%的组织匀浆液在4 ℃条件下以3 000 r/min离心10 min,取上清液分装到1.5 mL离心管中于-20 ℃冰箱保存待测。
1.4 测定指标与方法
1.4.1 生长性能指标
根据记录的试验数据,按下列公式计算各生长性能指标:
增重率(weight gain rate,WGR,%)=
100×(Wt-W0)/W0;
特定生长率(specific growth rate,SGR,%/d)=
100×(lnWt-lnW0)/t;
饲料系数(feed conversion ratio,FCR)=
FC/(Wt-W0);
摄食率(feeding rate,FR,%)=100×FC/
[(W0+Wt)/2]/t;
日摄食量(daily feed intake,DFI,g/尾)=
FC/t;
存活率(survival rate,SR,%)=100×
Nf/Ni。
式中:W0为每尾鱼平均初始体重(initial body weight,IBW),g/尾;Wt为每尾鱼平均终末体重(final body weight,FBW),g/尾;t为饲喂天数,d;FC为平均每尾鱼摄食饲料总量(feed consumption)(风干样重),g;Ni为初始鱼尾数,尾;Nf为终末鱼尾数,尾。
1.4.2 肠道消化酶活性
肠道脂肪酶和淀粉酶活性采用南京建成生物工程研究所提供的试剂盒进行测定。肠道蛋白酶活性的测定采用福林-酚试剂法,以磷酸二氢钠-磷酸氢二钠缓冲液调节pH,680 nm处测吸光度值。
1.4.3 血清生化指标
血清尿素氮(urea nitrogen,UN)、白蛋白(albnmin,ALB)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、游离脂肪酸(free fatty acid,FFA)水平分别用Fearon法、溴甲酚绿法、酶偶联比色法、甘油磷酸氧化酶-过氧化物酶(GPO-PAP)法、铜试剂法测定;酸性磷酸酶(acid phosphatase,ACP)和碱性磷酸酶(alkaline phosphatase,AKP)活性均采用磷酸苯二钠比色法测定;溶菌酶(lysozyme,LZM)活性采用比浊法,利用南京建成生物工程研究所提供的试剂盒测定。
1.4.4 肝胰脏脂肪代谢关键酶的水平或活性
肝胰脏脂肪酸合成酶(fatty acid synthetase,FAS)和乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)水平采用双抗体酶联免疫分析法测定;肝脂酶(hepatic lipase,HL)和脂蛋白脂酶(lipoprotein lipase,LPL)活性均采用铜试剂法测定,试剂盒由南京建成生物工程研究所提供,具体操作步骤见说明书。
1.5 数据统计与分析
所有试验数据以平均值±标准差(mean±SD)表示。原始数据用Excel 2010整理后,采用SPSS 19.0进行单因素方差分析(one-way ANOVA),若组间存在显著差异,则采用Duncan氏法进行多重比较,P<0.05表示差异显著。
2 结 果
2.1 饲料中添加表面活性素对吉富罗非鱼生长性能的影响
由表2可知,各添加组的FBW、WGR和SGR均显著高于对照组(P<0.05),同时50 mg/kg添加组显著高于200 mg/kg添加组(P<0.05)。各添加组的FCR均显著低于对照组(P<0.05),各添加组之间无显著差异(P>0.05)。50 mg/kg添加组的DFI显著高于对照组和200 mg/kg添加组(P<0.05),与100 mg/kg添加组无显著差异(P>0.05)。各组间FR和SR无显著差异(P>0.05)。
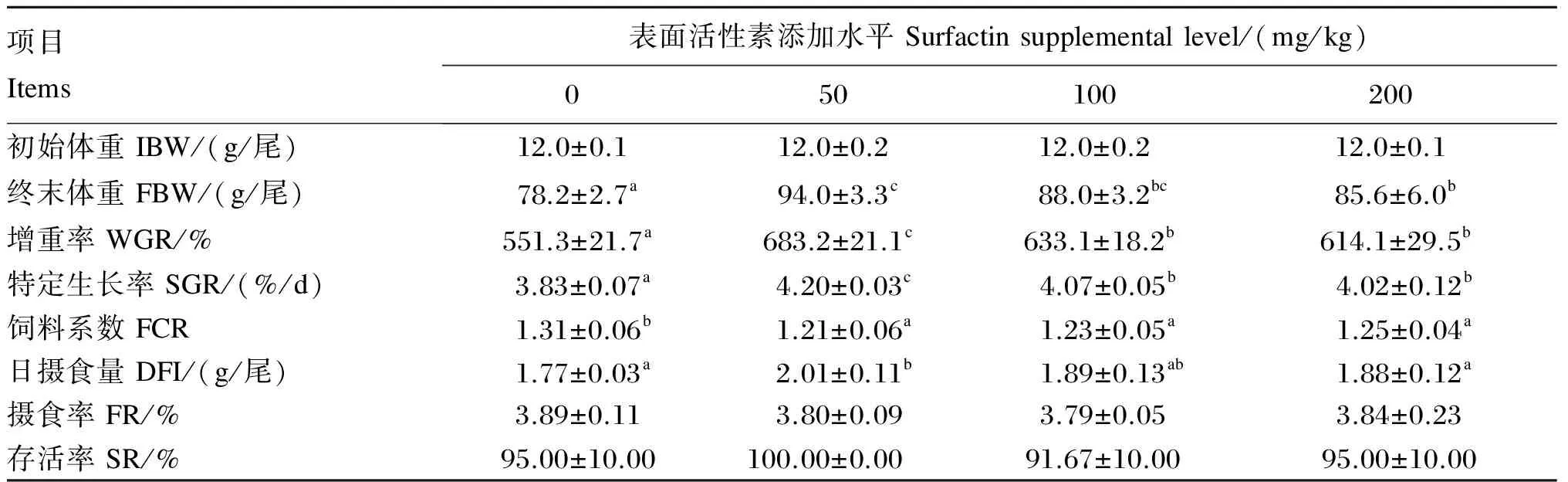
表2 饲料中添加表面活性素对吉富罗非鱼生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 饲料中添加表面活性素对吉富罗非鱼肠道消化酶活性的影响
由表3可知,饲料中添加表面活性素对吉富罗非鱼肠道淀粉酶和蛋白酶活性无显著影响(P>0.05)。随着表面活性素添加水平的升高,吉富罗非鱼肠道脂肪酶活性呈现上升趋势,除50 mg/kg添加组外,其余各添加组均显著高于对照组(P<0.05),但各添加组之间无显著差异(P>0.05)。
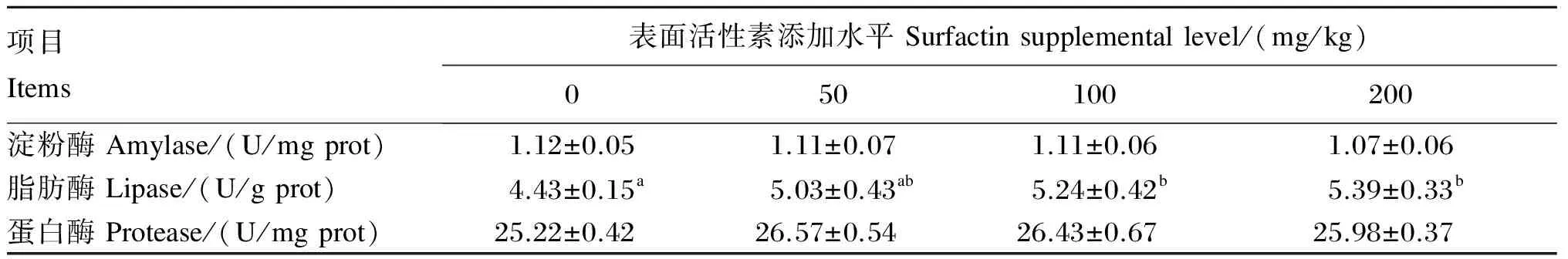
表3 饲料中添加表面活性素对吉富罗非鱼肠道消化酶活性的影响
2.3 饲料中添加表面活性素对吉富罗非鱼血清生化指标的影响
由表4可知,50 mg/kg添加组血清UN水平显著低于对照组(P<0.05),其他添加组与对照组相比无显著差异(P>0.05)。各添加组血清ALB水平均显著高于对照组(P<0.05),但各添加组之间差异不显著(P>0.05)。除200 mg/kg添加组外,其他添加组血清TC水平显著低于对照组(P<0.05)。各添加组血清TG水平均显著低于对照组(P<0.05),但各添加组之间差异不显著(P>0.05)。各添加组血清FFA水平显著高于对照组(P<0.05),但各添加组之间无显著差异(P>0.05)。各添加组血清ACP和AKP活性与对照组均无显著差异(P>0.05)。各添加组血清LZM活性均显著高于对照组(P<0.05),以50 mg/kg添加组血清LZM活性最高。
2.4 饲料中添加表面活性素对吉富罗非鱼肝胰脏脂肪代谢关键酶水平或活性的影响
由表5可知,各添加组肝胰脏FAS水平显著低于对照组(P<0.05),各添加组肝胰脏ACC水平与对照组无显著差异(P>0.05);各添加组肝胰脏HL和LPL活性显著高于对照组(P<0.05),各添加组间这2种酶活性无显著差异(P>0.05)。
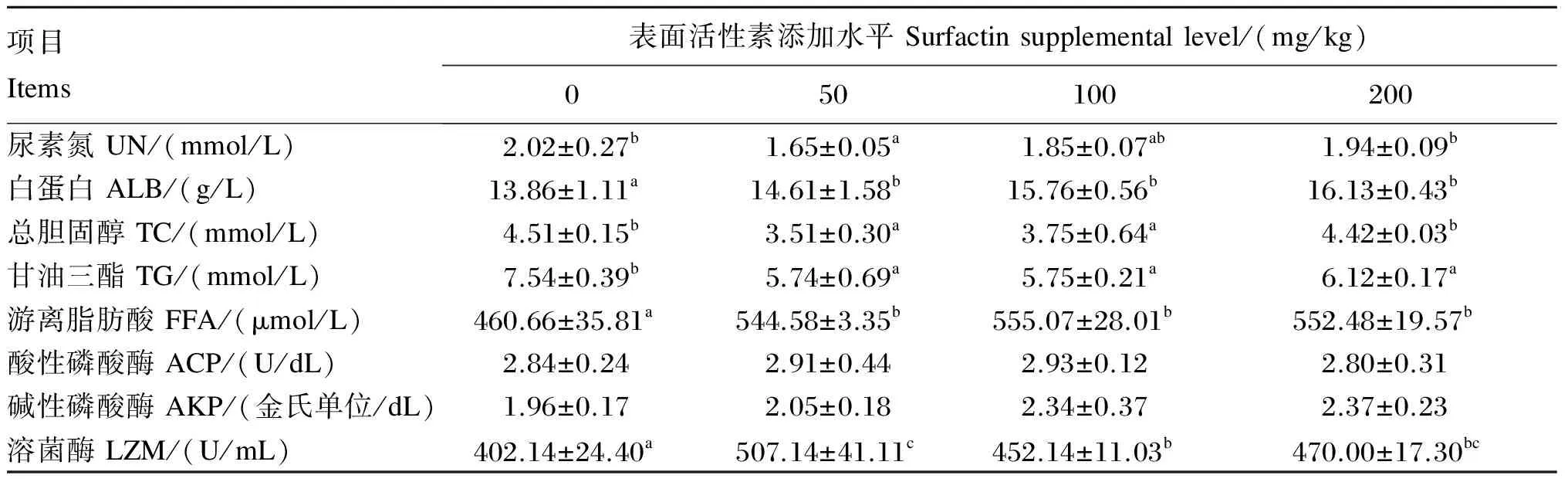
表4 饲料中添加表面活性素对吉富罗非鱼血清生化指标的影响
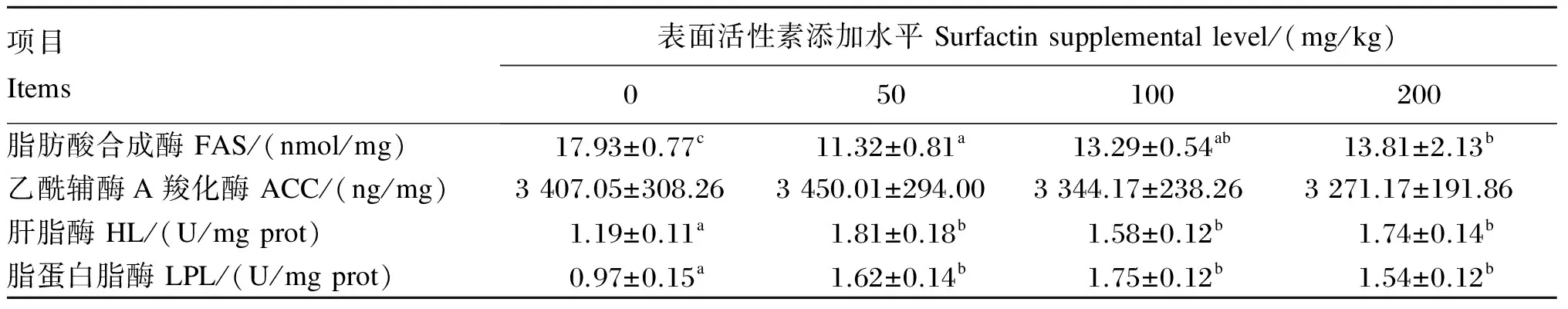
表5 饲料中添加表面活性素对吉富罗非鱼肝胰脏脂肪代谢关键酶水平或活性的影响
3 讨 论
3.1 饲料中添加表面活性素对吉富罗非鱼生长性能及消化酶活性的影响
本试验中,吉富罗非鱼饲料中添加50~200 mg/kg表面活性素均提高了FBW、WGR和SGR,降低了FCR,表明表面活性素具有促生长作用;其中50 mg/kg添加组的效果最佳。目前,关于表面活性素在水产饲料中应用的报道较少。研究表明,在吉富罗非鱼饲料中添加12.5~50.0 mg/kg抗菌脂肽(即表面活性素),以50.0 mg/kg添加组促生长效果最好[15];在点带石斑鱼(Epinepheluscoioides)饲料中添加2%含表面活性素的黄豆粉可显著提高其WGR[13];添加100 mg/kg的NT-6抗菌脂肽(以表面活性素、芬荠素和伊枯草菌素为活性成分)可显著提高凡纳滨对虾(Litopenaeusvannamei)的WGR和SGR[14]。此外,在AA肉鸡饲粮中添加4 000 U/kg抗菌脂肽对肉鸡的生长发育和免疫机能具有较好的调节和促进作用[11];在断奶仔猪饲粮中添加4 000 U/kg抗菌脂肽能够提高其生长性能,减少断奶应激造成的腹泻,抑制肠道有害微生物,对有益微生物也有一定的抑制作用,显著影响血液激素水平和某些生化指标,能够提高机体对脂类的转化利用能力和蛋白质的沉积能力[12]。本试验中表面活性素促生长的添加水平与前人报道存在较大差异,这可能是动物的种类、试验条件、表面活性素有效含量等不同所致。
本研究中,饲料中添加表面活性素提高了吉富罗非鱼肠道脂肪酶活性(50 mg/kg添加组除外)。这可能与饲料中添加表面活性素后,吉富罗非鱼肠道绒毛高度和黏膜基层厚度显著增加,隐窝深度变浅,小肠成熟吸收细胞的数量显著增多有关[16]。小肠绒毛高度越高,隐窝深度越浅,即两者比值变大时,其对营养物质的吸收能力逐渐增强[16-17];肠道成熟细胞数量与肠道消化酶活性呈正相关[18],肠道成熟细胞数量增加能提高消化酶活性,进而促进营养物质的消化[19]。
表面活性素是由一个手性序列为L-L-D-L-L-D-L的七肽和一个含13~15个碳原子的β-羟基脂肪酸构成的复合物,分子质量约为1 036 u[20];其长脂肪酸链及肽链上的L-亮氨酸2、D-亮氨酸3、L-缬氨酸4、D-亮氨酸6、L-亮氨酸7构成了亲油基团,环链骨架与L-谷氨酸1和L-天冬氨酸52个酸性氨基酸残基构成亲水基团[21],少量表面活性素即可起到良好的乳化、起泡和增溶等效果[10]。因此,饲料中添加表面活性素可能发挥与饲用乳化剂类似的作用。此外,表面活性素还具有抗菌、抗病毒和抗氧化等生物活性,其不仅可以阻止引起饲料变质的致病菌和腐生菌的滋生,还可能抑制吉富罗非鱼肠道中有害菌的繁殖,改善肠道健康状况[16,22-23],从而促进鱼体生长。
然而,随着表面活性素添加水平的增加,吉富罗非鱼生长指标并未呈上升趋势,200 mg/kg添加组吉富罗非鱼的FBW、WGR和SGR显著低于50 mg/kg添加组。研究表明,表面活性素的多种生物学活性以表面活性作用为基础。当表面活性素发挥表面活性作用时,其乳化效果与用量直接相关,在临界胶束浓度(critical micelle concentration,CMC)以下时,其乳化能力随着用量的增加而增加;但超过CMC后,乳化性能趋于稳定,即使加大用量,乳化效果也不会有太大变化[24]。因此,本试验中添加200 mg/kg表面活性素可能已超过其CMC,乳化作用不再显著增强。此外,过量的外源乳化剂可能对机体自身胆汁酸分泌产生抑制作用,导致机体生长受到影响[25]。
3.2 饲料中添加表面活性素对吉富罗非鱼血清生化指标的影响
鱼类血清生化指标的变化能够动态反映鱼体的营养物质代谢和生理健康状况。当鱼类健康状况良好时,体内蛋白质代谢正常,血清UN处于较低水平[26-27]。本研究结果显示,饲料中添加表面活性素显著降低了吉富罗非鱼血清中UN水平,表明其有利于改善蛋白质的代谢,提高蛋白质沉积率[28]。ALB是鱼类血清中重要的运输蛋白,能维持鱼类血液中胶体渗透压和免疫球蛋白水平稳定。当肝胰脏功能受损时,血清中ALB比例会下降[29]。本试验中,饲料中添加表面活性素提高了吉富罗非鱼血清中ALB水平,表明表面活性素可以维持鱼类肝胰脏健康。
血液中的TG、TC、FFA和磷脂等脂类物质总称为血脂,其水平的变化常用来反映机体脂类代谢状况和健康水平[30]。TG是鱼类重要的能源物质,主要参与体内能量的产生与储存,血清中TG水平较高表明肝胰脏中脂肪的分解代谢较低[31]。TC是合成胆汁酸、维生素D和甾体激素的主要原料,并参与形成细胞膜[32]。血清中FFA水平可衡量机体脂肪动员的程度[33]。本研究中,饲料中添加表面活性素后吉富罗非鱼血清中TG、TC水平显著降低,FFA水平显著升高,表明添加表面活性素可促进机体对脂类物质的转化和利用,加速TC分解代谢,抑制TC在血液中的沉积,提高TG的转运和代谢,具有明显的降血脂作用。
鱼类体内的特异性免疫机制不完善,维持机体健康主要依赖于非特异性免疫机制[34]。血清中ACP、AKP和LZM活性等是常用来评价鱼类免疫功能状况的非特异性免疫指标。本试验中,饲料中添加表面活性素后吉富罗非鱼血清中AKP活性有增强的趋势,说明表面活性素一定程度地提高了机体的免疫力[35]。LZM是一种具有溶菌活性的碱性蛋白,具有抵抗病原微生物感染的作用,是鱼类生理防御水平的重要指标之一[36]。本研究中,饲料中添加表面活性素提高了吉富罗非鱼血清中LZM活性,表明非特异性免疫功能增强。可见,饲料中添加表面活性素可提高吉富罗非鱼的非特异性免疫功能,这可能与表面活性素具有抗菌、抗病毒活性有关[15-16]。
3.3 饲料中添加表面活性素对吉富罗非鱼肝胰脏脂肪代谢关键酶水平或活性的影响
鱼类的脂肪代谢主要在肝胰脏中完成,包括合成代谢、体内的转运以及分解代谢等过程。肝胰脏中相关代谢酶的水平或活性可以反映出鱼类体内脂肪的代谢状况[37]。FAS是催化乙酰辅酶A酶促系列反应合成棕榈酸的关键酶,ACC是催化乙酰辅酶A形成丙二酰辅酶A反应最关键的酶,两者在脂肪酸合成过程中起着重要作用,控制着体内脂肪合成的强弱,从而影响机体脂肪沉积[38]。饲料中添加表面活性素后,吉富罗非鱼肝胰脏FAS水平显著降低,表明脂肪的合成代谢受到抑制,但是对ACC水平无显著影响。HL和LPL是鱼类肝脏中参与脂肪降解的2种关键酶。HL作为配体,还可促进低密度脂蛋白和乳糜微粒残粒进入肝细胞,参与高密度脂蛋白胆固醇的逆转运和高密度脂蛋白残粒的分解[37]。LPL是一种糖蛋白,存在于多种细胞和组织中,主要催化血浆中乳糜微粒和极低密度脂蛋白中的TG分解[39],产生甘油并释放出FFA,从而控制TG在各组织的量[40]。本研究中,饲料中添加表面活性素后吉富罗非鱼肝胰脏HL和HPL活性显著升高,表明脂肪分解代谢增强。这可能与表面活性素促进载脂蛋白表达激活以及肝细胞中HL合成有关[10,41]。
4 结 论
饲料中添加表面活性素可提高吉富罗非鱼肠道脂肪酶活性、改善血清生化指标、调节脂肪代谢酶水平或活性,进而促进吉富罗非鱼生长。本试验条件下,建议吉富罗非鱼饲料中表面活性素添加水平为50 mg/kg。
[1] 程汉良,夏德全,吴婷婷.鱼类脂类代谢调控与脂肪肝[J].动物营养学报,2006,18(4):294-298.
[2] BORGES P,OLIVEIRA B,CASAL S,et al.Dietary lipid level affects growth performance and nutrient utilisation of senegalese sole (Soleasenegalensis) juveniles[J].The British Journal of Nutrition,2009,102(7):1007-1014.
[3] ANDREWS J T,GIESEN A F,SCOTT F R.Antioxidants manage effects of oxidation on feeds,feed ingredients[J].Global Aquaculture Advocate,2004,12(6):66,68.
[4] 牛福来,郭建来,胡迎利.乳化剂的作用机理及其在饲料工业中的应用研究进展[J].饲料工业,2013,34(7):13-16.
[5] OLSEN R E,KIESSLING A,MILLEY J E,et al.Effect of lipid source and bile salts in diet of atlantic salmon,SalmosalarL.,on astaxanthin blood levels[J].Aquaculture,2005,250(3/4):804-812.
[6] 李红霞,刘文斌,李向飞,等.饲料中添加氯化胆碱、甜菜碱和溶血卵磷脂对异育银鲫生长、脂肪代谢和血液指标的影响[J].水产学报,2010,34(2):292-299.
[7] 冯伟,王玲,张春晓,等.饲料脂肪源和乳化剂对牛蛙生长性能、肠道消化酶活力及肝脏生化指标的影响[J].动物营养学报,2015,27(6):1954-1962.
[8] SHALIGRAM N S,SINGHAL R S.Surfactin—a review on biosynthesis,fermentation,purification and applications[J].Food Technology and Biotechnology,2010,48(2):119-134.
[9] MEENA K R,KANWAR S S.Lipopeptides as the antifungal and antibacterial agents:applications in food safety and therapeutics[J].BioMed Research International,2014,48(6):1-25.
[11] 都海明,戚广州,王建军,等.抗菌脂肽对肉鸡生产性能和免疫机能的影响[J].江苏农业学报,2010,26(5):1009-1014.
[12] 都海明,戚广州,王建军,等.抗菌脂肽对断奶仔猪生长性能、肠道微生物及血液指标的影响研究[J].中国粮油学报,2011,26(5):76-82.
[13] 林逸朋.以半固态发酵生产表面素最适条件之探讨与作为饲料添加剂之研究[D].硕士学位论文.基隆:国立台湾海洋大学,2013.
[14] 石广举,孙力军,王雅玲,等.NT-6抗菌脂肽对凡纳滨对虾生长性能及养殖源头弧菌数的影响[J].广东农业科学,2014(12):119-122.
[15] 史庆超,卢俊姣,陆鹏,等.饲料中添加抗菌脂肽对吉富罗非鱼生长性能和肠道消化酶活性的影响[J].饲料工业,2014,35(12):6-10.
[16] 史庆超.抗菌肽Surfactin对吉富罗非鱼生长及肠道健康的影响[D].硕士学位论文.厦门:集美大学,2015.
[17] 李晋南,徐奇友,王常安,等.谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J].动物营养学报,2014,26(5):1347-1352.
[18] CASPARY W F.Physiology and pathophysiology of intestinal absorption[J].The American Journal of Clinical Nutrition,1992,55(Suppl.1):299S-308S.
[19] 刘莉如,杨开伦,滑静,等.抗菌肽对海兰褐仔公鸡小肠黏膜形态结构及免疫活性细胞数量的影响[J].动物营养学报,2013,25(1):190-197.
[20] KAKINUMA A,HORI M,ISONO M,et al.Determination of amino acid sequence in surfactin,a crystalline peptidelipid surfactant produced byBacillussubtilis[J].Agricultural and Biological Chemistry,1969,33(6):991-992.
[21] KAKINUMA A,SUGINO H,ISONO M,et al.Determination of fatty acid in surfactin and elucidation of the total structure of surfactin[J].Agricultural and Biological Chemistry,1969,33(6):973-976.
[22] 刘建新.动物营养研究进展(2012年版)[M].北京:中国农业科学技术出版社,2012:327-337.
[23] 翟少伟,李剑,史庆超.抗菌脂肽Surfactin的抗菌活性及应用[J].动物营养学报,2015,27(5):1333-1340.
[24] 李翌,邹爱华,叶汝强,等.表面活性素分子结构对其胶束化行为的影响[J].物理化学学报,2011,27(5):1128-1134.
[25] BAUER E,JAKOB S,MOSENTHIN R.Principles of physiology of lipid digestion[J].Asian Australasian Journal of Animal Sciences,2005,18(2):282-295.
[26] 张媛媛,刘波,戈贤平,等.不同脂肪源对异育银鲫生长性能、机体成分、血清生化指标、体组织脂肪酸组成及脂质代谢的影响[J].水产学报,2012,36(7):1111-1118.
[27] 周晓波,黄燕华,曹俊明,等.5种乳酸菌对罗非鱼生长性能、体成分、血清生化指标及肠道菌群的影响[J].动物营养学报,2014,26(7):2009-2017.
[28] 毛盼,胡毅,郇志利,等.投喂蚕豆饲料和去皮蚕豆饲料对草鱼生长性能、肌肉品质及血液生理生化指标的影响[J].动物营养学报,2014,26(3):803-811.
[29] 林丽花,柯芙容,詹湉湉,等.凝结芽孢杆菌对黄羽肉鸡生产性能、血清生化指标及抗氧化功能的影响[J].动物营养学报,2014,26(12):3806-3813.
[30] 邹思湘.动物生物化学[M].4版.北京:中国农业出版社,2008:205-209.
[31] WAGNER T,CONGLETON J L.Blood chemistry correlates of nutritional condition,tissue damage,and stress in migrating juvenile chinook salmon (Oncorhynchustshawytscha)[J].Canadian Journal of Fisheries and Aquatic Sciences,2014,61(7):1066-1074.
[32] 宋理平,冒树泉,马国红,等.饲料脂肪水平对许氏平鲉脂肪沉积、血液生化指标及脂肪代谢酶活性的影响[J].水产学报,2014,38(11):1879-1888.
[33] 郑银桦,彭聪,吴秀峰,等.酵母酶解物对大口黑鲈生长性能、脂类代谢及肠道组织结构的影响[J].动物营养学报,2015,27(5):1605-1612.
[34] 王自蕊,谯仕彦,李波,等.饲料中添加天蚕素抗菌肽对湘云鲫生长性能、非特异性免疫功能及抗病力的影响[J].动物营养学报,2014,26(7):1856-1863.
[35] 毛述宏,林鑫,杨阳,等.甘露聚糖酶对罗非鱼生长性能、消化代谢和非特异性免疫力的影响[J].动物营养学报,2013,25(7):1641-1647.
[36] 陈晓瑛,曹俊明,黄燕华,等.饲料中添加低聚木糖对凡纳滨对虾幼虾生长性能、非特异性免疫力、抗氧化功能及抗对虾白斑综合征病毒能力的影响[J].动物营养学报,2014,26(8):2397-2407.
[37] 朱瑞俊,李小勤,谢骏,等.饲料中添加氯化胆碱对草鱼成鱼生长、脂肪沉积和脂肪代谢酶活性的影响[J].中国水产科学,2010,17(3):527-535.
[38] TIAN J J,JI H,OKU H,et al.Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp,Ctenopharyngodonidellus[J].Aquaculture,2014,430:57-65.
[39] WANG A M,HAN G M,QI Z T,et al.Cloning of lipoprotein lipase (LPL) and the effects of dietary lipid levels onLPLexpression in GIFT tilapia (Oreochromisniloticus)[J].Aquaculture International,2013,21(6):1219-1232.
[40] 孙建珍,王际英,张利民,等.不同脂肪水平下添加胆汁酸对大菱鲆(Scophthalmusmaximus)幼鱼生长、体组成和脂肪代谢的影响[J].海洋与湖沼,2014,45(3):617-625.
[41] DONG G F,ZOU Q,WANG H,et al.Conjugated linoleic acid differentially modulates growth,tissue lipid deposition,and gene expression involved in the lipid metabolism of grass carp[J].Aquaculture,2014,432:181-191.
Author, ZHAI Shaowei, associate professor, E-mail: shaoweizhai@163.com
(责任编辑 菅景颖)
Effects of Surfactin Supplementation on Growth Performance,Serum Biochemical Indexes and Lipid Metabolism of Genetically Improved Farmed Tilapia (Oreochromisniloticus)
ZHAI Shaowei LI Jian SUN Xiuwen
(FisheriesCollegeofJimeiUniveristy,Xiamen361021,China)
A 7-week feeding trial was conducted to evaluate the effects of surfactin supplementation on growth performance, serum biochemical indexes and lipid metabolism of genetically improved farmed tilapia (GIFT,Oreochromisniloticus). Two hundred and forty GIFT with the average body weight of (12.0±0.1) g were randomly divided into four groups with four replicates in each group and 15 fish in each replicate. The fish of four groups were fed experimental diets supplemented with 0 (control group), 50, 100 and 200 mg/kg surfactin, respectively. Results showed as follows: the final body weight, weight gain rate and specific growth rate were significantly increased by surfactin supplementation (P<0.05), and final body weight, weight gain rate and specific growth rate of 50 mg/kg supplementation group were significantly higher than those of 200 mg/kg supplementation group (P<0.05); the feed conversion ratio was significantly decreased by surfactin supplementation (P<0.05). Feeding rate and survival rate of all groups were similar (P>0.05). The lipase activity (except the 50 mg/kg supplementation group) in intestinal tract was significantly increased by surfactin supplementation (P<0.05), but the activities of amylase and protease were not significantly different among all groups (P>0.05). The serum urea nitrogen level was decreased by surfactin supplementation, and the significant difference was found between 50 mg/kg supplementation group and control group (P<0.05). The levels of serum albnmin and free fatty acid of supplementation groups were significantly higher than those of control group (P<0.05). The levels of serum total cholesterol (except the 200 mg/kg supplementation group) and triglyceride of supplementation groups were significantly lower than those of control group (P<0.05). The activities of serum acid phosphatase and alkaline phosphatase were not significantly different among all groups (P>0.05). The serum lysozyme activity of surfactin supplementation groups were significantly higher than that of control group (P<0.05), and the lysozyme activity of 50 mg/kg supplementation group was the highest among all groups. Compared with control group, the fatty acid synthetase level in hepatopancreas of supplementation groups were significantly decreased (P<0.05), while the acetyl CoA carboxylase level in hepatopancreas was not affected by surfactin supplementation (P>0.05). The activities of hepatic lipase and lipoprotein lipase in hepatopancreas were significantly increased by surfactin supplementation (P<0.05), but no significant differences of those two enzymes were found among all supplementation groups (P>0.05). In conclusion, the recommended dietary surfactin supplementation level is 50 mg/kg, which can increase the intestinal lipase activity, improve the serum biochemical indexes and regulate the enzyme levels/activities of lipid metabolism, and then improve the growth of GIFT under present experimental condition.[ChineseJournalofAnimalNutrition, 2015, 27(12):3959-3967]
surfactin; genetically improved farmed tilapia; growth performance; lipid metabolism
10.3969/j.issn.1006-267x.2015.12.038
2015-06-04
科技部国际科技合作与交流专项“海洋生物表面活性素应用于水产动物饲料的研究”(2014DFT30150)
翟少伟(1973—),男,河北晋州人,副教授,硕士生导师,博士,研究方向为动物营养与饲料资源开发。E-mail: shaoweizhai@163.com
S963
A
1006-267X(2015)12-3959-09
