动物源性食品中β-肾上腺素受体兴奋剂残留研究
2015-05-09顾丽群王明进熊和琴李宣敏
黎 俊 顾丽群 王明进 熊和琴 何 虎 李 雷 李宣敏
(毕节市动物产品质量安全监督检验所,毕节551700)
动物源性食品中β-肾上腺素受体兴奋剂残留研究
黎 俊 顾丽群*王明进*熊和琴 何 虎 李 雷 李宣敏
(毕节市动物产品质量安全监督检验所,毕节551700)
β-肾上腺素受体兴奋剂(简称β-兴奋剂)具有降低动物体内脂肪含量,促进蛋白质合成和提高饲料转化率的作用,常被用作饲料添加剂用于畜产品的生产,但由于其在动物体内的残留并通过食物链最终进入人体,给人类健康带来潜在威胁,大多数国家已颁布一系列法律法规明令禁止在畜牧业中使用该类药物。本文通过介绍β-兴奋剂的作用机制、检测标准和检测方法,为今后该类药物残留的研究提供参考。
β-兴奋剂;β-肾上腺素受体;残留;作用机制;检测标准;检测方法
β-肾上腺素受体兴奋剂(β-adrenoceptor agonists),简称β-兴奋剂或β-激动剂(β-agonists),是一类化学结构和生理功能类似2种天然β-激动剂[肾上腺素和去甲肾上腺素(norepinephrine)]的苯乙胺类(phenethylamines,PEAs)化学合成衍生物,因能选择性地与动物体内大多数组织细胞膜上的β-肾上腺素受体(β-adrenergic receptor,β-AR)结合而得名[1-2]。从结构上看,β-兴奋剂类药物具有苯乙醇胺结构母核(图1),苯环上连接碱性的β-羟胺侧链,侧链取代基通常有N-叔丁基、N-异丙基或N-烷基苯,能与大多数无机酸和有机酸成盐[3]。早在1933年,Easson等[4]研究指出,β-兴奋剂与受体结合的3个主要活性位点是β-羟基基团、脂肪氮和芳香环,其中芳香环是β-兴奋剂与受体结合发生生物学效应的关键结构,苯环上取代基通常有羟基、卤素、氨基、羟甲基、氰基或它们的结合。根据苯环上取代基的差异,可将β-兴奋剂分为苯胺型和苯酚型。苯胺型结构中具有芳伯氨基,中等极性,典型药物有克伦特罗(clenbuterol)、马布特罗(mabuterol)、西马特罗(cimaterol)和溴布特罗(brombuterol)等。苯酚型结构一般在母核苯环上的C3~C5位含有1~2个酚羟基,极性高。根据母核苯环上羟基取代基的位置或数量,苯酚型结构又可分为苯酚型、邻或间苯二酚型和水杨醇型,其中具有苯酚型结构的有莱克多巴胺(ractopamine)、苯氧丙酚胺(isoxsuprine)和利托君(ritodrine)等;邻苯二酚型(儿茶酚型)结构的有异丙肾上腺素(isoproterenol)、去甲肾上腺素和多巴酚丁胺(dobutamine)等;间苯二酚型(雷索酚型)结构的有特布他林(terbutaline)、非诺特罗(fenoterol)和异丙喘宁(metaproterenol)等;水杨醇型结构的有沙丁胺醇(salbutamol)、帕布特罗(pirbuterol)和沙美特罗(salmeterol)等。一些常见的β-兴奋剂结构如图2。
在医学上,β-兴奋剂属拟交感神经类作用药,具有松弛平滑肌,扩张支气管的作用,常用来治疗支气管哮喘类病症[5]。20世纪80年代有研究表明,β-兴奋剂能影响营养物质在动物体内的流向和重新分配,使动物体内脂肪代谢增强,蛋白质合成增加,可以明显提高胴体瘦肉率和饲料利用率[6-7]。同时,大多数β-兴奋剂具有口服活性和热稳定性,因而被非法作为饲料添加剂用于畜产品的生产,以促进动物生长和改善肉质。但是,该类药物残留会聚集在动物可食用组织中,如果违法超量使用将会引起心悸、头疼、目眩、恶心甚至损害肝脏和肾脏等毒副作用[8-9],因而包括我国在内的许多国家已明令禁止将此类药物作为饲料添加剂用于畜产品的生产。世界上使用最广泛的β-兴奋剂有克伦特罗、沙丁胺醇和莱克多巴胺等,近年来,由于世界范围内对其禁用,其他β-兴奋剂如马布特罗、溴布特罗和马喷特罗等的使用也越来越多,而且当一种药物被禁用时,不断有新的β-兴奋剂作为替代品出现,严重影响人类健康,所以关于β-兴奋剂的研究一直是动物营养领域中的热点。本文就从β-兴奋剂的作用机制、检测标准和检测方法3个方面综述了其研究进展。

图1 β-兴奋剂的基本化学结构

图2 常见β-兴奋剂的化学结构
1 β-兴奋剂的作用机制
1.1 β-AR及亚型
β-AR几乎存在于所有哺乳动物细胞膜上,是一种镶嵌于细胞膜脂质双层中的整合糖蛋白,由1条氨基酸链,400多个氨基酸残基组成,分子质量约64 ku[11-12]。β-AR包括7个疏水性α螺旋结构的跨膜结构域,受体分子通过该结构被锚定于细胞膜上,并且在细胞质膜内外分别形成3个环状亲水性跨膜结构域。β-AR与配体结合位点位于7个跨膜结构域的中心,而与Gs蛋白反应的位点位于细胞内的3个环状结构上[12-13]。β-AR的结构模型见图3。
β-AR包括3个亚型:β1-AR、β2-AR和β3-AR。其中,β3-AR是人们在20世纪70年代中期研究脂肪组织时发现的,其与β1-AR和β2-AR不同的是几种β1-AR、β2-AR的拮抗剂对β3-AR具有一定的兴奋作用[14]。大多数动物细胞内都存在β-AR,但其亚型分布和比例因动物种类和组织来源而异。β1-AR主要分布于心脏和脂肪细胞膜上,与提高心率和心脏输出能力、脂肪细胞脂解和能量生成有关。β2-AR主要分布于骨骼肌、平滑肌和肝脏细胞膜上,与气管和支气管松弛、骨骼肌收缩以及血管平滑肌松弛有关。另外,在心脏中也存在少量β2-AR。在大鼠上研究发现,β3-AR主要存在于棕色脂肪和白色脂肪组织中,同时也存在于肠骨骼肌、心肌上,其药理作用与β1-AR和β2-AR有明显区别。研究表明,这3种β-AR亚型在同种动物体内氨基酸序列的同源性接近50%,不同动物物种之间,同种受体的同源性可达75%或更高[15]。
1.2 β-兴奋剂的作用机制
β-AR的生理功能主要是由于β-兴奋剂与β-AR结合,形成的复合物激活了Gs蛋白,从而使机体发生一系列生理生化反应的过程。
当β-兴奋剂与β-AR的跨膜3、5、6功能区结合后将引起β-AR构象的改变,激活Gs蛋白,然后Gs蛋白的α亚基与三磷酸鸟苷(GTP)结合并催化释放二磷酸鸟苷(GDP),Gs蛋白的α亚基结合GTP后从Gs蛋白上解离,从Gs蛋白解离下的α亚基进而激活腺苷酸环化酶并催化产生环磷酸腺苷(cAMP),cAMP又作为第二信使与蛋白激酶A的调节亚基结合,并使蛋白激酶A释放其催化亚基,导致细胞内多种酶被磷酸化,被磷酸化后的酶部分被激活(如激素敏感脂酶、脂肪细胞甘油三酯降解限速酶等)或抑制(如乙酰辅酶A羧化酶、长链脂肪酸生物合成限速酶等)[16-17],被激活的酶促进脂肪分解,被抑制的酶抑制脂肪合成,最终降低脂肪沉积,β-兴奋剂的作用机制见图4。
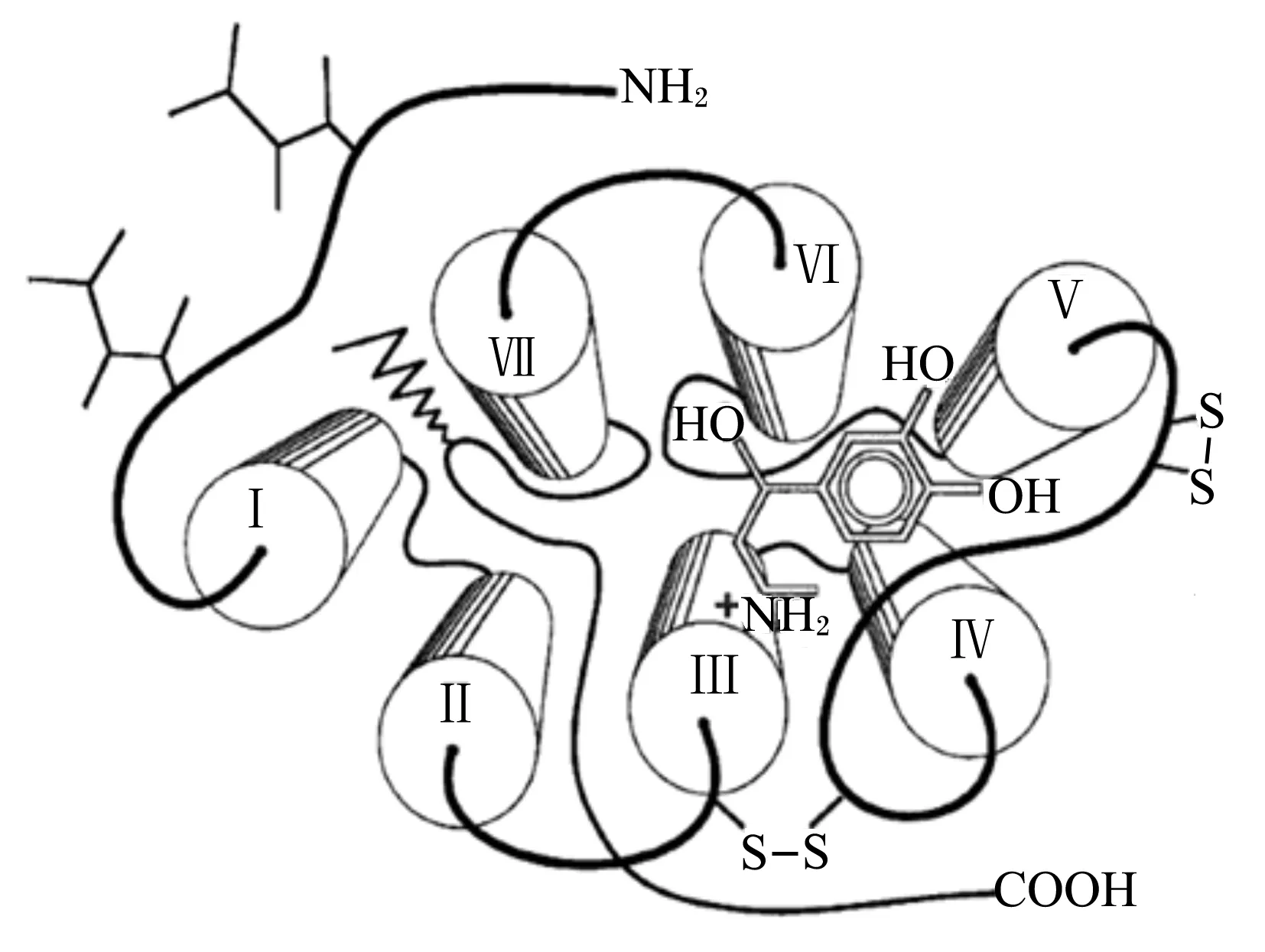
H2N—:氨基amino;HO—:羟基hydroxy;COOH—:羧基carboxy;—S—S—:二硫键disulfide bond。
图3β-AR的结构模型
Fig.3 Projected structure ofβ-AR[16]
2 β-兴奋剂残留的检测标准和检测方法
2.1 β-兴奋剂残留的检测标准
1999年9月13日,我国农业部发布了关于修订《动物性食品中兽药最高残留限量》[18]的公告(农牧发[1999]17号),首次规定了克伦特罗在马和牛肌肉、内脏、肾脏及牛奶中的最高残留限量(MRL)分别为0.1、0.5、0.5、0.05 μg/kg,而美国食品药品监督管理局(FDA)和世界卫生组织(WHO)规定的克伦特罗在动物体内的MRL为:肌肉0.2 μg/kg、肝脏0.6 μg/kg、肾脏0.6 μg/kg、脂肪0.2 μg/kg、奶0.05 μg/kg。由此可见,我国政府规定的MRL略低于FDA和WHO的标准。2002年12月,农业部第235号公告修订了《动物性食品中兽药最高残留限量》,同时废除农牧发[1999]17号。该规定指出,克伦特罗在所有动物性食品中不得检出。
近年来,我国卫生部、农业部和国家质量监督检验检疫总局发布了关于检测沙丁胺醇、盐酸克伦特罗和莱克多巴胺等β-兴奋剂残留的国家标准和行业标准(表1)[19-22],并且全国各省、自治区、直辖市以及地(州)县均设立了质量技术监督部门和产品质量监督检验机构,加大了对食品安全(特别是药物残留)监管和检测力度,建立了一套相对完善的β-兴奋剂残留检测标准,为β-兴奋剂残留的确证提供依据。

β-AR:β-肾上腺素受体β-adrenergic receptor;ATP:三磷酸腺苷 adenosine triphosphate;cAMP:环磷酸腺苷 cyclic adenosine monophosphate。
图4β-兴奋剂的作用机制
Fig.4 Acting mechanism ofβ-agonists[11]
2.2 β-兴奋剂残留的检测方法
理想的β-兴奋剂的检测过程应包括有效提取、分离净化和高灵敏的检测。β-兴奋剂残留的检测分析方法包括色谱法,如高效液相色谱(HPLC)、液相色谱-串联质谱(LC-MS/MS)和气相色谱-质谱(GC-MS)等;免疫分析法(IA),如酶联免疫测定法[酶联免疫分析法(enzyme-linked immunoassay,EIA)和酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)]、放射免疫分析法(radioimmunoassay,RIA)、荧光免疫分析法(fluorescence immunoassay,FIA)等;生物技术测定法,如生物传感器(biosensor,BS)技术、生物芯片(biochip)技术等。β-兴奋剂残留的检测方法虽多,但各有其优缺点。色谱法在检测β-兴奋剂中具有灵敏度高、检测结果最为准确的特点,可作为最终的确证性检测方法,但样品前处理繁琐、操作费时,并需要昂贵的仪器及专业的人员操作,不适合大批量样品的检测。然而,免疫分析法,尤其是ELISA却能克服以上缺点,具有快速、灵敏、操作简便等优点,非常适合大批量样品的检测,检测结果与HPLC、GC-MS具有较高的一致性,起到很好的检测筛选作用,其缺点是容易出现假阳性。
2.2.1 色谱法
HPLC是近年来发展速度快,具有高效分离和检测能力的方法,我国将其作为“瘦肉精”残留检测的半确证法,其最低检出限为0.05 μg/kg。在技术上,HPLC设备采用高压泵、高效固定相和高灵敏度检测器,具有分离速度快、分离效率高、检测结果准确和假阳性率低等优点,但也存在检测过程繁琐、检测时间长、不易操作等缺点[23]。HPLC检测一般先将样品中蛋白质去除,然后再经过柱净化和富集,最后上机检测分析[24]。
GC-MS是β-兴奋剂残留检测中最常用的定量和确证方法。与HPLC类似,在检测前需要将样品进行去蛋白质处理,然后再经过提取和净化,但由于β-兴奋剂不易被气化,因而样品经过提取和净化后还需进行衍生化处理才能进行气相色谱仪检测[11]。与HPLC相比,GC-MS灵敏度更高,假阳性率更低,并且可以对多种残留物进行定性和定量分析,我国已将其作为β-兴奋剂残留检测的确证法。GC-MS的缺点与HPLC类似,仪器昂贵、操作较难,在实际检测中,建议将该法与ELISA结合起来,先用ELISA进行初步筛选,再用GC-MS进行确证较为理想。
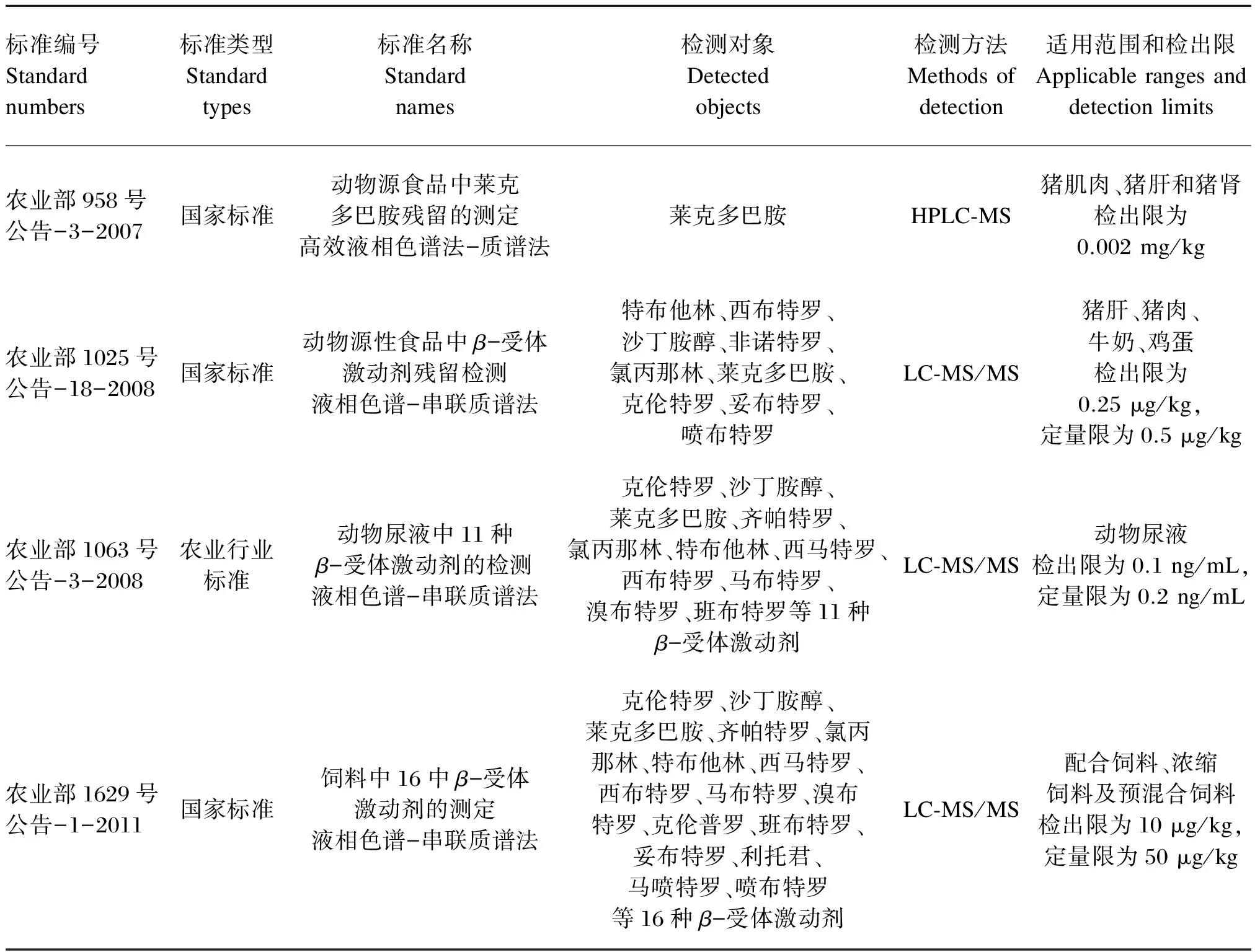
表1 β-兴奋剂的检测标准
LC-MS/MS能提供更详细的药物结构信息,受干扰少,比GC-MS具有更高的特异性和灵敏性。但LC-MS/MS设备价格昂贵,样品前处理繁琐,检测速度慢[1]。
2.2.2 IA
IA是根据抗原与抗体的特异性免疫反应原理而建立起来的检测分析技术。按示踪物及标记种类差异,IA可分为RIA、FIA、EIA、化学发光免疫分析法(chemiluminescence immunoassay,CIA)、胶体金免疫分析法(colloidal gold immunoassay,CGIA)、时间分辨免疫荧光测定(time-resolved fluoroimmunoassay,TRFIA)和毛细管电泳免疫分析(capillary electrophoresis based immunoassay,CEIA)等[11],本文重点介绍EIA、CGIA、TRFIA、CEIA。
ELISA是在酶免疫技术的基础上发展起来的一种新型的免疫测定技术,也是目前应用最多的一种免疫分析技术,其基本原理是采用抗原与抗体的特异性免疫反应将待测物与酶连接,然后通过酶与底物产生颜色反应,进行定量测定。该方法具有操作方便、检测迅速等优点,欧盟已将其作为β-兴奋剂残留检测的首选筛检方法,但该技术检测结果可能存在假阳性,不能实现在线检测等缺点[1],结合其他定性定量检测最为理想。近年来,一些新的免疫技术在生物学和医学领域已经成为有效的研究手段,如CGIA,样品无需预处理,可进行在线检测。张慧嫦等[25]用CGIA快速检测动物组织中盐酸克伦特罗残留,分析过程仅需5 min,检出限达0.5 ng/mL。姜金庆等[26]利用胶体金作为示踪物,采用抗体标记模式,成功研制出同时检测克伦特罗和莱克多巴胺的多残留胶体金免疫层析试纸条,整个实验过程可在5~8 min内凭肉眼观察结果,操作简单,非常适合现场检测。
TRFIA技术是一种新型的超微量非放射性标记免疫分析技术,它常用三价稀土离子及其螯合物作为示踪物,以代替放射性同位素、荧光物质、酶和化学发光物质来标记抗原、抗体、核酸探针等物质[27]。当免疫反应发生后,用时间分辨荧光仪测定最后产物中的荧光强度,根据荧光强度和相对荧光强度比值,判断反应体系中分析物的浓度,以达到定量检测的目的[28]。该方法具有高精度、自动化、示踪物稳定、大样本快速检测(1~2 h就能出结果)等优点,已逐步成为生物医学研究和临床超微量生化检验中一项最有发展前景的分析手段[29],但在β-兴奋剂类残留检测方面的报道很少。何明祥[27]采用铕离子(Eu3+)标记的Sal-OVA抗原为示踪物,利用TRFIA建立起快速、高灵敏度的猪尿液中沙丁胺醇全自动检测方法,检测灵敏度为0.04 ng/mL,平均回收率达106.5%。
CEIA是将免疫反应基本原理与毛细管电泳分离检测方法相结合的一种分析新技术,该技术利用抗原抗体复合物与游离抗原、抗体在电泳上的行为差异,将毛细管电泳作为分离分析手段[30]。CEIA技术最早可追溯到1986年Hurrell利用毛细管电泳进行抗原、抗体和半抗原的分离开始,此后,随着仪器自动化的发展,到2013年底,据不完全统计,发表在国内外期刊上关于毛细管电泳的文章已达7 000余篇,但大多数都是关于临床和药物分析方面,而关于β-兴奋剂检测的文献很少。
IA一般作为筛选方法,由于样品中待测物结构信息少,易出现假阳性,故该方法需结合其他定性定量检测技术进行最终确证。
2.2.3 生物技术测定法
BS技术是近几年发展起来的一项用于检测β-兴奋剂类药物的新技术,BS是由固定化的生物敏感材料作为识别元件,再结合适当的理化换能器及信号输出显示装置所构成的分析工具或系统。BS的基本原理是当传感器的分子识别元件与被检测物接触后,通过引发化学变化、光变化和热变化产生电信号,再经过信号输出装置将电信号输出显示进行检测的方法。Traynor等[31]和Lu等[32]利用表面等离子体共振BS技术分别检测了肝脏组织中β-兴奋剂和猪肌肉组织中莱克多巴胺残留量均取得很好效果。BS与计算机紧密结合,实现采样、进样、显示、分析等的自动化是未来BS技术检测β-兴奋剂残留发展的方向。
生物芯片技术是生命科学领域中迅速崛起的一项高新技术,被喻为21世纪生命科学的支撑技术,是自20世纪90年代中期以来影响最深远的重大科技进展之一。其基本原理是通过在玻璃片、硅片等材料上固定样本,通过微加工技术以实现对核酸、蛋白质、化合物等准确、快速、高通量的检测分析[33]。与其他方法相比,生物芯片技术的突出优点是能够在短时间内检测大量的分子,如饲料中β-兴奋剂类添加剂和兽药残留等的检测[34]。李琴等[35]利用生物芯片技术同时测定乳和乳粉中β-兴奋剂类残留量,得出其最低检出限为0.1 μg/kg,回收率达99%以上。
3 小 结
近年来,尽管国内外都加大了对β-兴奋剂类药物的监管和检测力度,但仍然存在将其作为饲料添加剂应用于畜产品生产的情况,引起食品安全的事件时有发生。因此,尽快建立一套完善的、快速的β-兴奋剂类药物残留的检测方法,对进一步健全和完善我国食品安全保障体系,保护人类健康,促进经济社会发展具有重要意义。一套完善快速的检测体系应着重从以下方面展开研究:缩短样品预处理时间,增加样品预处理效率;扩大样品残留的检测范围;深入开展仪器操作的简便化和自动化。
[1] 翟福丽,赖克强,张衍亮,等.动物性食品中β-兴奋剂残留概述[J].食品科学,2011,32(5):351-356.
[2] 王若军,郭年藩.β-肾上腺素能兴奋剂的作用机理及应用效果(上)[J].国外畜牧科技,1993,20(6):20-21.
[3] 许青华.沙丁胺醇药物残留酶联免疫检测法的建立[D].硕士学位论文.广州:华南理工大学,2012.
[4] EASSON L H,STEDMAN E.Studies on the relationship between chemical constitution and physiological action:molecular dissymmetry and physiological activity[J].Biochemical Journal,1933,27(4):1257-1266.
[5] SALPETER S R,BUCKLEY N S,ORMISTON T M,et al.Meta-analysis:effect of long-actingβ-agonists on severe asthma exacerbations and asthma-related deaths[J].Annals of internal medicine,2006,144(12):904-912.
[6] BAKER P K,KIERNAN J A.Phenylethanolamine derivatives and acid addition salts thereof for enhancing the growth rate of meat-producing animals and improving the efficiency of feed utilization thereby[P].United States Patent 4404222,1983-09-13.
[7] BAKER P K,DALRYMPLE R H,INGLE D L,et al.Use of aβ-adrenergic agonist to alter muscle and fat deposition in lambs[J].Journal of Animal Science,1984,59(5):1256-1261.
[8] VANOOSTHUYZE K E I,ARTS C J M,VAN PETEGHEM C H.Development of a fast and simple method for determination ofβ-agonists in urine by extraction on empore membranes and detection by a test strip immunoassay[J].Journal of Agricultural and Food Chemistry,1997,45(8):3129-3137.
[9] SHELVER W L,SMITH D J.Determination of ractopamine in cattle and sheep urine samples using an optical biosensor analysis:comparative study with HPLC and ELISA[J].Journal of Agricultural and Food Chemistry,2003,51(13):3715-3721.
[10] SMITH D J.The pharmacokinetics,metabolism,and tissue residues of beta-adrenergic agonists in livestock[J].Journal of Animal Science,1998,76(1):173-194.
[11] 汪慧蓉.β-兴奋剂克伦特罗、沙丁胺醇的免疫检测方法研究[D].硕士学位论文.西安.西北大学,2006.
[12] 王选年.β-肾上腺素受体激动剂克伦特罗的免疫特性及中毒病理学研究[D].博士学位论文.长春:中国人民解放军军需大学,2002.
[13] 段铭,高宏伟,梁鸿雁.β-肾上腺素受体兴奋剂的作用机制及药学特性的研究进展[J].黑龙江八一农垦大学学报,2001,13(2):76-81.
[14] ARCH J R S,KAUMANN A J.β3and atypicalβ-adrenoceptors[J].Medicinal Research Reviews,1993,13(6):663-729.
[15] PIÉTRI-ROUXEL F,LENZEN G,KAPOOR A,et al.Molecular cloning and pharmacological characterization of the bovineβ3-adrenergic receptor[J].European Journal of Biochemistry,1995,230(1):350-358.
[16] MERSMANN H J.Overview of the effects of beta-adrenergic receptor agonists on animal growth including mechanisms of action[J].Journal of Animal Science,1998,76(1):160-172.
[17] 陈刚,周光宏.β-肾上腺素能激动剂作用机理及对生长代谢的影响[J].青海畜牧兽医杂志,1998,28(4):38-39.
[18] 农业部.农牧发第17号.关于发布《动物性食品中兽药最高残留限量》的通知[EB/OL].1999.http://www.moa.gov.cn/ztzl/xumugb/99-2-2.htm
[19] 中华人民共和国农业部.农业部958号公告-3-2007 动物源食品中莱克多巴胺残留量的测定-高效液相色谱法-质谱法[OL].北京:中国标准出版社,2007.
[20] 中华人民共和国农业部.农业部1025号公告-18-2008 动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法[OL].北京:中国农业出版社,2008.
[21] 中华人民共和国农业部.农业部1063号公告-3-2008 动物尿液中11种β-受体激动剂的检测液相色谱-串联质谱法[OL].北京:中国标准出版社,2008.
[22] 中华人民共和国农业部.农业部1629号公告-1-2011 饲料中16种β-受体激动剂的检测 液相色谱-串联质谱法[OL].北京:中国农业出版社,2011,
[23] 赵晓风,徐雪华,万宇平,等.β2-兴奋剂类药物残留检测的研究进展[J].四川畜牧兽医,2011,38(7):29-30,33.
[24] 赵亚华.动物性食品中β2-受体激动剂残留检测技术的研究概况[J].中国卫生检验杂志,2003,13(3):387-390.
[25] 张慧嫦,张少恩,吴忠华,等.胶体金免疫层析法快速检测盐酸克伦特罗残留[J].中国国境卫生检疫杂志,2008,31(1):39-42.
[26] 姜金庆,杨雪峰,王自良,等.克伦特罗和莱克多巴胺多残留胶体金免疫层析试纸条的研制[J].畜牧兽医学报,2013,44(1):87-94.
[27] 何明祥.沙丁胺醇时间分辨荧光免疫分析检测技术的研究[J].长江大学学报:自然科学版,2009,6(1):33-37.
[28] 武学成,何林,周克元.时间分辨荧光免疫分析技术及临床应用[J].医学综述,2006,12(7):434-436.
[29] 杭建峰,吴英松,李明.时间分辨荧光免疫分析的研究进展及应用[J].热带医学杂志,2004,4(3):340-343,304.
[30] 徐汉琴.毛细管电泳免疫分析综述[J].中国医学研究与临床,2006,4(4):27-30.
[31] TRAYNOR I M,CROOKS S R H,BOWERS J,et al.Detection of multi-β-agonist residues in liver matrix by use of a surface plasma resonance biosensor[J].Analytica Chimica Acta,2003,483(1/2):187-191.
[32] LU X,ZHENG H,LI X Q,et al.Detection of ractopamine residues in pork by surface plasmon resonance-based biosensor inhibition immunoassay[J].Food Chemistry,2012,130(4):1061-1065.
[33] 陶亮亮,寇庆,梁咪娟.饲料中β-兴奋剂检测方法的研究进展[J].中国饲料,2011(21):6-8.
[34] KNECHT B G,STRASSER A,DIETRICH R,et al.Automated microarray system for the simultaneous detection of antibiotics in milk[J].Analytical Chemistry,2004,76(3):646-654.
[35] 李琴,姜金斗,姜全忠,等.生物芯片技术用于同时测定乳与乳粉中β-兴奋剂类残留量[J].中国乳品工业,2014,42(2):52-54,64.
*Corresponding authors: GU Liqun, senior livestock engineer, E-mail: 30986428@qq.com; WANG Mingjin, senior livestock engineer, E-mail: wangmj1967@163.com
(责任编辑 陈 燕)
Research ofβ-Adrenoceptor Agonists Residues in Foodstuffs of Animal Origin
LI Jun GU Liqun*WANG Mingjin*XIONG Huoqin HE Hu LI Lei LI Xuanmin
(BijieAnimalProductsQualitySecuritySupervisionandInspectionCenter,Bijie551700,China)
β-adrenoceptor agonists (β-agonists for short) possess the capacity to regulate nutrient metabolism in an animal body, such as decreasing fat content, promoting protein synthesis and increasing feed efficiency. A lot of profit-oriented illegal users often use it as feed additive for animal products, but its residues in animal products eventually enter human body through food chain, which may pose potential risks to human health, so many countries have passed a series of laws and regulations to prohibit the use ofβ-agonists in animal husbandry. This article reviewed the mechanisms of action, standards and methods of detection ofβ-agonists, which would provide the reference in the study ofβ-agonists residues.[ChineseJournalofAnimalNutrition, 2015, 27(12):3663-3670]
β-agonists;β-adrenoceptor; residues; mechanisms of action; standards of detection; methods of detection
10.3969/j.issn.1006-267x.2015.12.003
2015-07-02
国家农业科技成果转化资金项目(2012GB2F200408);国家绒毛用羊产业体系建设项目(CARS-40-30,CARS-40-461)
黎 俊(1986—),男,贵州遵义人,畜牧师,硕士,主要从事动物营养与农畜产品质量安全监测方面的研究。E-mail: lijun8776@163.com
*通信作者:顾丽群,高级畜牧师,E-mail: 30986428@qq.com;王明进,高级畜牧师,E-mail: wangmj1967@163.com
S816.79
A
1006-267X(2015)12-3663-08
