饲料中添加β-葡聚糖对黄颡鱼幼鱼生长性能、血清生化指标及抗嗜水气单胞菌感染能力的影响
2015-05-09李永娟王卫民黄燕华曹俊明王国霞
李永娟 王卫民 黄燕华 曹俊明* 王国霞
赵红霞1,3,4 刘少昱1,3,4 马永萍1,3,4
(1.广东省农业科学院动物科学研究所,广州510640;2.华中农业大学水产学院,武汉430070;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
饲料中添加β-葡聚糖对黄颡鱼幼鱼生长性能、血清生化指标及抗嗜水气单胞菌感染能力的影响
李永娟1,2,3,4王卫民2黄燕华1,3,4曹俊明1,3,4*王国霞1,3,4
赵红霞1,3,4刘少昱1,3,4马永萍1,3,4
(1.广东省农业科学院动物科学研究所,广州510640;2.华中农业大学水产学院,武汉430070;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
为研究饲料中添加β-葡聚糖对黄颡鱼幼鱼生长性能、血清生化指标及抗嗜水气单胞菌感染能力的影响,在基础饲料中分别添加200、600和1 000 mg/kg β-葡聚糖配制3种试验饲料。选取初始体重为(1.53±0.04) g的健康黄颡鱼幼鱼720尾,随机分为7组,包括1个投喂基础饲料的对照组(G0组)、3个连续投喂添加β-葡聚糖饲料的连续投喂组(SG200、SG600、SG1000组)及3个间隔投喂添加β-葡聚糖饲料和基础饲料各7 d的间隔投喂组(IG200、IG600、IG1000组)。连续投喂组每组4个重复,对照组和间隔投喂组每组3个重复,每个重复均为30尾鱼。试验期为42 d。养殖试验结束后,注射嗜水气单胞菌进行感染试验,计算96 h内的累计死亡率。结果显示:1)7组黄颡鱼幼鱼的增重率、饲料系数、蛋白质效率和存活率均没有显著差异(P>0.05),但IG1000组的肝体比较对照组显著降低(P<0.05)。各β-葡聚糖添加组的增重率和蛋白质效率与对照组相比均有所升高,且连续投喂组的增重率高于对应的间隔投喂组,并在SG600组达到最高。2)各β-葡聚糖添加组全鱼粗蛋白质、粗脂肪和粗灰分含量均高于对照组,同时水分含量均低于对照组,但组间差异不显著(P>0.05)。3)饲料中添加β-葡聚糖对黄颡鱼幼鱼各血清生化指标均无显著影响(P>0.05);与对照组相比,SG1000和IG600组血清球蛋白和总蛋白含量有所升高,各β-葡聚糖添加组血清谷丙转氨酶和谷草转氨酶活性均有所降低。4)嗜水气单胞菌感染96 h后,各组的累计死亡率在35%~46%之间,组间差异不显著(P>0.05)。由此得出,除间隔投喂1 000 mg/kg β-葡聚糖显著降低肝体比外,不论采取连续投喂还是间隔投喂方式,饲料中添加200、600和1 000 mg/kg β-葡聚糖对黄颡鱼幼鱼的生长性能、体成分、血清生化指标及抗嗜水气单胞菌感染能力均没有显著影响。
β-葡聚糖;黄颡鱼;生长性能;血清生化指标;嗜水气单胞菌
黄颡鱼(Pelteobagrusfulvidraco)又名黄腊丁,属鲶形目,鲿科,黄颡鱼属,是淡水水体中分布较广的底层经济杂食性鱼类,也是我国经济结构调整的优良品种。近年来,随着黄颡鱼集约化和规模化养殖的发展,病害防控越来越成为人们关注的焦点。应用β-葡聚糖等免疫增强剂提高黄颡鱼的非特异性免疫能力和对病害的抵抗力,是解决此类问题的有效途径之一。目前,关于β-葡聚糖对黄颡鱼生长性能和抗病力等的研究尚未见报道。因此,本试验通过在饲料中添加不同水平的β-葡聚糖,并采用连续和间隔2种投喂方式,研究β-葡聚糖对黄颡鱼幼鱼生长性能、体成分、血清生化指标及抗嗜水气单胞菌感染能力的影响,以便为β-葡聚糖在黄颡鱼饲料中的应用提供理论依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕为主要蛋白质源,高筋面粉为主要糖源,鱼油为主要脂肪源配制基础饲料,其组成及营养水平见表1。在基础饲料中分别添加200、600和1 000 mg/kg酵母β-葡聚糖配制3种试验饲料。酵母β-葡聚糖主链为β-1,3结构,纯度>90%,来自安琪酵母有限公司。饲料原料经粉碎后过40目筛,按配方准确称取。β-葡聚糖以高筋面粉作为载体,再逐级放大。各种饲料成分充分混匀,用SLX-80型双螺杆挤压机制成粒径为1.5 mm的颗粒饲料,55 ℃烘干,自然冷却后放入密封袋中,置于-20 ℃冰箱中保存备用。
1.2 试验鱼与饲养管理
试验用黄颡鱼幼鱼购自广东省清远市黄沙渔业基地,养殖试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统中进行。养殖系统包括24个350 L圆柱形纤维玻璃缸(直径80 cm,高70 cm,水体体积约为300 L),进水速率为1.5 L/min。养殖用水为曝气的自来水,经珊瑚石、活性炭过滤。将购买的鱼苗先放在室外水泥池中暂养2周,期间投喂不含β-葡聚糖的商品饲料,每天2次。试验开始时,选取初始体重(1.53±0.04) g的黄颡鱼幼鱼720尾,随机分为7组,分别为投喂基础饲料组(G0组,作为对照组)、连续投喂添加200、600和1 000 mg/kg β-葡聚糖饲料的3个连续投喂组(SG200、SG600和SG1000组)和先投喂添加200、600、1 000 mg/kg β-葡聚糖饲料7 d、再投喂基础饲料7 d的3个间隔投喂组(IG200、IG600和IG1000组)。其中,连续投喂组每组4个重复,对照组和间隔投喂组每组3个重复,每个重复均为30尾鱼。每天08:30和18:30各投喂1次,初次投喂量约为初始体重的5%,按摄食情况调整投喂量。试验过程中自然光照,每天测定溶氧浓度、水温、pH等,记录死亡鱼尾数和重量。养殖期间氨氮浓度<0.2 mg/L,亚硝酸盐浓度<0.02 mg/L,溶氧浓度>6.0 mg/L,水温28~32 ℃,pH 7.5~8.0。每周换水2次,每次换水量为总体积的1/3。养殖试验为期42 d。

表1 基础饲料组成及营养水平(风干基础)
1)每千克维生素预混料含有One kilogram of vitamin premix contained the following:VA 3 200 000 IU,VB14 g,VB28 g,VB64.8 g,VB1216 mg,VD 31 600 000 IU,VE 16 g,VK 4 g,泛酸钙 calcium pantothenate 16 g,叶酸 folic acid 1.28 g,烟酸 nicotinic acid 28 g,肌醇 inositol 40 g,生物素 biotin 64 mg,水分 moisture≤10%。
2)每千克矿物质预混料含One kilogram of mineral premix contained the following:MgSO4·H2O 12 g,Ca(IO3)29 g,KCl 36 g,Met-Cu 1.5 g,ZnSO4·H2O 10 g,FeSO4·H2O 1 g,Met-Co 250 mg,NaSeO30.003 6 g。
3)营养水平为实测值Nutrient levels were measured values。
1.3 样品采集
养殖试验结束后停食24 h,记录每个重复鱼的尾数,称量鱼体总重。每个重复随机取5尾鱼,用于全鱼体成分的测定。每个重复随机取15尾鱼,经MS-222麻醉后用1 mL无菌注射器于尾静脉取血,静置4 h,4 000 r/min离心10 min制备血清,取上清液分装,保存于-80 ℃冰箱中备用。
1.4 指标分析
1.4.1 生长性能计算公式
增重率(weight gain rate,WGR,%)=
100×(Wt-W0)/W0;
存活率(survival rate,SR,%)=100×Nf/Ni;
饲料系数(feed conversion ratio,FCR)=
F/(Wt-W0);
蛋白质效率(protein efficiency rate,PER,%)=
100×(Wt-W0)/(F×P);
肝体比(hepatosomatic index,HSI,%)=
100×Wh/Wt;
肥满度(condition factor,CF,g/cm3)=
100×Wt/L3。
式中:W0为初始体重(g);Wt为终末体重(g);Nf为终末尾数(尾);Ni为初始尾数(尾);F为饲料摄入量(g);P为饲料粗蛋白质含量(%);Wh为肝脏重量(g);L为体长(cm)。
1.4.2 体成分测定
粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)、粗脂肪含量采用乙醚抽提法(GB/T 6433—1994)、粗灰分含量采用550 ℃灼烧法(GB/T 6438—1992)、水分含量采用105 ℃烘箱干燥法(GB/T 6435—1986)进行测定。
1.4.3 血清生化指标分析
血清球蛋白(gobulin,GLO)、总蛋白(total protein,TP)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHO)、尿素(urea,UR)、葡萄糖(glucose,GLU)含量及谷丙转氨酶(glutamic pyruvic transaminase,GPT)和谷草转氨酶(glutamic oxalacetic transaminase,GOT)活性委托广州金域医学检验中心测定。
1.5 嗜水气单胞菌感染试验
试验用嗜水气单胞菌菌种来自中国水产科学院南海水产研究所。菌种用营养肉汤琼脂培养基在37 ℃培养箱中摇床培养24 h,复壮2次。选取对数生长期的菌体,4 000 r/min离心1 min,收集沉淀菌体,用灭菌生理盐水清洗。集菌后进行梯度稀释,预试验确定半数致死浓度。在600 nm下,制备吸光度(OD)值为0.2的菌体悬液(约107CFU/mL),置于4 ℃冰箱中保存备用。
养殖试验采样结束后,每组选取大小一致的鱼40尾,随机分为4个桶,其中3个桶每尾鱼腹腔注射40 μL的嗜水气单胞菌悬液,另外1个桶腹腔注射等量的生理盐水。观察感染鱼体出现症状,并及时捞出死亡个体,记录死亡尾数。感染期间投喂基础饲料,不间断充气,水体不循环。感染试验时间为96 h,计算累积死亡率(accumulative mortality rate,AMR)。
累积死亡率(%)=(感染结束时死亡鱼尾数/
感染鱼尾数)×100。
1.6 统计分析
试验结果用平均值±标准差(mean±SD)表示,采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),利用Duncan氏法多重比较进行组间显著差异分析,差异显著性水平为P<0.05。
2 结果与分析
2.1 黄颡鱼幼鱼的生长性能
由表2可见,除IG600组鱼的增重率低于对照组外,其他β-葡聚糖添加组鱼的增重率均高于对照组,而且连续投喂组的增重率高于对应的间隔投喂组,但是各组之间均无显著差异(P>0.05)。在3个连续投喂组中,增重率以SG600最高,但组间差异不显著(P>0.05)。各组之间的存活率、饲料系数和蛋白质效率无显著差异(P>0.05)。饲料中添加β-葡聚糖有降低肝体比的趋势,IG1000组的肝体比显著低于对照组(P<0.05)。除SG1000组鱼的肥满度低于对照组外,β-葡聚糖添加组鱼的肥满度均高于对照组,而且连续投喂组的肥满度低于对应的间隔投喂组,但是各组之间均无显著差异(P>0.05)。
2.2 黄颡鱼幼鱼的体成分
由表3可见,β-葡聚糖添加组鱼体的粗蛋白质、粗脂肪和粗灰分含量均高于对照组,但未出现显著差异(P>0.05)。除SG200组的粗蛋白质含量低于IG200组外,另外2个连续投喂组均高于对应的间隔投喂组,但组间差异不显著(P>0.05)。β-葡聚糖添加组鱼体的水分含量均低于对照组,但差异不显著(P>0.05)。
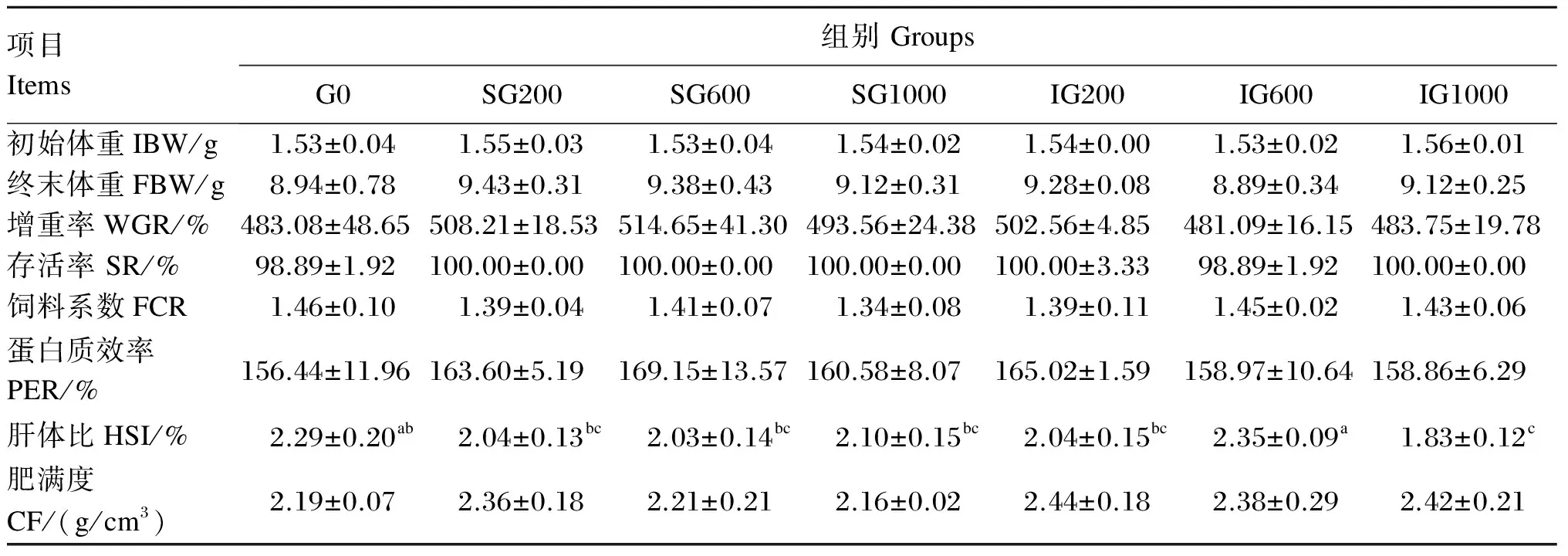
表2 饲料中添加β-葡聚糖对黄颡鱼幼鱼生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.

表3 饲料中β-葡聚糖对黄颡鱼幼鱼体成分的影响(湿重基础)
2.3 黄颡鱼幼鱼的血清生化指标
由表4可见,饲料中添加β-葡聚糖对黄颡鱼幼鱼各血清生化指标均没有显著影响(P>0.05)。其中,对照组血清球蛋白和总蛋白含量低于SG1000和IG600组,各β-葡聚糖添加组血清谷丙转氨酶和谷草转氨酶活性均低于对照组。
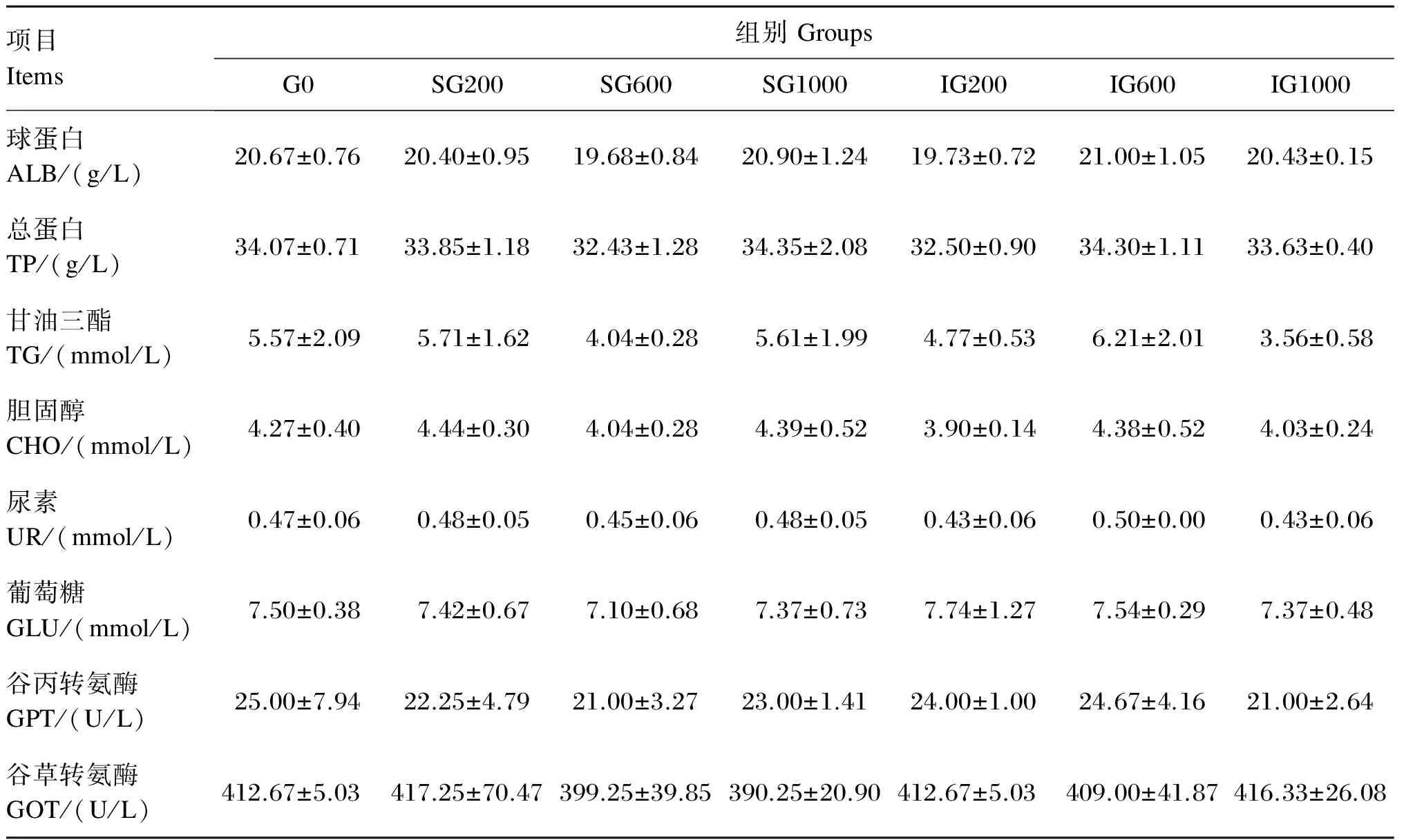
表4 饲料中添加β-葡聚糖对黄颡鱼幼鱼血清生化指标的影响
2.4 黄颡鱼幼鱼感染嗜水气单胞菌后的累计死亡率
注射生理盐水的各桶试验鱼直到试验结束都没有出现鱼体死亡现象。注射嗜水气单胞菌后20 h,各组试验鱼开始出现死亡,病鱼离群,活动量减少,游动异常,体表及腹腔内出现不同程度的充血。感染96 h后各组试验鱼的累计死亡率见表5。7组黄颡鱼的累计死亡率在35%~46%之间,组间未出现显著差异(P>0.05)。
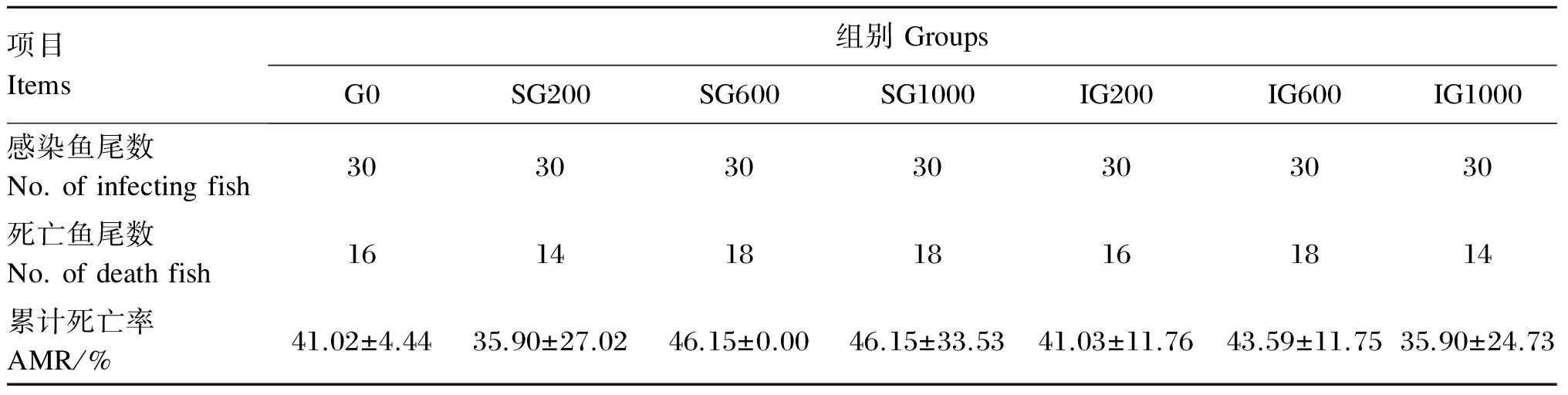
表5 感染嗜水气单胞菌96 h后黄颡鱼幼鱼的累计死亡率
3 讨 论
3.1 饲料中添加β-葡聚糖对黄颡鱼幼鱼生长性能的影响
β-葡聚糖对水产动物生长性能的作用已有大量研究,但是作用效果却因饲料配方[12]、添加剂量[15]或生长阶段[16]等不同而表现出差异性。吴春玉等[8]对花鲈的研究表明,饲料中添加β-1,3-葡聚糖可以显著提高生长性能,但周艳萍[17]的研究结果显示,β-葡聚糖对异育银鲫(Carassiusauratusgibelio)的生长性能无显著影响。另外有报道指出,长期连续投喂β-葡聚糖会抑制齐口裂腹鱼(SchizothoraxprenantiTchang)的生长[18]。作为一种免疫增强剂,β-葡聚糖对水产动物生长性能的作用机制尚不清楚,有学者指出,β-葡聚糖可以作为营养物质被消化吸收提供能量[19],但谭北平等[20]认为β-葡聚糖提供的能量有限,应该是通过提高抗氧化能力来促进生长。本试验中,在饲料中添加不同水平的β-葡聚糖,并采用连续和间隔2种投喂方式,养殖42 d后,可以一定程度提高黄颡鱼幼鱼的增重率,而且连续投喂的效果优于间隔投喂,但是并没有因为添加水平或投喂方式的不同而出现显著性差异。这与β-葡聚糖对暗纹东方鲀[8]的作用效果一致。在对鲤鱼(Cyprinuscarpio)的研究中也发现,投喂葡聚糖60 d对其生长性能没有显著影响[21]。在本试验中,连续投喂组的增重率随β-葡聚糖添加量的增加出现先升高后降低的趋势,这与吴春玉等[8]对花鲈的研究结果相似,表明β-葡聚糖对黄颡鱼生长性能的影响亦与添加量相关。有研究发现,采用间隔投喂β-葡聚糖的方式可以缓解长期投喂对水产动物生长的抑制作用[22],但是本试验中,3个间隔投喂组的增重率均低于相应的连续投喂组,而且随添加量的增加出现先下降后上升的趋势,与连续投喂组的趋势相反,出现这种结果可能与鱼的种类、生长时期、养殖周期或者β-葡聚糖的添加量等有关。因此,关于β-葡聚糖对黄颡鱼幼鱼生长性能影响的作用效果和机制的研究还有待继续深入,包括生长阶段、饲料营养水平、投喂频率以及投喂方式等多方面的因素,以便进一步明确β-葡聚糖在黄颡鱼健康养殖中的应用效果。
本试验中,β-葡聚糖没有对黄颡鱼幼鱼的蛋白质效率产生显著影响,但是出现升高趋势,这与其对增重率的作用效果一致。肝体比和肥满度是反映鱼体形体的指标。本研究结果显示,饲料中添加β-葡聚糖可以降低肝体比,提高肥满度,这与β-1,3-葡聚糖对花鲈[8]、几丁聚糖对吉富罗非鱼[23](Oreochromisniloticus)的研究结果一致,其中间隔投喂1 000 mg/kg组肝体比显著低于对照组,推测β-葡聚糖可能通过提高黄颡鱼幼鱼的消化酶活性来提高饲料利用效率,进而增加营养物质在机体的沉积,引起肝体比降低。覃志彪[24]曾报道,饲料中添加β-葡聚糖能显著提高奥尼罗非鱼蛋白酶、淀粉酶、脂肪酶和纤维素酶活性,肌肉粗蛋白质含量随β-葡聚糖添加量的增加而增加。
本试验结果表明,β-葡聚糖对黄颡鱼鱼体粗蛋白质、粗脂肪和粗灰分含量的影响差异不显著,这与赵红霞等[25]及谭崇桂等[26]对凡纳滨对虾的研究结果一致。周艳萍等[17]的试验中,饲料中添加β-葡聚糖对异育银鲫的肌肉成分也无显著影响。本试验的结果可能是因为试验中各组饲料的营养水平基本一致,在此养殖阶段内黄颡鱼机体组成保持相对稳定没有达到差异显著水平。
3.2 饲料中添加β-葡聚糖对黄颡鱼幼鱼血清生化指标的影响
血清生化指标可以反映机体物质代谢和某些组织器官的变化,常用来评价鱼体健康和营养状况等。血清中的蛋白质主要维持渗透压,其含量变化与机体的生理密切相关,可反映动物的健康状况,具有免疫功能。本试验中,各组血清总蛋白和球蛋白含量未出现显著差异,两者的变化趋势基本一致。胡毅等[27]在饲料中添加复合芽孢杆菌制剂养殖凡纳滨对虾10周后发现血清总蛋白含量显著提高。血清中甘油三酯和胆固醇含量的变化可反映机体脂质代谢功能,尿素为衡量机体蛋白质分解代谢的指标,葡萄糖是机体主要的能量物质。本试验中,β-葡聚糖对上述指标表现出不同程度的影响,但差异均未达显著水平,原因有待进一步研究。转氨酶是反映肝功能的重要指标,其活性升高是肝细胞损伤的标志。本研究结果显示,饲料中添加β-葡聚糖有降低血清中谷丙转氨酶和谷草转氨酶活性的趋势,但并未达到显著水平,表明β-葡聚糖可在一定程度内保护肝脏,此结果与β-1,3-葡聚糖在鲈鱼[8]、酵母细胞壁免疫多糖在草鱼(Ctenopharyngodonidellus)[28]上的研究结果一致。Dawood等[29]对海鲷(Pagelluserythrinus)的研究结果显示,饲料中添加β-葡聚糖对血清中谷草转氨酶、谷丙转氨酶活性及尿素含量无显著影响。周传朋等[30]的研究表明,寡糖-中草药复合物可降低异育银鲫血清中谷丙转氨酶的活性。贺国龙等[28]发现,在饲料中添加0.5%的酵母细胞壁免疫多糖可显著降低草鱼血清中谷丙转氨酶活性。
3.3 饲料中添加β-葡聚糖对黄颡鱼幼鱼抗嗜水气单胞菌感染能力的影响

在本试验中,饲料中添加β-葡聚糖,无论是连续投喂还是间隔投喂,均没有显著降低黄颡鱼幼鱼感染嗜水气单胞菌后的累计死亡率。这说明,在本试验条件下,β-葡聚糖没有提高黄颡鱼抵抗嗜水气单胞菌感染的能力,这与其对生长性能的影响相一致,其原因和机理有待结合免疫指标分析等进一步深入探讨。同样,对罗非鱼进行海豚链球菌感染,结果显示各组的存活率没有受到显著影响,葡聚糖对罗非鱼抗海豚链球菌感染能力没有显著影响[36]。这提示,β-葡聚糖对水产动物的抗菌活性及对外源病菌和病毒抵抗力的研究范围和深度尚需要进一步加强,不同处理方式的作用效果、对不同病原菌的抵抗反应机制等均有待深入研究。
4 结 论
饲料中添加200、600和1 000 mg/kg β-葡聚糖,不论采取连续投喂还是间隔投喂方式,除间隔投喂1 000 mg/kg组肝体比显著低于对照组外,对黄颡鱼幼鱼的生长性能、体成分、血清生化指标及抗嗜水气单胞菌感染能力均没有显著影响。
[1] 吴振,刘嘉,郑刚,等.β-葡聚糖调节血糖作用及其机理的研究进展[J].中国粮油学报,2010,25(12):44-48.
[2] DALMO R A,BØOGWALD J.β-glucans as conductors of immune symphonies[J].Fish & Shellfish Immunology,2008,25(4):384-396.
[3] 曹俊明,赵红霞,黄燕华,等.β-葡聚糖及其在水生动物中的应用研究[J].饲料工业,2013,34(18):1-6.
[4] TSONI S V,BROWN G D.β-Glucans and dectin-1[J].Annals of the New York Academy of Sciences,2008,1143(1):45-60.
[5] VARGAS-ALBORES F,YEPIZ-PLASCENCIA G.Beta glucan binding protein and its role in shrimp immune response[J].Aquaculture,2000,191(1/2/3):13-21.
[6] BRIDLE A R,CARTER C G,MORRISON R N,et al.The effect of β-glucan administration on macrophage respiratory burst activity and Atlantic salmon,SalmosalarL.,challenged with amoebic gill disease-evidence of inherent resistance[J].Journal of Fish Diseases,2005,28(6):347-356.
[7] 迟淑艳,周歧存,周健斌,等.β-葡聚糖对奥尼罗非鱼生长性能及抗嗜水气单胞菌感染的影响[J].中国水产科学,2006,13(5):767-774.
[8] 吴春玉,曹俊明,黄燕华,等.饲料中添加β-葡聚糖对花鲈生长性能、体成分、血清生化指标和抗氨氮应激能力的影响[J].动物营养学报,2013,25(12):3033-3040.
[9] AI Q H,MAI K S,ZHANG L,et al.Effects of dietary β-1,3 glucan on innate immune response of large yellow croaker,Pseudosciaenacrocea[J].Fish & Shellfish Immunology,2007,22(4):394-402.
[10] 王永宏.β-葡聚糖对暗纹东方鲀非特异性免疫及生长性能的影响[D].硕士学位论文.上海:华东师范大学,2013.
[11] 刘栋辉,阳会军,刘永坚.β-葡聚糖和维生素C对斑节对虾生长和抗病力的效果[J].中山大学学报:自然科学版,2002,41(4):59-62.
[12] 刘立鹤,郑石轩,谭斌,等.不同饲料配方下β-葡聚糖对凡纳滨对虾生长性能、非特异性免疫力的影响及成本分析[J].饲料工业,2005,26(8):26-30.
[13] 余水法,蔡春芳,宋学宏,等.β-葡聚糖对河蟹免疫功能的影响[J].中国饲料,2006(5):20-22.
[14] 季高华,刘至治,冷向军.饲料中添加β-葡聚糖和低聚果糖对中华鳖幼鳖生长和血清SOD、溶菌酶活力的影响[J].上海水产大学学报,2004,13(1):36-40.
[15] SANG H M,FOTEDAR R.Effects of dietary β-1,3-glucan on the growth,survival,physiological and immune response of marron,Cheraxtenuimanus(Smith,1912)[J].Fish & Shellfish Immunology,2010,28(5/6):957-960.
[16] 李富东,叶继丹,王琨,等.β-葡聚糖对鲤鱼生长性能及非特异性免疫功能的影响[C]. 2008年中国水产学会学术年会论文摘要集. 北京:中国水产学会,2008.
[17] 周艳萍.β-葡聚糖对异育银鲫非特异性免疫和生长性能的影响[D].硕士学位论文.武汉:武汉工业学院,2008.
[18] 张辽.β-葡聚糖对齐口裂腹鱼生长及非特异性免疫功能的影响[D].硕士学位论.雅安:四川农业大学.
[19] 王银东,张欣欣,吴世林.β-葡聚糖在水产动物中的应用[J].饲料博览:技术版,2008(5):33-35.
[20] 谭北平,周歧存,郑石轩,等.β-1,3/1,6-葡聚糖制剂对凡纳对虾生长及免疫力的影响[J].高技术通讯,2004,14(5):73-77.
[21] YE J D,WANG K,LI F D,et al.Effects of long-term dietary administration of β-glucan on tissue enzyme activity and disease resistance in common carp,Cyprinuscarpio[J].The Israeli Journal of Aquaculture,2011,63:1-6.
[22] BAI N,ZHANG W B,MAI K S,et al.Effects of discontinuous administration of β-glucan and glycyrrhizin on the growth and immunity of white shrimp,Litopenaeusvannamei[J].Aquaculture,2010,306(1/2/3/4):218-224.
[23] 强俊,孙意岚,黄永,等.饲料中添加几丁聚糖对吉富罗非鱼幼鱼生长性能、免疫调控与抗海豚链球菌感染的影响[J].动物营养学报,2015,27(6):1769-1778.
[24] 覃志彪.β-葡聚糖对奥尼罗非鱼生长性能、机体营养成分及消化酶活性的影响[D].硕士学位论文.南宁:广西大学,2012.
[25] 赵红霞,曹俊明,黄燕华,等.饲料中长期添加β-1,3-葡聚糖对凡纳滨对虾生长、生化指标和免疫功能的影响[C]. 2009年中国水产学会学术年会论文摘要集.北京:中国水产学会,2009.
[26] 谭崇桂,冷向军,李小勤,等.多糖、寡糖、蛋白酶对凡纳滨对虾生长、消化酶活性及血清非特异性免疫的影响[J].上海海洋大学学报,2013,22(1):93-99.
[27] 胡毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
[28] 贺国龙,刘立鹤,乐义详,等.酵母细胞壁免疫多糖对草鱼免疫功能的影响[J].粮食与饲料工业,2010(7):43-45.
[29] DAWOOD M A O,KOSHIO S,ISHIKAWA M,et al.Interaction effects of dietary supplementation of heat-killedLactobacillusplantarumand β-glucan on growth performance,digestibility and immune response of juvenile red sea bream,Pagrusmajor[J].Fish & Shellfish Immunology,2015,45(1):33-42.
[30] 周传朋,刘波,王广宇,等.寡糖-中草药复合物和黄霉素对异育银鲫生长、免疫及抗病力的影响[J].淡水渔业,2009(3):46-51.
[31] MISRA C K,DAS B K,MUKHERJEE S C,et al.Effect of long term administration of dietary β-glucan on immunity,growth and survival ofLabeorohitafingerlings[J].Aquaculture,2006,255(1/2/3/4):82-94.
[32] CHEN D,ANISWORTH A J.Glucan administration potentiates immune defense mechanisms of channel catfish,IctaluruspunctatusRafineque[J].Journal of Fish Diseases,1992,15(4):295-304.
[33] COUSO N,CASTRO R,MAGARINOS B,et al.Effect of oral administration of glucans on the resistance of gilthead seabream to pasteurellosis[J].Aquaculture,2003,219(1/2/3/4):99-109.
[34] 刘群芳,曹俊明,黄燕华,等.β-葡聚糖与硒、维生素E联合添加对凡纳滨对虾组织生化指标及免疫、抗氧化相关酶mRNA表达的影响[J].动物营养学报,2013,25(5):1045-1053.
[35] 陈超然,陈萱,陈昌福,等.酵母β-葡聚糖对受免异育银鲫免疫应答的增强作用[J].华中农业大学学报,2003,22(4):380-384.
[36] WELLKER T L,LIM C,YILDIRIM-AKSOY M,et al.Use of diet crossover to determine the effects of β-glucan supplementation on immunity and growth of Nile Tilapia,Oreochromisniloticus[J].Journal of the World Aquaculture Society,2012,43(3):335-348.
*Corresponding author, professor, E-mail: junmcao@163.com
(责任编辑 菅景颖)
Effects of Dietary β-Glucan on Growth Performance, Serum Biochemical Indices and Resistance AgainstAeromonashydrophilaof Juvenile Yellow Catfish (Pseudobagrusfulvidraco)
LI Yongjuan1,2,3,4WANG Weimin2HUANG Yanhua1,3,4CAO Junming1,3,4*WANG Guoxia1,3,4ZHAO Hongxia1,3,4LIU Shaoyu1,3,4MA Yongping1,3,4
(1.InstituteofAnimalScience,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China;2.CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China; 3.GuangdongPublicLaboratoryofAnimalBreedingandNutrition,Guangzhou510640,China; 4.GuangdongKeyLaboratoryofAnimalBreedingandNutrition,Guangzhou510640,China)
A 42 days feeding trial was conducted to study the effects of dietary β-glucan on growth performance, serum biochemical indices and resistance againstAeromonashydrophilaof juvenile yellow catfish (Pseudobagrusfulvidraco). A basal diet was supplemented with 200, 600 and 1 000 mg/kg β-glucan to prepare three test diets. Seven hundred and twenty fish with an initial body weight of (1.53±0.04) g were selected and randomly divided into 7 groups, including feeding with basal diet as control group (G0 group), continuous feeding with diets of different levels of β-glucan (SG200, SG600 and SG1000 groups), and interval feeding with diets of different levels of β-glucan for 7 days followed by the basal diet for 7 days (IG200, IG600 and IG1000 groups). The continuous feeding groups had 4 replicates, and control group and interval feeding groups all had 3 replicates, and each replicate had 30 fish. After the feeding trail, the fish were challenged withAeromonashydrophilafor 96 h to calculate the accumulative mortality rate (AMR). The results showed as follows: 1) there were no significant differences in weight gain rate (WGR), feed conversion ratio (FCR), protein efficiency ratio (PER) and survival rate (SR) among 7 groups (P>0.05), but hepatosomatic index (HSI) in IG1000 group was significantly lower than that in control group (P<0.05). Furthermore, the fish fed diets supplemented with β-glucan showed higher WGR and PER than the control group, and continuous fed diet supplemented with β-glucan showed higher WGR than interval fed diet supplemented with the same level of β-glucan, the highest values appeared in SG600 group. 2)Compared with the control group, the contents of crude protein, ether extract and ash of whole body in the other six groups were increased to some extent and the moisture content was decreased to some extend, but no significant differences were observed (P>0.05). 3) There were no significant differences in serum biochemical indices among all groups (P>0.05). However, compared with the control group, the contents of serum globulin (GLB) and total protein (TP) in SG1000 and IG600 group were higher, but the activities of serum glutamic oxalacetic transaminase (GOT) and glutamic pyruvic transaminase (GPT) in β-glucan supplementation groups were lower. 4) AfterAeromonashydrophilainfection for 96 h, the AMR was 35% to 46% among all groups and there was no significant difference (P>0.05). In conclusion, except for HSI of interval feeding 1 000 mg/kg β-glucan is significantly decreased, supplementation of 200, 600 and 1 000 mg/kg β-glucan to diets, using either continuous or interval feeding strategies, has no significant effects on growth performance, body composition, serum biochemical indices and resistance againstAeromonashydrophilaof juvenile yellow catfish.[ChineseJournalofAnimalNutrition, 2015, 27(12):3754-3762]
β-glucan; yellow catfish; growth performance; serum biochemical indices;Aeromonashydrophila
10.3969/j.issn.1006-267x.2015.12.014
2015-06-24
广东省海洋渔业科技推广专项(A201301F01);广东省自然科学基金团队项目(10351064001000000)
李永娟(1989—),女,河北石家庄人,硕士研究生,从事水产动物营养与饲料的研究。E-mail: 715877473@qq.com
*通信作者:曹俊明,研究员,博士生导师,E-mail: junmcao@163.com
S963
A
1006-267X(2015)12-3754-09
