饲料蛋白质水平对黄姑鱼幼鱼生长性能、体组成和消化酶活性的影响
2015-05-09王立改
鲁 琼 王立改 楼 宝 詹 炜
陈睿毅2,3 罗胜玉1 刘佳节1 王肇霖1
(1.浙江海洋学院,舟山316022;2.浙江省海洋水产研究所,舟山316021;3.浙江省海水增养殖重点实验室,舟山316021)
饲料蛋白质水平对黄姑鱼幼鱼生长性能、体组成和消化酶活性的影响
鲁 琼1,2王立改1,2楼 宝2,3*詹 炜2,3
陈睿毅2,3罗胜玉1刘佳节1王肇霖1
(1.浙江海洋学院,舟山316022;2.浙江省海洋水产研究所,舟山316021;3.浙江省海水增养殖重点实验室,舟山316021)
本试验旨在研究饲料蛋白质水平对黄姑鱼幼鱼生长性能、体组成和消化酶活性的影响。试验以鱼粉、豆粕和小麦蛋白粉为蛋白质源,配制蛋白质水平实测值分别为37.52%、41.80%、46.52%、49.84%、56.80%和61.48%的6种等能等脂饲料。试验选取平均体重为(17.84±0.34) g的黄姑鱼幼鱼360尾,随机分成6组,每组3个重复,每个重复20尾鱼,饲养于500 L流水钢化玻璃水桶中,在水温(27±2) ℃、盐度28~29的条件下进行8周的生长试验。结果表明:饲料蛋白质水平为56.80%时,黄姑鱼幼鱼的增重率、特定生长率和饲料转化率显著高于除61.48%组以外的其余各组(P<0.05)。随着饲料蛋白质水平的升高,黄姑鱼幼鱼的肝体比、脏体比和肥满度的变化没有显著差异(P>0.05)。黄姑鱼幼鱼全鱼粗蛋白质、粗脂肪和粗灰分含量不受饲料蛋白质水平的显著影响(P>0.05)。黄姑鱼幼鱼肠道蛋白酶活性随饲料蛋白质水平的升高先升高后稳定,饲料蛋白质水平对黄姑鱼幼鱼肠道淀粉酶、脂肪酶和肝脏蛋白酶、淀粉酶、脂肪酶的活性均无显著影响(P>0.05)。以特定生长率为评价指标,经折线模型分析表明,黄姑鱼幼鱼对饲料中蛋白质的最适需求量为55.39%。
黄姑鱼幼鱼;蛋白质;生长;体组成;消化酶
蛋白质是鱼类维持生命和生长所必需的营养成分,不仅参与体内组织的构成,而且是某些代谢活性物质(激素、酶、免疫抗体)的主要成分,同时也是饲料成本中比例最大的部分。饲料中蛋白质水平过低则不能满足鱼类生长需要,过高则可能造成蛋白质浪费和饲料成本增加。目前,国内外已经开展了大黄鱼(Larimichthyscrocea)[1-2]、牙鲆(Paralichthysolivaceus)[3]和黑鲷(Sparusmacrocephalus)[4]等多种鱼类最适蛋白质需求量的研究。对于黄姑鱼的研究,当前主要集中在繁育[5-7]、育种[8-9]和形态[10]等方面,对营养需求的研究报道较少,关于黄姑鱼幼鱼最适蛋白质需求量的研究尚未见报道。本试验考察了饲料中不同蛋白质水平对黄姑鱼幼鱼生长性能、饲料利用率、体组成、形体指标和消化酶活性的影响,以期为黄姑鱼幼鱼人工饲料的研发提供参考依据。
1 材料与方法
1.1 试验设计与试验饲料制作
以鱼粉、豆粕和小麦蛋白粉为蛋白质源,鱼油和大豆卵磷脂为脂肪源,配制6种不同蛋白质水平(35%、40%、45%、50%、55%和60%)的等能等脂饲料,蛋白质水平实测值分别为37.52%、41.80%、46.52%、49.84%、56.80%和61.48%,分别记为P1、P2、P3、P4、P5和P6。试验饲料组成及营养水平见表1。所有原料粉碎后过60目筛,按配方比例称重后搅拌均匀,各组分采用逐级扩大法混合均匀后,放置于搅拌机中,边搅拌边加入适量的水分,搅拌均匀后用F-26型双螺杆挤条机挤压成2和4 mm 2种粒径的配合饲料,风干至水分含量10%左右,用封口袋分装后于-20 ℃冰箱保存备用。
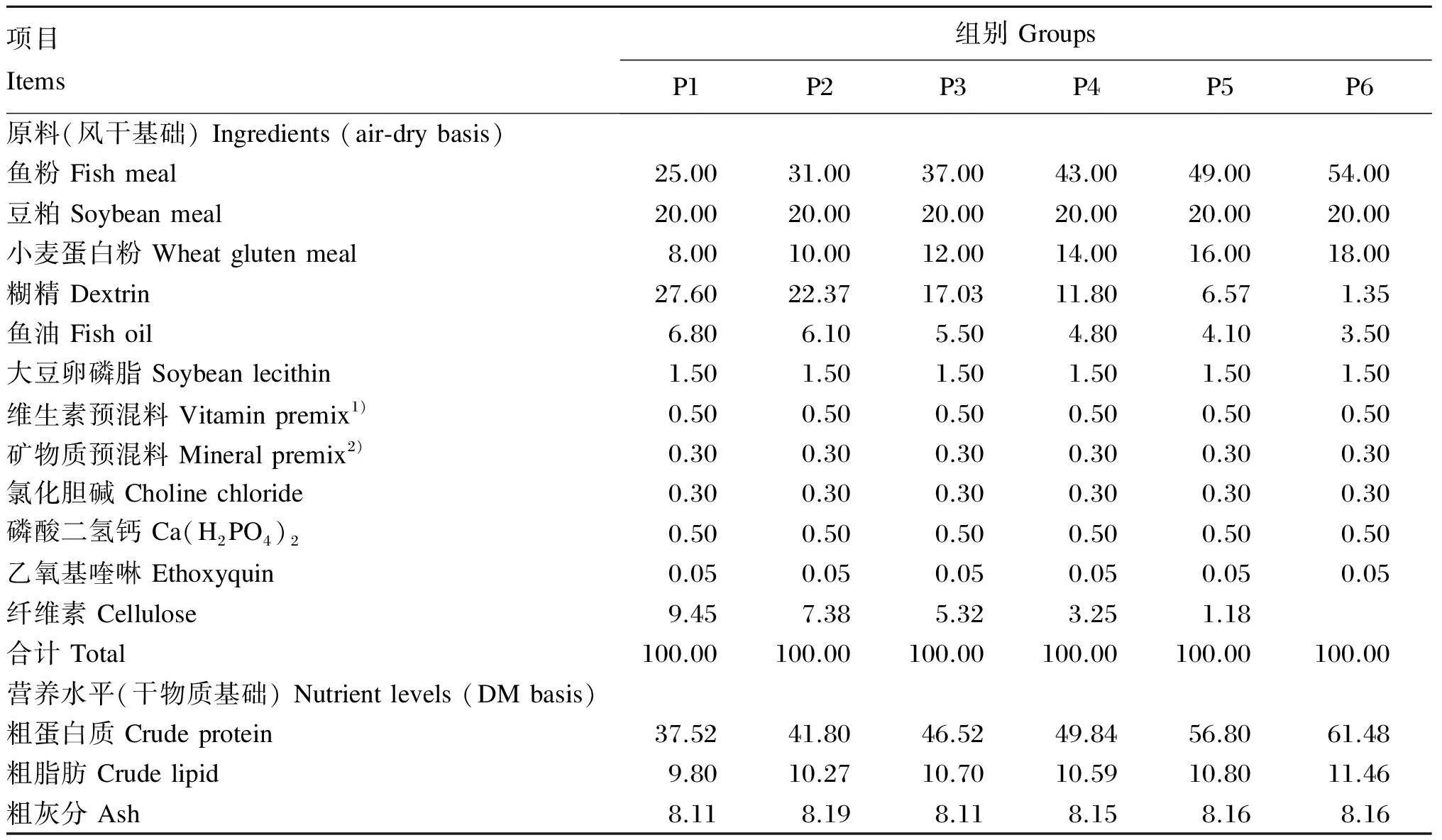
表1 试验饲料组成及营养水平
1)每千克维生素预混料含有Contains the following per kg of vitamin premix:VA 32 mg,VD35 mg,VK 5.1 mg,VE 120 mg,VB125 mg,VB236.7 mg,VB620 mg,VB120.1 mg,VB560 mg,VB3200 mg,VB920 mg,生物素 biotin 1.2 mg,肌醇 inositol 792 mg,VC 1 000 mg。
2)每千克矿物质预混料含有Contains the following per kg of mineral premix:MgSO4·7H2O 1 826 mg,FeSO4·7H2O 119 mg,ZnSO4·7H2O 76 mg,MnSO4·H2O 44 mg,CoCl2·6H2O 2 mg,KI 0.8 mg,CuSO4·5H2O 10 mg,NaCl 100 mg,KH2PO4233.2 mg,NaH2PO4137.03 mg。
1.2 试验用鱼及养殖管理
试验鱼为浙江省海洋水产研究所西闪岛试验场人工培育的苗种。初步选择600余尾幼鱼在室内50 m3水泥池中集中暂养2周。暂养结束后,选用大小均匀、健康活泼的初始体重为(17.84±0.34) g的幼鱼360尾,随机分为6组,每组3个重复,每个重复20尾鱼,分别饲养于500 L钢化玻璃桶中。养殖试验在位于西闪岛试验场的中挪海水鱼类营养与饲料联合实验室的流水系统中进行。每天分别在07:00和16:00各喂饲料1次,投喂量为鱼体重的3%~5%,每2周称重1次,以调整投喂量,试验期8周。养殖期间,水温为(27±2) ℃,水体pH为 7.8~8.0,盐度为28~29,溶解氧浓度>6 mg/L,氨氮浓度<0.05 mg/L。
1.3 样品采集
饲养试验结束,停食24 h后,称量每个钢化玻璃桶中的黄姑鱼总重并记录尾数。从每个桶中随机取5尾鱼测量其体重、体长;在冰盘上分离肝脏和内脏团并称重。另取3尾鱼解剖,取肝脏和肠道分别放至2.0 mL离心管中,迅速放置于液氮罐中,备测消化酶活性。从每个桶中再取6尾鱼,用于全鱼常规营养成分分析。
1.4 生长指标及其计算公式
增重率(WGR,%)=100×(终末体重-
初始体重)/初始体重;
特定生长率(SGR,%/d)=100×(ln终末体重-
ln初始体重)/饲养天数;
饲料转化率(FCR,%)=100×
总增重/饲料消耗量;
蛋白质效率(PER)=100×
鱼体增重/蛋白质摄入量;
存活率(SR,%)=100×
终末尾数/初始尾数;
肥满度(CF,%)=100×
体重/体长3;
肝体比(HSI,%)=100×肝脏重/体重;
脏体比(VSI,%)=100×内脏重/体重。
1.5 指标检测方法
1.5.1 常规营养成分检测
试验饲料、全鱼的常规营养成分采用AOAC(1995)中方法检测。其中,水分含量采用105 ℃恒温烘干法测定;粗蛋白质含量采用凯氏定氮仪(BUCHI,KjeIFIex K-360,瑞士)测定,粗脂肪含量采用索氏抽提仪(FOSS Soxtec-2055,瑞典)测定,粗灰分含量采用马福炉550 ℃灼烧法测定。
1.5.2 消化酶活性检测
肠道和肝脏样品检测前于4 ℃冰箱解冻,用预冷(0~4 ℃)的0.86%的生理盐水洗2次,再用滤纸吸干表面水分,称重,切碎后与预冷的0.86%的生理盐水按1∶9质量体积比稀释,于冰水浴中高速匀浆,匀浆液于高速冷冻离心机(0 ℃,4 000 r/min)离心20 min后,取上清液作为粗酶液,置于-80 ℃冰箱保存备用。
蛋白酶活性采用福林-酚试剂法测定,淀粉酶和脂肪酶活性采用南京建成生物工程研究所提供的试剂盒检测。
1.6 数据分析
试验所得数据采用SPSS 19.0软件进行单因子方差分析(one-way ANOVA),组间差异显著(P<0.05)时,进行Duncan氏法多重比较,试验结果以平均值±标准差(mean±SD)表示。
2 结 果
2.1 饲料蛋白质水平对黄姑鱼幼鱼生长性能的影响
由表2可知,黄姑鱼幼鱼的增重率、特定生长率和饲料转化率的变化基本一致,均随饲料蛋白质水平的升高整体呈现先升高后维持稳定的趋势,且均在P5组达到最大值,分别为423.66%、3.12%/d和115.15%,略高于P6组(P>0.05),显著高于其余各组(P<0.05)。随饲料蛋白质水平的升高,蛋白质效率先升高后持续小幅下降,以P2组最高,显著高于P6组(P<0.05)。存活率以P6组最低,显著低于P3组(P<0.05),其他组间差异不显著(P>0.05)。
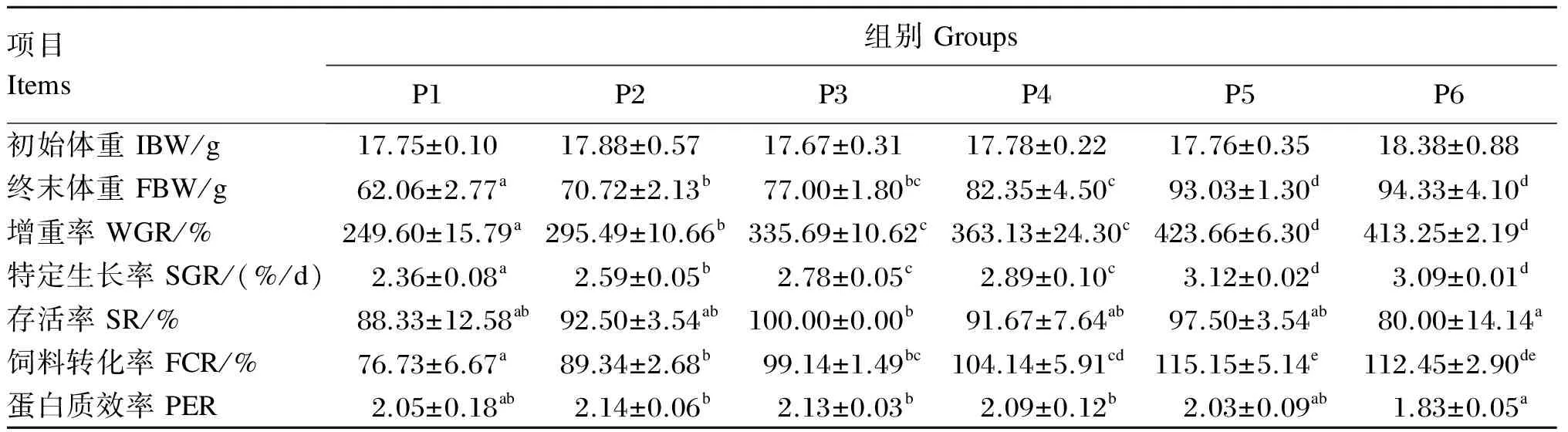
表2 饲料蛋白质水平对黄姑鱼幼鱼生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
为研究饲料蛋白质水平与特定生长率的效应关系,以确定黄姑鱼幼鱼饲料中最适蛋白质水平,以饲料中蛋白质水平为横坐标(x),以特定生长率为纵坐标(y)作图进行折线拟合(图1)。结果表明,在本试验条件下,黄姑鱼幼鱼获得最佳生长效果时饲料蛋白质水平为55.39%。
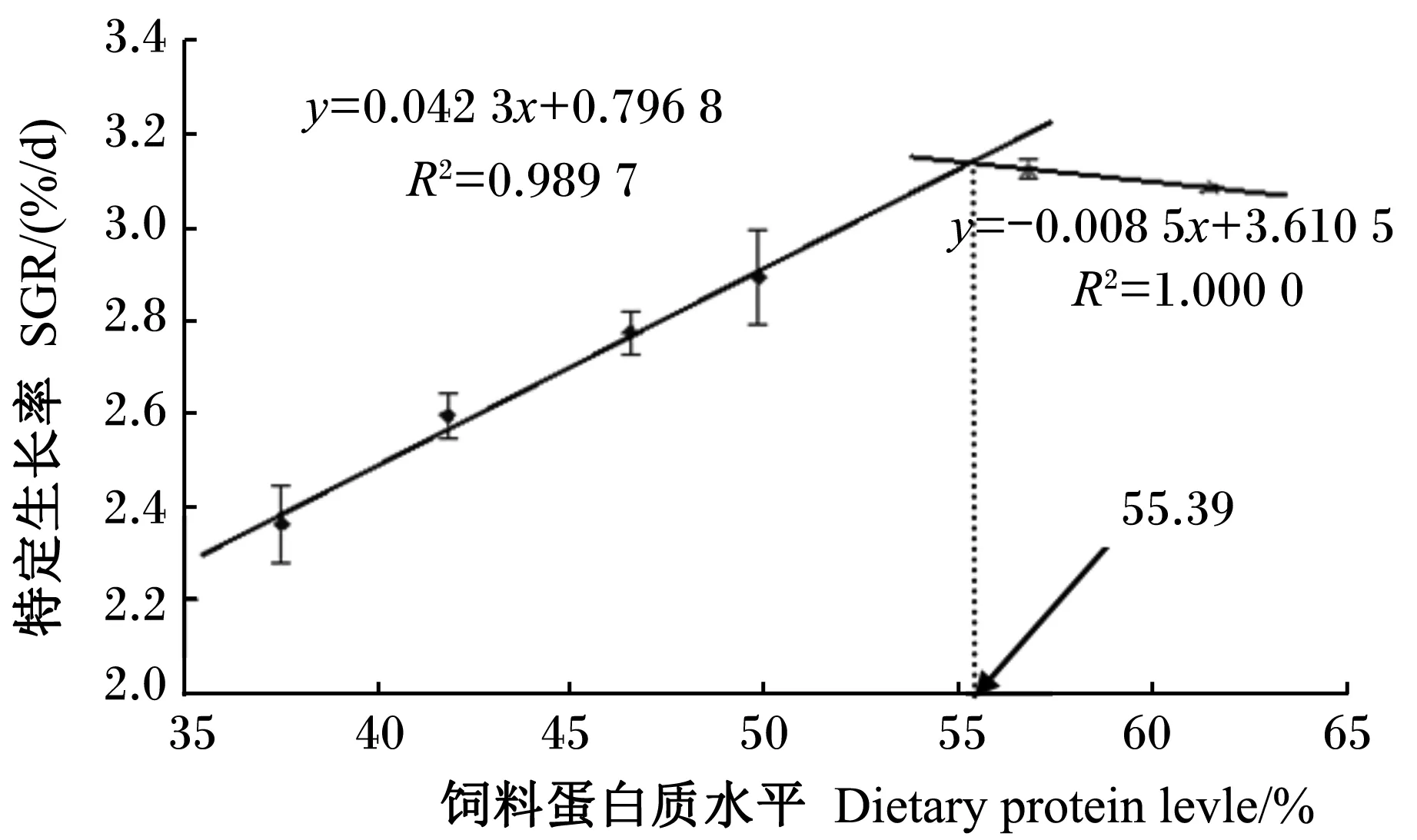
图1 折线模型分析饲料蛋白质水平与黄姑鱼幼鱼特定生长率之间的关系
2.2 饲料蛋白质水平对黄姑鱼幼鱼体组成和形体指标的影响
由表3可知,P6组的全鱼水分、粗蛋白质和粗灰分含量均最高,P1组的全鱼粗脂肪含量最高,但上述指标各组之间均没有显著差异(P>0.05)。
由表4可知,随饲料蛋白质水平的升高,黄姑鱼幼鱼的肝体比、脏体比和肥满度未产生显著变化(P>0.05)。
2.3 饲料蛋白质水平对黄姑鱼幼鱼肠道和肝脏消化酶活性的影响
由表5可知,黄姑鱼幼鱼肝脏中蛋白酶的活性比肠道中小得多。当饲料蛋白质水平由37.52%升至56.80%时,肠道蛋白酶活性随饲料蛋白质水平的升高而增大,饲料蛋白质水平为56.80%时,肠道蛋白酶活性达到最大值,显著高于饲料蛋白质水平为37.52%时(P<0.05)。P6组肠道蛋白酶活性小于P5组,但两者之间无显著差异(P>0.05)。饲料蛋白质水平对黄姑鱼幼鱼肝脏蛋白酶活性的影响不显著(P>0.05)。
黄姑鱼幼鱼肝脏的淀粉酶活性比肠道淀粉酶活性稍高。当饲料蛋白质水平为61.48%时,肠道和肝脏淀粉酶活性均最低,但黄姑鱼幼鱼肠道和肝脏中淀粉酶活性并不受饲料蛋白质水平的显著影响(P>0.05)。
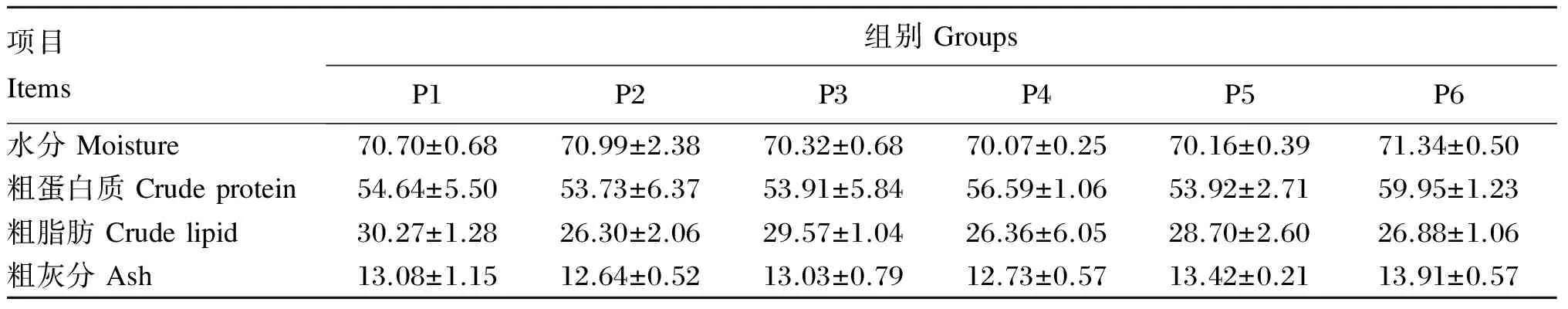
表3 饲料蛋白质水平对黄姑鱼幼鱼体组成的影响(干物质基础)
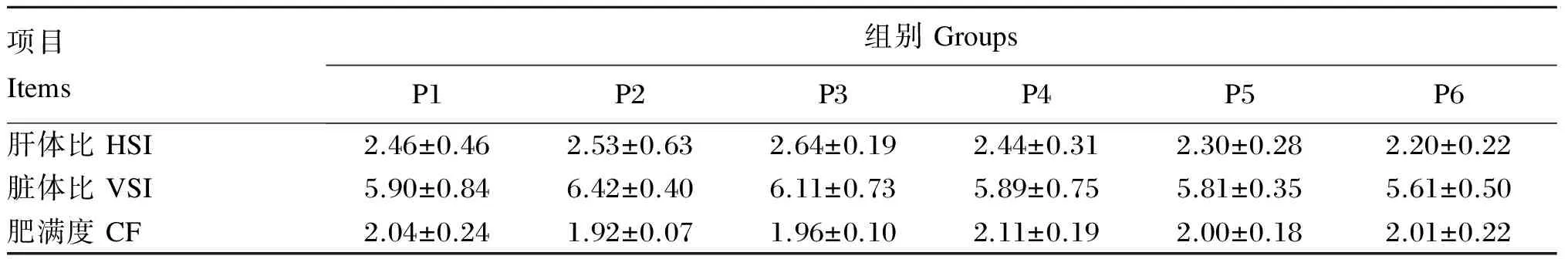
表4 饲料蛋白质水平对黄姑鱼幼鱼形体指标的影响
肠道和肝脏的脂肪酶活性接近,饲料蛋白质水平对肠道和肝脏脂肪酶活性均无显著影响(P>0.05)。
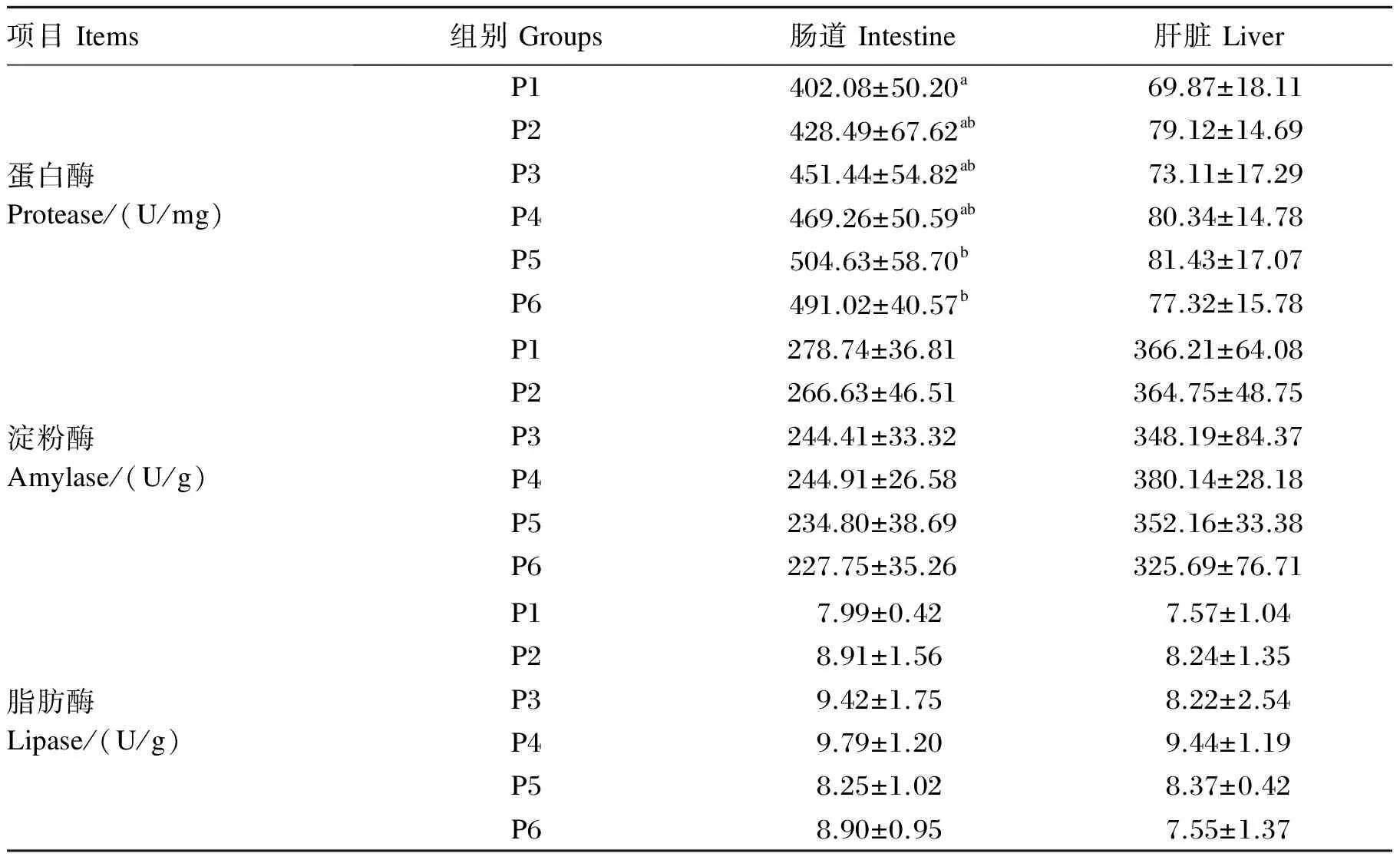
表5 饲料蛋白质水平对黄姑鱼幼鱼肠道和肝脏消化酶酶活性的影响
3 讨 论
3.1 饲料蛋白质水平对黄姑鱼幼鱼生长性能的影响
在本试验中,随着饲料蛋白质水平的升高,黄姑鱼幼鱼的增重率和特定生长率逐渐上升,当饲料蛋白质水平达到56.80%后开始维持稳定,高蛋白质水平组(P5和P6组)之间并无显著差异。Yang等[11]在研究澳洲银鲈(Bidyanusbidyanus)蛋白质需求时同样发现当饲料中蛋白质水平由13%升高到37%时,鱼体增重率持续上升,当饲料蛋白质水平在37%~55%时,增重率没有显著变化。Chen等[12]、Salhi等[13]和王胜[14]的研究结果中都曾出现类似现象。Lee等[3]研究发现,当饲料蛋白质水平过高时,牙鲆的增重率和特定生长率显著降低。这可能是因为过量的氨基酸发生脱氨基作用进入能量代谢,最终产生氨和尿素排出体外,而不能在体内沉积下来用于生长[15-16],更为严重的还可能造成氨中毒[17-18]。

饲料转化率是衡量动物所摄食饲料中用于机体生长增重的比例。林星[24]研究发现,饲料蛋白质水平由34.76%升高到39.85%时,花鲈(Lateolabraxjaponicas)的饲料转化率不断升高,当饲料蛋白质水平继续升至45.03%时,饲料转化率没有显著差异。本试验中也出现了相同的变化趋势,其中P5组饲料转化率最高,表明此时饲料中用于黄姑鱼幼鱼生长的营养物质比例较大。
研究表明,蛋白质效率随饲料蛋白质水平的升高显著降低[25-26]。本试验中,黄姑鱼幼鱼的蛋白质效率总体上随着饲料蛋白质水平的升高趋于降低,与上述结果类似。
3.2 饲料蛋白质水平对黄姑鱼幼鱼体组成和形体指标的影响
本试验结果表明,黄姑鱼幼鱼摄食不同蛋白质水平的饲料时,全鱼粗蛋白质含量无显著差异,这一结果与翘嘴红鲌(Erythroculterilishaeformis)[27]幼鱼和褐鳟(Salmotrutta)[28]的结果一致。这说明饲料蛋白质水平在一定范围(37.52%~61.48%)内变化不影响黄姑鱼幼鱼的体蛋白质的沉积量。这可能是因为在较低的饲料蛋白质水平下,鱼体对低蛋白质饲料的蛋白质生物效价显著高于高蛋白质饲料[29],以弥补饲料蛋白质水平的不足,保证机体蛋白质的积累。
本试验中,随着饲料蛋白质水平的升高,全鱼粗脂肪含量的变化无显著差异,说明鱼体粗脂肪含量不受饲料蛋白质水平的显著影响,这与四须鲃(Barbodesaltus)[30]、鳙(Aristichthysnobilis)[31]的结果相一致。但是,对虹鳟(Oncorhynchusmykiss)[32]、石斑鱼(Epinephelusmalabaricus)[33-34]的研究发现,随着饲料粗蛋白质水平的升高,鱼体粗脂肪含量却不断下降。
饲料蛋白质水平对黄姑鱼幼鱼全鱼粗灰分和水分含量没有显著影响,这与四须鲃[30]、罗非鱼(Sarotherodonmossambicus)[16]幼鱼的研究结果一致。本试验结果表明,各组黄姑鱼幼鱼的肝体比、脏体比无显著差异,这与大黄鱼[1]、金头鲷(Sparusaurata)[35]等的研究结果相一致。试验结果显示,饲料蛋白质水平未影响黄姑鱼幼鱼的肥满度,类似结果在大黄鱼[1]、宝石鲈(Scortumbacoo)[36]等鱼类上都有发现。
3.3 饲料蛋白质水平对黄姑鱼幼鱼肠道和肝脏消化酶活性的影响
饲料蛋白质水平影响鱼体的蛋白酶活性。对宝石鲈[36]、翘嘴红鲌[37]、牙鲆(Paralichthysolivaceus)[38]以及刺鲃(Barbodescaldwell)[39]等的研究均表明,在一定范围内,随饲料蛋白质水平的升高,鱼类肠道蛋白酶活性逐渐升高,当达到某一蛋白质水平后,蛋白酶活性不再增加,甚至还有所下降。本试验结果显示,当饲料蛋白质水平由37.52%升至56.80%时,黄姑鱼幼鱼肠道蛋白酶活性升高;当饲料蛋白质水平高于56.80%时,肠道蛋白酶活性略有下降,与上述报道基本一致。这可能是因为黄姑鱼为肉食性鱼类,对饲料蛋白质的需求量较高,肠道蛋白酶活性对饲料中蛋白质水平的变化比较敏感,饲料中的蛋白质可以刺激肠道蛋白酶的分泌[40-41];然而,过高的饲料蛋白质水平则增加了肠道的消化负担,代谢产生了较多的有毒含氮物质,对肠道蛋白酶的分泌产生负反馈调节[42]。本研究结果显示,黄姑鱼幼鱼肝脏蛋白酶活性不受饲料蛋白质水平的显著影响,这与刺鲃[39]、大鳞鲃(Barbuscapito)[43]、芙蓉鲤鲫[44]和瓦氏黄颡鱼(Pelteobagrusvachelli)[45]的研究结果一致。
本试验中,随着饲料蛋白质水平的升高,黄姑鱼幼鱼肠道和肝脏的淀粉酶活性均无显著变化。有关饲料蛋白质水平对鱼类消化腺淀粉酶活性的影响,在不同鱼类的研究中得到的结论并不一致,如肠道淀粉酶活性随饲料蛋白质水平的升高而升高[46]、降低[39,45]、先升高后降低[4,47]或不受影响[44]。刺鲃[39]、黑鲷[4]的肝胰脏淀粉酶活性随饲料蛋白质水平的升高先升高后降低;鳡(Elopichthysbambusa)[48]、翘嘴红鲌[37]、芙蓉鲤鲫[44]和瓦氏黄颡鱼[45]的肝胰脏淀粉酶活性随饲料蛋白质水平的升高没有显著变化。由此可见,饲料蛋白质水平对鱼类淀粉酶活性的影响因鱼而异。
一些研究表明,饲料蛋白质水平对鱼类的脂肪酶活性无显著影响,如宝石鲈[36]、瓦氏黄颡鱼[45]和翘嘴红鲌[37]等。在本试验中,饲料蛋白质水平对黄姑鱼幼鱼肠道和肝脏的脂肪酶活性均无显著影响,与上述研究结果一致。脂肪酶的活性主要与其所摄食的饲料种类有关,特别是饲料中脂肪的水平有关[38,49-50],而在本试验中各组饲料的脂肪水平是相等的,这可能是各组试验结果之间没有显著差异的原因。
4 结 论
饲料蛋白质水平影响黄姑鱼幼鱼的生长性能、肠道蛋白酶活性,基于特定生长率的折线模型拟合后获得黄姑鱼幼鱼对饲料中蛋白质的适宜需求量为55.31%。
[1] 林淑琴.不同生长阶段大黄鱼的蛋白质和蛋/能比营养研究[D].硕士学位论文.青岛:中国海洋大学,2013.
[2] 孙瑞健,张文兵,徐玮,等.饲料蛋白质水平与投喂频率对大黄鱼生长、体组成及蛋白质代谢的影响[J].水生生物学报,2013,37(2):281-289.
[3] LEE S M,PARK C S,BANG I C.Dietary protein requirement of young Japanese flounderParalichthysolivaceusfed isocaloric diets[J].Fisheries Science,2002,68(1):158-164.
[4] 王蕾蕾.黑鲷幼鱼适宜蛋白需要量的研究[D].硕士学位论文.杭州:浙江大学,2007.
[5] 楼宝,史会来,毛国民,等.黄姑鱼全人工繁育及大规格苗种培育技术研究[J].现代渔业信息,2011,26(3):20-23.
[6] 徐冬冬,楼宝,薛宝贵,等.黄姑鱼(Nibeaalbiflora)雌核发育的人工诱导及鉴定[J].海洋与湖沼,2013,44(2):310-317.
[7] 杨育凯,谢仰杰,蔡明夷,等.黄姑鱼雌核发育诱导及鉴定[J].水产学报,2013,37(9):1297-1303.
[9] 蔡明夷,刘贤德,翁朝红,等.大黄鱼与黄姑鱼杂交F1及其双亲的核型分析[J].集美大学学报:自然科学版,2012,17(5):321-326.
[10] 雷霁霖,樊宁臣,郑澄伟.黄姑鱼(NibeaalbifloraRichardson)胚胎及仔、稚鱼形态特征的初步观察[J].海洋水产研究,1981,(2):77-84.
[11] YANG S D,LIOU C H,LIU F G.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch (Bidyanusbidyanus)[J].Aquaculture,2002,213(1/2/3/4):363-372.
[12] CHEN Y J,TIAN L X,YANG H J,et al.Effect of protein and starch level in practical extruded diets on growth,feed utilization,body composition,and hepatic transaminases of juvenile grass carp,Ctenopharyngodonidella[J].Journal of the World Aquaculture Society,2012,43(2):187-197.
[13] SALHI M,BESSONART M,CHEDIAK G,et al.Growth,feed utilization and body composition of black catfish,Rhamdiaquelen,fry fed diets containing different protein and energy levels[J].Aquaculture,2004,231(1/2/3/4):435-444.
[14] 王胜.草鱼幼鱼对蛋白质和主要必需氨基酸需求的研究[D].博士学位论文.广州:中山大学,2006.
[15] VERGARA J M,FERNANDEZ-PALACIOS H,ROBAINA L,et al.The effects of varying dietary protein level on the growth,feed efficiency,protein utilization and body composition of gilthead sea bream fry[J].Fisheries Science,1996,62(4):620-623.
[16] JAUNCEY K.The effects of varying dietary protein level on the growth,food conversion,protein utilization and body composition of juvenile tilapias (Sarotherodonmossambicus)[J].Aquaculture,1982,27(1):43-54.
[17] BARCELLOS L J G,KREUTZ L C,DE SOUZA C,et al.Hematological changes in jundiá (RhamidaquelenQuoyandGaimardPimelodidae)after acute and chronic stress caused by usual aquacultural management,with emphasis on immunosuppressive effects[J].Aquaculture,2004,237(1/2/3/4):229-236.
[18] 刘颖.饲料蛋白水平及蛋白质量对彭泽鲫养殖全期生长的影响[D].硕士学位论文.北京:中国农业科学院,2008.
[19] 刘兴旺.大菱鲆及半滑舌鳎蛋白质营养生理研究[D].博士学位论文.青岛:中国海洋大学,2010.
[20] TAKEDA M,SHIMENO S,HOSOKAWA H,et al.The effect of dietary calorie-to-protein ratio on the growth,feed conversion and body composition of young yellowtail[J].Bulletin of the Japanese Society of Scientific Fisheries,1975,41(4):443-447.
[21] CHOU R L,SU M S,CHEN H Y.Optimal dietary protein and lipid levels for juvenile cobia (Rachyceutroncanadum)[J].Aquaculture,2001,193(1/2):81-89.
[22] KIM S S,LEE K J.Dietary protein requirement of juvenile tiger puffer (Takifugurubripes)[J].Aquaculture,2009,287(1/2):219-222.
[23] 钱雪桥,崔奕波,解绶启,等.养殖鱼类饲料蛋白需要量的研究进展[J].水生生物学报,2002,28(4):410-416.
[24] 林星.饲料中不同蛋白质水平对花鲈幼鱼生长和饲料利用的影响[J].福建农业学报,2013,28(7):648-652.
[25] 杨州,杨家新.暗纹东方魨幼鱼对蛋白质的最适需要量[J].水产学报,2003,27(5):450-455.
[26] 王常安,徐奇友,唐玲,等.大鳞鲃幼鱼蛋白质的需求量[J].华中农业大学学报,2014,33(3):90-96.
[27] 陈建明,叶金云,王友慧,等.翘嘴红鲌幼鱼对蛋白质的需要量[J].水产学报,2005,29(1):83-86.
[28] ARZEL J,MÉTAILLER R,KERLEGUER C,et al.The protein requirement of brown trout (Salmotrutta) fry[J].Aquaculture,1995,130(1):67-78.
[29] 李同庆,郝玉江,安瑞永,等.饲料蛋白水平对史氏鲟幼体消化率的影响[J].淡水渔业,2002,32(5):51-54.
[30] ELANGOVAN A,SHIM K F.Growth response of juvenileBarbodesaltusfed isocaloric diets with variable protein levels[J].Aquaculture,1997,158(3/4):321-329.
[31] SANTIAGO C B,REYS O S.Optimum dietary protein level for growth of bighead carp (Aristichthysnobilis) fry in a static water system[J].Aquaculture,1991,93(2):155-165.
[32] SASTIA B P.Quantitative protein requirements of rainbow trout[J].The Progressive Fish-Culturist,1974,36(2):80-85.
[33] SHIAU S Y,LAN C W.Optimum dietary protein level and protein to energy ratio for growth of grouper (Epinephelusmalabaricus)[J].Aquaculture,1996,145(1/2/3/4):259-266.
[34] CHEN H Y,TSAI J C.Optimal dietary protein level for the growth of juvenile grouper,Epinephelusmalabaricus,fed semipurified diets[J].Aquaculture,1994,119(2/3):265-271.
[35] SANTINHA P J M,GOMES E F S,COIMBRA J O.Effects of protein level of the diet on digestibility and growth of gilthead sea bream,SparusauratusL.[J].Aquaculture Nutrition,1996,2(2):81-87.
[36] 邵庆均,苏小凤,许梓荣,等.饲料蛋白水平对宝石鲈生长和体组成影响研究[J].水生生物学报,2004,28(4):367-373.
[37] 钱曦,王桂芹,周洪琪,等.饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J].动物营养学报,2007,19(2):182-187.
[38] 李金秋,林建斌,朱庆国,等.不同能量蛋白比饲料对牙鲆体内消化酶活性的影响[J].集美大学学报:自然科学版,2005,10(4):296-299.
[39] 吕耀平,陈建明,叶金云,等.饲料蛋白质水平对刺鲃幼鱼的生长、胴体营养组成及消化酶活性的影响[J].农业生物技术学报,2009,17(2):276-281.
[40] 杨代勤,严安生,陈芳,等.不同饲料对黄鳝消化酶活性的影响[J].水产学报,2003,27(6):558-563.
[41] 钱国英.不同驯食方式对鳜鱼胃肠道消化酶活性的影响[J].浙江农业大学学报,1998,24(2):207-210.
[42] DAS K M,TRIPATHl S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodonidella(Val.)[J].Aquaculture,1991,92:21-32.
[43] 王常安,徐奇友,徐伟,等.饲料蛋白质水平对大鳞鲃幼鱼消化酶活性的影响[J].天津农学院学报,2012,19(3):26-31.
[44] 何志刚,伍远安,王金龙,等.饲料蛋白水平对芙蓉鲤鲫幼鱼增重和消化酶活性的影响[J].湖北农业科学,2014,53(1):153-156.
[45] 孙翰昌,徐敬明,庞敏.饲料蛋白水平对瓦氏黄颡鱼消化酶活性的影响[J].水生态学杂志,2010,3(2):84-88.
[46] KAWAI S,IKEDA S.Studies on digestive enzymes of fish.Ⅲ.Development of the digestive enzymes of rainbow trout after hatching and the effect of dietary change on the activities of digestive enzymes in the juvenile stage[J].Bulletin of the Japanese Society of Scientific Fisheries,1973,39(7):819-823.
[47] 方桂萍.蛋白质水平对蒙古鲌生长、体成分及消化酶活性的影响[D].硕士学位论文.福州:福建农林大学,2014.
[48] 杨磊.蛋白质水平对鳡幼鱼生长、消化和蛋白质代谢的影响[D].硕士学位论文.武汉:华中农业大学,2011.
[49] 王重刚,陈品健,顾勇,等.不同饵料对真鲷稚鱼消化酶活性的影响[J].海洋学报,1998,20(4):103-106.
[50] 汤保贵,陈刚,张健东,等.饵料系列对军曹鱼仔鱼生长、消化酶活力和体成分的影响[J].水生生物学报,2007,31(4):479-484.
*Corresponding author, professor, E-mail: loubao6577@163.com
(责任编辑 菅景颖)
Effects of Dietary Protein Level on Growth Performance,Body Composition and Digestive Enzyme Activities of JuvenileNibeaalbiflora
LU Qiong1,2WANG Ligai1,2LOU Bao2,3*ZHAN Wei2,3CHEN Ruiyi2,3LUO Shengyu1LIU Jiajie1WANG Zhaolin1
(1.ZhejiangOceanUniversity,Zhoushan316022,China; 2.MarineFisheriesResearchInstituteofZhejiangProvince,Zhoushan316021,China; 3.KeyLabofMaricultureandEnhancementofZhejiangProvince,Zhoushan316021,China)
This experiment was conducted to investigate the effects of dietary protein level on growth performance, body composition and digestive enzyme activities of juvenileNibeaalbiflora. Fish meal, soybean meal and wheat gluten meal were used as main dietary protein sources to formulate isoenergetic and isolipidic diets at six protein levels, which were 37.52%, 41.80%, 46.52%, 49.84%, 56.80% and 61.48%, respectively. A total of 360 juvenileNibeaalbiflorawith the average body weight of (17.84±0.34) g were randomly allocated into 6 groups with 3 replicates per group and 20 juvenileNibeaalbifloraper replicate, and they were reared in 500 L water-flowing glass fiber reinforced plastic buckets, separately. An 8-week growth experiment was conducted under the condition of water temperature (27±2) ℃ and salinity 28 to 29. The results showed that the weight gain rate, specific growth rate and feed conversion rate of the juvenileNibeaalbiflorain the 56.80% group were significantly higher than those in the other groups except 61.48% group (P<0.05). With the dietary protein level increasing, there were no significant changes in hepatosomatic index, viscerasomatic index and condition factor of juvenileNibeaalbiflora. Dietary protein level had no significant influences on the contents of crude protein, crude lipid and ash in the body of juvenileNibeaalbiflora(P>0.05). The intestinal protease activity of juvenileNibeaalbifloraincreased at first and then decreased with the dietary protein level increasing. Dietary protein level had no significant influences on the activities of intestinal amylase, lipase as well as protease, amylase and lipase in the liver (P>0.05). With specific growth rate as an evaluating index, the optimal dietary protein requirement estimated by broken-line model is 55.39% for juvenileNibeaalbiflora.[ChineseJournalofAnimalNutrition, 2015, 27(12):3763-3771]
juvenileNibeaalbiflora; protein; growth; body composition; digestive enzymes
10.3969/j.issn.1006-267x.2015.12.015
2015-06-08
浙江省科技计划项目(2012C12907-8,2013F20001);浙江海洋学院科研启动经费资助
鲁 琼(1989—),男,河南新郑人,硕士研究生,研究方向为水产动物营养与饲料。E-mail: 111w2017@163.com
*通信作者:楼 宝,教授,硕士生导师,E-mail: loubao6577@163.com
S963
A
1006-267X(2015)12-3763-09
