儿童急性化脓性扁桃体炎和急性鼻窦炎的病原菌分布及药物敏感性
2015-05-05胡付品朱德妹
杨 洋, 胡付品, 朱德妹
·论著·
儿童急性化脓性扁桃体炎和急性鼻窦炎的病原菌分布及药物敏感性
杨 洋, 胡付品, 朱德妹
目的 了解儿童急性化脓性扁桃体炎和急性鼻窦炎的病原学分布及头孢托仑等对分离得到的病原菌的抗菌作用。方法 采用传统的细菌分离鉴定方法和分子生物学方法对分离获得的细菌进行鉴定,采用微量稀释法对分离获得的细菌进行头孢托仑等抗菌药物的体外敏感性测定。结果 肺炎链球菌(27.2%)、流感嗜血杆菌(25.2%)、金黄色葡萄球菌菌(金葡菌,21.8%)、卡他莫拉菌(19.7%)是引起儿童上呼吸道疾病的主要病原菌;头孢托仑对甲氧西林敏感金葡菌(MSSA)、肺炎链球菌包括青霉素敏感和中介株(PSSP和PISP)、化脓链球菌、流感嗜血杆菌和卡他莫拉菌均具有良好的抗菌活性。传统的细菌分离鉴定方法和分子生物学方法对肺炎链球菌和流感嗜血杆菌的鉴定结果基本一致。结论 头孢托仑对肺炎链球菌、流感嗜血杆菌、卡他莫拉菌和金葡菌具有良好的抗菌作用,可用于治疗上述各类敏感菌引起的儿童呼吸道感染。
急性化脓性扁桃体炎, 儿童; 急性鼻窦炎; 病原学; 头孢托仑; 药敏试验
急性化脓性扁桃体炎和急性鼻窦炎是儿童中重要的呼吸道疾病。肺炎链球菌、流感嗜血杆菌和卡他莫拉菌是该类疾病的最重要病原菌[1-4]。本文主要报道一项“头孢托仑匹酯细粒治疗儿童急性化脓性扁桃体炎和急性细菌性鼻窦炎的多中心、随机、双盲双模拟、阳性药物平行对照的有效性和安全性研究”中的病原学分布及药敏试验结果。
1 材料与方法
1.1 材料
1.1.1 菌种来源 菌种分离自国内15所医院诊断为急性化脓性扁桃体炎或急性鼻窦炎、需要进行全身抗菌药物治疗、年龄<14 岁、入选前72 h内尚未用过有效抗菌药物的患儿。各分中心于-80 ℃超低温冰箱保存分离得到的菌种,定期将菌种复苏并集中运送至中心实验室。
1.1.2 主要培养基和试剂 哥伦比亚血琼脂基础,鉴定流感嗜血杆菌的X、V、和X+V因子,以及鉴定肺炎链球菌的奥普脱欣(Optochin)纸片、去氧胆酸钠均为OXOID公司的产品,药敏试验用CAMHB(阳离子调节的MH肉汤)为BD公司的产品。VITEK生化反应鉴定条为法国生物梅里埃公司产品。
1.1.3 抗菌药物 药敏试验用抗菌药物头孢托仑为日本明治制果药业株式会社提供,头孢克洛、头孢克肟、头孢地尼、头孢曲松、阿莫西林、克拉维酸、阿奇霉素、苯唑西林和氨苄西林均为中国食品药品检定研究院技术服务部标准品。
1.1.4 基因分析 所用对肺炎链球菌和流感嗜血杆菌的DNA抽提试剂盒、进一步菌种确认及耐药性状分析的Cycleave聚合酶链反应(PCR)试剂盒(Lot: ACZB200)均为宝生物工程(TaKaRa)公司产品。
1.2 方法
1.2.1 细菌复核 按中华人民共和国卫生部医政处《全国临床检验操作规程》第3版中临床微生物学检验[5]进行细菌鉴定复核。将运送至中心实验室的菌株分别接种在含5%脱纤维羊血的哥伦比亚血平皿和巧克力平皿后置于5% CO2培养箱中,35 ℃培养过夜,获得纯培养物后结合形态学以及相应的生化反应进行菌种鉴定,其中肺炎链球菌进行Optochin敏感性试验和胆盐溶菌试验,嗜血杆菌进行X、V因子生长依赖试验,卡他莫拉菌和金黄色葡萄球菌(金葡菌)进行DNA酶试验。
1.2.2 抗菌药物的敏感性试验 按CLSI推荐的微量稀释法测定头孢托仑等抗菌药物对上述标本中分离获得菌株进行药敏试验。抗菌药物的测试浓度范围0.015~32 mg/L,细菌的接种菌量为 105CFU/mL。药敏试验设置受试菌生长对照、培养基空白对照;以金葡菌ATCC 29213、肺炎链球菌ATCC 49619和流感嗜血杆菌ATCC49247为质控菌株。
1.2.3 基因分析 DNA抽提按宝生物工程公司提供的试剂盒和试验操作步骤进行。抽提获得的细菌DNA保存在-70 ℃冰箱。待全部完成抽提后在蓝冰状态下送TaKaRa公司完成菌种及耐药性状的分子生物学鉴定。
1.2.4 菌种及耐药性状分子生物学测定 由宝生物工程公司按肺炎链球菌和流感嗜血杆菌菌种鉴定的保守序列以及对青霉素、大环内酯类、氨苄西林等抗菌药物的耐药性状设计特异性PCR引物,并采用PCR扩增方法进行上述两菌种的菌种确认和耐药性状检测。流感嗜血杆菌以ATCC 49247和ATCC 49766为对照;肺炎链球菌以ATCC49619为对照。
1.2.5 药敏试验判断标准和数据分析 采用SPSS软件统计分析抗菌药物对受试细菌的最低抑菌浓度(MIC)范围、MIC50和MIC90,按2012年CLSI M100-S22[6]的标准判断药敏试验中细菌对抗菌药物的敏感率和耐药率。其中肺炎链球菌对青霉素敏感性同时采用2012年CLSI M100-S22推荐的非脑膜炎肺炎链球菌和口服青霉素的2个标准。前者青霉素MIC≤2 mg/L为敏感、4 mg/L为中介、≥8 mg/L 为耐药;后者青霉素MIC≤0.06 mg/L、0.125~1 mg/L和≥2 mg/L 分别为青霉素敏感肺炎链球菌(PSSP)、青霉素中介肺炎链球菌(PISP)和青霉素耐药肺炎链球菌(PRSP)。
2 结果
2.1 细菌分布
急性化脓性扁桃体炎和急性鼻窦炎患儿中分离到符合方案并进行药敏试验的细菌共147株。菌种包括肺炎链球菌40株(27.2%),流感嗜血杆菌37株(25.2%),卡他莫拉菌29株(19.7%),金葡菌32株(21.8%),化脓链球菌9株(6.1%)(表1)。
2.2 细菌对头孢托仑等抗菌药物的敏感性
32株金葡菌中甲氧西林敏感株(MSSA)25株,耐药株(MRSA)7株。40株肺炎链球菌经种特异性PCR引物Lyt A扩增,结果39株获PCR扩增阳性,仅1株与传统鉴定不符合;按口服青霉素的判断标准,上述菌株中PSSP 、PISP 和PRSP分别为7、14和19株;按非脑膜炎分离菌株的判断标准则其中34株为PSSP,6株为PISP。37株流感嗜血杆菌进行种特异性引物PCR扩增,除1株未扩增出P6的产物外,其余菌株P6和Hib特异性荚膜基因引物扩增均为阳性;37株中产β内酰胺酶菌6株、不产β内酰胺酶菌31株。29株卡他莫拉菌中28株产β内酰胺酶。

表1 147株分离菌的分布
头孢托仑对MSSA、PSSP(非脑膜炎标准)、化脓链球菌、流感嗜血杆菌和卡他莫拉菌均具有良好的抗菌活性(表2)。其对上述前3种革兰阳性菌的MIC90分别为1、1和≤0.015 mg/L。本品对流感嗜血杆菌中的产酶株及不产酶株的MIC90均为0.03 mg/L。头孢托仑对卡他莫拉菌的MIC90为0.5 mg/L。1 mg/L 的本品可100%抑制MSSA(图1)、流感嗜血杆菌(图2)、卡他莫拉菌(图3)和超过90%抑制PSSP(青霉素MIC≤2 mg/L)生长(图4)。2 mg/L浓度的头孢托仑也可100%抑制另外6株肺炎链球菌生长。但本品对MRSA的抗菌活性差,MIC范围为32~>128 mg/L。

图1 头孢托仑等抗菌药物对25株MSSA的累计抑菌率

图3 头孢托仑等抗菌药物对29株卡他莫拉菌的累计抑菌率

图2 头孢托仑等抗菌药物对37株流感嗜血杆菌的累计抑菌率

图4 头孢托仑等抗菌药物对34株PSSP的累计抑菌率

Microorganism(no.ofisolates)AntibioticBreakpointaMIC/(mg/L)SRRange50%90%S/%R/%MSSA(25) Cefditoren≤1-0.25⁃10.51100- Cefaclor≤8≥321⁃8221000 Cefixime--2⁃844-- Cefdinir≤1≥4≤0.06⁃0.250.1250.251000 Ceftriaxone≤8≥640.5⁃2121000 Amoxicillin⁃clavulanicacid≤4/2≥8/40.25/0.125⁃1/0.50.5/0.251/0.51000 Azithromycin≤2≥80.5⁃>12864>12840.060.0 Oxacillin≤2≥40.25⁃20.511000MRSA(7)b Cefditoren≤1-32⁃>128--0- Cefaclor≤8≥3264⁃>128--07 Cefixime--64⁃>128-- -- Cefdinir≤1≥464⁃>128--07 Ceftriaxone≤8≥64>128--07 Amoxicillin⁃clavulanicacid≤4/2≥8/48/4⁃32/16--07 Azithromycin≤2≥82⁃>128--16 Oxacillin≤2≥432⁃>128--07S.pyogenes(9)b Cefditoren≤1-≤0.015--9- Cefaclor--0.125⁃0.25-- -- Cefixime--0.06⁃0.125-- -- Cefdinir--≤0.015-- -- Ceftriaxone≤0.5-≤0.015--9- Amoxicillin⁃clavulanicacid--≤0.015/0.008⁃0.03/0.015-- -- Azithromycin≤0.5≥20.125⁃>32--27 Penicillin≤0.125-≤0.015--9- S.pneumoniae(40) Cefditoren≤1-≤0.015⁃20.5287.5- Cefaclor≤1≥40.25⁃>32>32>3220.070.0 Cefixime--0.125⁃>321632 -- Cefdinir≤0.5≥20.03⁃3241630.065.0 Ceftriaxone≤1≥4≤0.015⁃41477.512.5 Amoxicillin⁃clavulanicacid≤2/1≥8/4≤0.015/0.008⁃4/21/0.54/282.50 Azithromycin≤0.5≥2>32>32>320100 Penicillin(nonmeningitis)≤2≥8≤0.015⁃41485.00
continued table 2
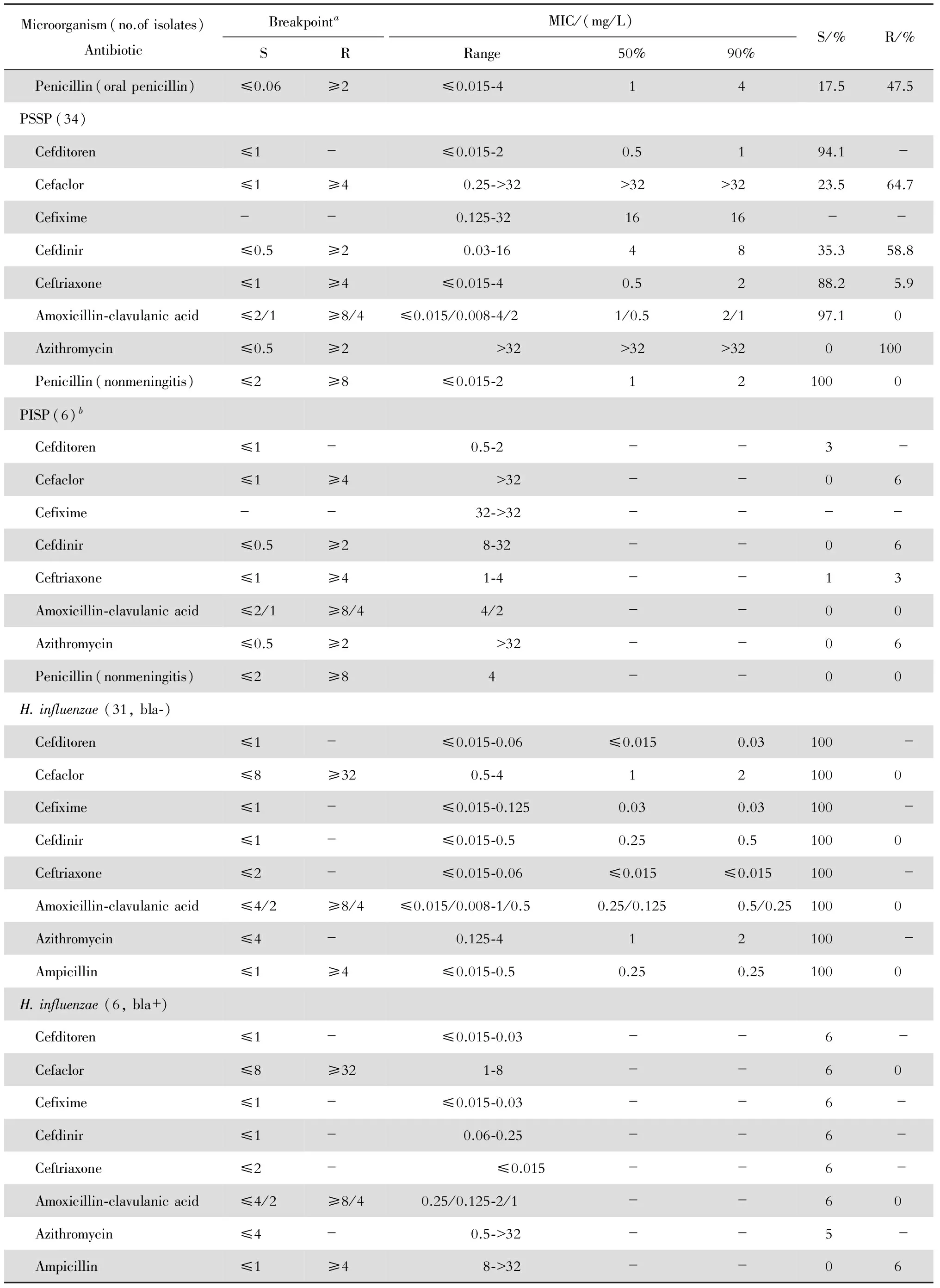
Microorganism(no.ofisolates)AntibioticBreakpointaMIC/(mg/L)SRRange50%90%S/%R/% Penicillin(oralpenicillin)≤0.06≥2≤0.015⁃41417.547.5PSSP(34) Cefditoren≤1-≤0.015⁃20.5194.1- Cefaclor≤1≥40.25⁃>32>32>3223.564.7 Cefixime--0.125⁃321616-- Cefdinir≤0.5≥20.03⁃164835.358.8 Ceftriaxone≤1≥4≤0.015⁃40.5288.25.9 Amoxicillin⁃clavulanicacid≤2/1≥8/4≤0.015/0.008⁃4/21/0.52/197.10 Azithromycin≤0.5≥2>32>32>320100 Penicillin(nonmeningitis)≤2≥8≤0.015⁃2121000PISP(6)b Cefditoren≤1-0.5⁃2--3- Cefaclor≤1≥4>32--06 Cefixime--32⁃>32-- - - Cefdinir≤0.5≥28⁃32--06 Ceftriaxone≤1≥41⁃4--13 Amoxicillin⁃clavulanicacid≤2/1≥8/44/2--00 Azithromycin≤0.5≥2>32--06 Penicillin(nonmeningitis)≤2≥84--00H.influenzae(31,bla⁃) Cefditoren≤1-≤0.015⁃0.06≤0.0150.03100 - Cefaclor≤8≥320.5⁃4121000 Cefixime≤1-≤0.015⁃0.1250.030.03100 - Cefdinir≤1-≤0.015⁃0.50.250.51000 Ceftriaxone≤2-≤0.015⁃0.06≤0.015≤0.015100 - Amoxicillin⁃clavulanicacid≤4/2≥8/4≤0.015/0.008⁃1/0.50.25/0.1250.5/0.251000 Azithromycin≤4-0.125⁃412100 - Ampicillin≤1≥4≤0.015⁃0.50.250.251000H.influenzae(6,bla+) Cefditoren≤1-≤0.015⁃0.03--6- Cefaclor≤8≥321⁃8--60 Cefixime≤1-≤0.015⁃0.03--6- Cefdinir≤1-0.06⁃0.25--6- Ceftriaxone≤2-≤0.015--6- Amoxicillin⁃clavulanicacid≤4/2≥8/40.25/0.125⁃2/1--60 Azithromycin≤4-0.5⁃>32--5- Ampicillin≤1≥48⁃>32--06
continued table 2

Microorganism(no.ofisolates)AntibioticBreakpointaMIC/(mg/L)SRRange50%90%S/%R/%H.influenzae(37) Cefditoren≤1-≤0.015⁃0.06≤0.0150.03100- Cefaclor≤8≥320.5⁃8141000 Cefixime≤1-≤0.015⁃0.1250.030.03100- Cefdinir≤1-≤0.015⁃0.50.250.5100- Ceftriaxone≤2-≤0.015⁃0.06≤0.015≤0.015100- Amoxicillin⁃clavulanicacid≤4/2≥8/4≤0.015/0.008⁃2/10.5/0.251/0.51000 Azithromycin≤4-0.125⁃>321297.6 - Ampicillin≤1≥4≤0.015⁃>320.251683.816.2M.catarrhalis(29) Cefditoren≤1-≤0.015⁃10.1250.5100- Cefaclor≤8≥320.25⁃160.5896.60 Cefixime--0.06⁃0.250.1250.25-- Cefdinir--0.06⁃0.50.1250.25-- Ceftriaxone≤2-0.03⁃20.251100- Amoxicillin⁃clavulanicacid≤4/2≥8/4≤0.015/0.008⁃0.5/0.250.125/0.060.5/0.251000 Azithromycin≤0.25-0.03⁃>320.125>3275.9-
-: no breakpoint.
aBreakpoints from the Clinical and Laboratory Standards Institute (CLSI) M100-S22. The breakpoints S≤1 mg/L for cefditoren are recommended by Japanese Society of Chemotherapy, but not CLSI.
bNumber of strains is presented instead of MIC50and MIC90data if the total number of strains is less than 10.
2.3 头孢托仑与其他抗菌药物的比较
头孢托仑对MSSA的抗菌作用与头孢曲松和阿莫西林-克拉维酸相仿、较头孢克洛和头孢克肟为优,但略差于头孢地尼。其MIC90值分别是头孢克肟、头孢曲松、头孢克洛和阿莫西林-克拉维酸的1/4、1/2、1/2和1倍。对化脓链球菌的抗菌作用与头孢地尼、头孢曲松和阿莫西林-克拉维酸相仿,优于头孢克洛和头孢克肟。对肺炎链球菌的抗菌作用优于头孢地尼、头孢克洛和头孢克肟;本品对PSSP(青霉素MIC≤2 mg/L)的抗菌作用与头孢曲松和阿莫西林-克拉维酸相仿;对PRSP(青霉素MIC>4 mg/L)的抗菌作用略优于头孢曲松和阿莫西林-克拉维酸。本品对流感嗜血杆菌的抗菌作用优于头孢克洛、略优于头孢地尼和阿莫西林-克拉维酸、与头孢克肟和头孢曲松相仿。本品对卡他莫拉菌的抗菌作用优于头孢克洛,其MIC90值是后者的1/16,与其他受试的β内酰胺类相仿。本品对肺炎链球菌和卡他莫拉菌的抗菌作用优于阿奇霉素,对流感嗜血杆菌大致相仿。头孢托仑及其他测试的β内酰胺类抗生素对MRSA的抗菌活性差,MIC90值均>128 mg/L(表2)。
3 讨论
急性化脓性扁桃体炎和急性鼻窦炎是儿童常见重要的上呼吸道感染性疾病。文献报道,引起感染的最常见的病原菌依次为:肺炎链球菌、卡他莫拉菌和流感嗜血杆菌,还可包括金葡菌、化脓链球菌和极少数肠杆菌科细菌[1-4,7]。积极有效的治疗对于急性化脓性扁桃体炎和急性鼻窦炎患儿的康复和健康发育至关重要。本组资料显示,从64例急性化脓性扁桃体炎和78例急性鼻窦炎患儿的上呼吸道标本中分离培养出肺炎链球菌、流感嗜血杆菌、金葡菌、卡他莫拉菌和β溶血链球菌,菌种与文献报道一致。采用头孢托仑等抗菌药物对本组147株细菌的药敏试验测定,结果显示1~2 mg/L浓度的头孢托仑可100%抑制除MRSA以外的上述常见病原菌生长。同期进行的多中心临床试验研究结果,也显示头孢托仑匹酯对上述细菌所致的急性化脓性扁桃体炎的临床有效率(100%)、细菌清除率(93.5%)和综合有效率(93.5%)与对照组头孢克洛(98.5%、93.9%和93.9%)相仿;头孢托仑匹酯对急性细菌性鼻窦炎的临床有效率(93.8%)、细菌清除率(74.3%)和综合有效率(74.3%)均明显高于对照组头孢克洛(86.6%、60.5%和60.5%)。
肺炎链球菌、流感嗜血杆菌和卡他莫拉菌是引起上呼吸道感染的重要病原菌,是儿童及老年人群社区获得性肺炎、血流感染、细菌性脑膜炎、急性化脓性扁桃体炎和急性鼻窦炎、急性中耳炎、急性下呼吸道感染的重要病原体。由于抗菌药物的广泛使用,使上述细菌对之产生一定程度上的耐药性。青霉素、氨苄西林作为治疗上述细菌感染的经典用药,目前因该菌的耐药性受到严重的挑战[8]。据中国CHINET细菌耐药性监测资料[9-11]显示,儿童中青霉素不敏感肺炎链球菌的检出率由2006年6.5%上升到2012年的22.9%;流感嗜血杆菌中β内酰胺酶的检出率近年也已达30%;卡他莫拉菌中β内酰胺酶的检出率目前已高达100%。此外,这些耐药的细菌往往是多重耐药菌[8-11]。肺炎链球菌对红霉素、克林霉素的耐药率可高达90%或以上,流感嗜血杆菌对氨苄西林和甲氧苄啶-磺胺甲口恶唑的耐药率也分别达到40%和70% 或以上;卡他莫拉菌对红霉素、克林霉素的耐药率分别达到40%和60% 或以上。本组资料中从急性化脓性扁桃体炎和急性鼻窦炎患儿标本中分离获得的40株肺炎链球菌中6株对青霉素不敏感(青霉素MIC>2 mg/L,15%),并对受试的头孢克洛、头孢地尼和阿奇霉素全部耐药;37株流感嗜血杆菌中6株产β内酰胺酶(16.2%);29株卡他莫拉菌中28株产β内酰胺酶(96.6%)。流感嗜血杆菌除因产β内酰胺酶所致对氨苄西林敏感性降低外,有文献报道β内酰胺酶阴性的菌株中目前也不乏对氨苄西林耐药的菌株,称为β内酰胺酶阴性氨苄西林耐药流感嗜血杆菌(β-lactamase negative ampicillin resistant, BLNAR)[12]。Jansen等[13]报道在欧州BLNAR的检出由2000年时1.5% 上升至2004年的33.9%;在日本同期检出率由5.8%上升到34.5%[14-15]。BLNAR主要的耐药机制是该菌细胞壁上的青霉素结合蛋白(PBP)发生突变,导致其对氨苄西林的亲和力降低,以及外膜蛋白改变所致的药物通透性降低所致。据中国CHINET细菌耐药监测资料显示,儿童中不产酶但对氨苄西林耐药的流感嗜血杆菌的菌株数及构成比正在上升,从2007年[16]的2.7%上升到2010年[17]的5.3%。值得引起重视。
头孢托仑匹酯是由日本明治制果药业株式会社开发的酯型口服第三代头孢菌素类抗生素[18-19]。该药是一种前体药物。在具有抗菌活性的头孢托仑的第二位羧基上通过酯结合的方式结合上新戊酰基羟甲基,从而提高了口服时的吸收性。本药口服后,肠壁上的酯酶将其水解,产生头孢托仑随血液分布于全身组织,对肺炎链球菌、流感嗜血杆菌、卡他莫拉菌及MSSA、化脓链球菌等病原菌具有良好的抗菌活性。本研究的药敏试验结果提示,头孢托仑匹酯可用于治疗上述儿童呼吸道感染。
致谢 参加本次多中心临床试验的单位有四川省人民医院,中国人民解放军第三军医大学第三附属医院,四川大学华西医院,中国人民解放军第四军医大学西京医院,复旦大学附属耳鼻喉科医院,北京大学第三医院,山西医科大学第一医院,无锡市第一人民医院,吉林大学第一医院,湖南省人民医院,昆明医科大学附属第二医院,上海交通大学医学院附属新华医院。以上各参加单位的医护人员在病例入选、标本处理、菌种保存和运输等方面均做出了很大的贡献,在此一并致谢。
[ 1 ] Meltzer EO, Hamilos DL, Hadley JA, et al. Rhinosinusitis: establishing definitions for clinical research and patient care[J]. J Allergy Clin Immunol, 2004,114(6 Suppl):155-212.
[ 2 ] Brook I, Yocum P, Shah K. Aerobic and anaerobic bacteriology of concurrent chronic otitis media with effusion and chronic sinusitis in children[J]. Arch Otolaryngol Head Neck Surg, 2000,126(2):174-176.
[ 3 ] Gentile A, Bazan V. Prevention of pneumococcal disease through vaccination[J]. Vaccine, 2011,29(Suppl 3):c15-c25.
[ 4 ] 张罗, 韩德民. 鼻窦炎病原菌和抗菌治疗的临床药理学[J]. 中国耳鼻咽喉头颈外科, 2006,13(12):845-850.
[ 5 ] 中华人民共和国卫生部医政司. 全国临床检验操作规程[M].3版.南京:东南大学出版社, 2006.
[ 6 ] Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing[S]. Twenty-Second Informational Supplement. 2012, M100-S22. Wayne, PA: Clinical and Laboratory Standards Institute.
[ 7 ] Gunnarsson RK, Holm SE, Soderstrom M. The prevalence of potential pathogenic bacteria in nasopharyngeal samples from individuals with a respiratory tract infection and a sore throat-implications for the diagnosis of pharyngotonsillitis[J]. Fam Pract, 2001,18(3):266-271.
[ 8 ] 王辉, 朱家馨, 刘勇, 等. 1999-2000年中国4所医院肺炎链球菌、流感嗜血杆菌及卡他莫拉菌的耐药现状[J]. 中国抗感染化疗杂志, 2001,1(3):142-146.
[ 9 ] 汪复. 2006年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2008,8(1):1-9.
[10] 朱德妹, 汪复, 胡付品, 等. 2010年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2011,11(5):321-329.
[11] 汪复, 朱德妹, 胡付品, 等. 2012年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2013,13(5):321-330.
[12] Tristram S, Jacobs MR, Appelbaum PC. Antimicrobial resistance inHaemophilusinfluenzae[J]. Clin Microbiol Rev, 2007,20(2):368-389.
[13] Jansen WT, Verel A, Beitsma M, et al. Longitudinal European surveillance study of antibiotic resistance ofHaemophilusinfluenzae[J]. J Antimicrob Chemother, 2006,58(4):873-877.
[14] Hasegawa K, Kobayashi R, Takada E, et al. High prevalence of type b beta-lactamase-non-producing ampicillin-resistantHaemophilusinfluenzaein meningitis: the situation in Japan where Hib vaccine has not been introduced[J]. J Antimicrob Chemother, 2006,57(6):1077-1082.
[15] Ubukata K, Shibasaki Y, Yamamoto K, et al. Association of amino acid substitutions in penicillin-binding protein 3 with beta-lactam resistance in beta-lactamase-negative ampicillin-resistantHaemophilusinfluenzae[J]. Antimicrob Agents Chemother, 2001,45(6):1693-1699.
[16] 张泓, 李万华, 王传清, 等. 2007中国CHINET流感嗜血杆菌耐药性监测[J]. 中国感染与化疗杂志, 2009,9(3):207-209.
[17] 张泓, 孔菁, 王传清, 等. 2010中国CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测[J]. 中国感染与化疗杂志, 2012,12(3):180-184.
[18] Yang Q, Xu Y, Chen M, et al.Invitroactivity of cefditoren and other comparators againstStreptococcuspneumoniae,Haemophilusinfluenzae, andMoraxellacatarrhaliscausing community-acquired respiratory tract infections in China[J]. Diagn Microbiol Infect Dis, 2012,73(2):187-191.
[19] Soriano F, Gimenez M J, Aguilar L. Cefditoren in upper and lower community-acquired respiratory tract infections[J]. Drug Des Devel Ther, 2011,5:85-94.
Distribution and susceptibility to cefditoren of pathogens causing acute suppurative tonsillitis and acute sinusitis in children
YANG Yang, HU Fupin, ZHU Demei
. (Institute of Antibiotics, Huashan Hospital, Fudan University, Key Laboratory of Clinical Pharmacology of Antibiotics, Ministry of Health, Shanghai 200040, China)
Objective To understand the etiology of acute suppurative tonsillitis and acute sinusitis in children and susceptibility to cefditoren. Methods Bacterial pathogens were isolated from the children with acute suppurative tonsillitis and acute sinusitis and identified by both traditional and molecular methods. Susceptibility testing was carried out with cefditoren and other antibiotics by broth microdilution method.ResultsS.pneumoniae(27.2%),H.influenzae(25.2%),S.aureus(21.8%) andM.catarrhalis(19.7%) were the major pathogens causing upper respiratory tract infections in children. Cefditoren showed strong antimicrobial activity against methicillin-susceptibleS.aureus,S.pneumoniae, including penicillin susceptible and intermediate strains,S.pyogenes,H.influenzaeandM.catarrhalis. The bacterial identification results by traditional method were basically consistent with the results by molecular method for bothS.pneumoniaeandH.influenzae. Conclusions Cefditoren has good activity againstS.pneumoniae,H.influenzae,M.catarrhalisandS.aureus. It is an appropriate treatment for respiratory tract infections caused by susceptible bacteria in children.
acute suppurative tonsillitis, children; acute sinusitis; etiology; cefditoren; susceptibility testing
国家科技部“重大新药创制”科技重大专项 (2012ZX 09303004-001)。
复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040。
杨洋(1988—),男,硕士研究生,主要从事抗菌药物药效学及细菌耐药性研究。
朱德妹,E-mail: zhu_dm@fudan.edu.cn。
R378
A
1009-7708(2015)04-0316-08
2014-12-31
2015-03-24
