人促卵泡激素体外生物学活性测定方法的建立
2015-05-04贾慧齐连权梁艳常翠云王鑫徐俊杰陈薇
贾慧,齐连权,梁艳,常翠云,王鑫,徐俊杰,陈薇
1.军事医学科学院 生物工程研究所 北京 100071;2.北京泰德制药股份有限公司,北京 100176
人促卵泡激素(follicle stimulating hormone,FSH)是一种治疗女性不孕的重要药物,主要用于治疗女性无排卵性不孕症、控制性卵巢刺激和辅助生殖技术等。FSH是一个异源二聚体的糖蛋白激素,由垂体前叶产生,相对分子质量约30×103。FSH由一个α亚基和一个β亚基经非共价键连接[1],其中α亚基与其他糖蛋白激素如促甲状腺素(thyroid stimu⁃lating hormone,TSH)、促黄体生成素(luteotropic hormone,LH)、胎盘产生的绒毛膜促性腺激素(chori⁃onic gonadotrophin,CG)一致,而β亚基为FSH所特有,发挥生物学活性。FSH用于女性不孕症的治疗已有40余年。目前,FSH主要来源为从绝经期妇女尿液中提取和在哺乳动物细胞中表达纯化重组FSH,由于重组FSH的高纯度和高度安全性,在过去20年被广泛接受和使用[2]。
迄今惟一被国内外监管机构批准和认可的FSH的体内活性测定方法仍为半个世纪前建立[3-6],该方法是基于FSH对雌性幼大鼠卵巢有增重作用。根据2010年版中国药典二部附录Ⅻ,FSH生物测定法采用的是比较尿促性素标准品与供试品对幼大鼠卵巢增重的作用,以测定供试品中FSH的效价。但是该方法具有很多局限性,如耗时长、操作繁琐,以及对结果重复性的限制等,并且该方法依赖于较高的实验技能。由于该方法须使用雌性幼大鼠,鼠龄要求严格,所以对待检样品的前期制备、贮存、运输及实验过程中的样品保存等有极高的稳定性要求。另外,大量动物的使用还存在伦理学上的问题。基于此,欧盟委员会联合各医药、化学制品、化妆品及生物制品企业,计划在产品开发和放行检测过程中尽量减少实验动物的数量[7]。
由于体内活性检测的局限性和限制性,近期上市的几个FSH产品使用了几种物理化学方法替代体内活性对产品进行检测,例如分子排阻高效液相色谱法、定量等电聚焦电泳法[8-10]。这些物理化学方法与传统的大鼠卵巢增重法(Steelman-Pohley法)相比,精确度有很大的提高,但是与生物学活性的特异相关性不高,包括酶联免疫方法等物理化学方法都不能很好地反应产品的生物学活性。
基于此,我们开发了一种体外细胞的活性测定方法,用人FSH的靶细胞来评价FSH的生物学活性。初级卵巢细胞的成熟由FSH诱导形成,所以在哺乳动物卵巢中颗粒细胞是FSH天然的靶细胞。FSH受体是G蛋白家族的一种跨膜蛋白受体,当FSH与位于靶细胞膜上的FSH受体结合后,激发cAMP信号传导通路,进而转录激活目的基因表达,激活芳香化酶,引起类固醇蛋白如孕酮、雌二醇等的合成和分泌。
已有多种人颗粒细胞系被建立用于研究和应用,例如来源于卵巢肿瘤细胞的HTOG、COV434和KGN细胞系,通过致癌性转化的HGL、HO-23、GCLa、HGP53细胞系[11]。KGN细胞株是从一位患有颗粒细胞癌的妇女身上获得的,在FSH受体的表达上表现出良好的生理活性。KGN细胞产生孕酮的量与FSH的加入呈一定的剂量反应关系[12],据此,我们建立了一种FSH的体外生物学活性测定方法,用不同浓度的FSH作用于KGN细胞,使细胞的孕酮分泌相应增加,采用ELISA方法检测细胞培养上清中孕酮含量的增加程度,以此反映FSH的生物学活性,无须任何改造,简单方便实用。
采用KGN细胞活性测定方法可同时检测多个样品,其结果用FSH国际标准品进行校正。相比药典规定的卵巢增重法,利用KGN细胞测定FSH活性的方法避免了耗时长、操作繁琐、重复性差的限制,评价结果的重现性和准确度均有大幅度提高,提高了生产效率,降低了生产和检测成本。
1 材料与方法
1.1 材料
KGN细胞系由解放军总医院母义明教授赠送;已上市的CHO细胞表达的重组人FSH产品果纳芬(Gonal-f)购自默克雪兰诺有限公司(批号BAO21064、BAO20708、BAO22155,13.6 IU/μg);自制 重 组 人 FSH( 批 号 R6008DS01、R6009DS01、R6010DS01);第二代FSH活性测定用国际标准品(NIBSC code为 08/282,12.6 IU/μg)购自英国国家生物制品检定所(NIBSC);活性测定用尿促性素国家标准品(150524-200503,190 IU/支)购自中国药品食品检定研究院。
DMEM/F12培养基购自Life Technology公司;胎牛血清(FBS)购自Gibco公司;青链霉素、胰蛋白酶、PBS缓冲液、0.4%台盼蓝染色液均购自Sigma公司;孕酮检测ELISA试剂盒分别购自Alpha Diagnos⁃tic公司和DRG公司;酶标仪和SoftMax分析软件为Molecular Devices公司产品。
1.2 细胞悬液和FSH样品制备
KGN细胞为单层贴壁生长细胞,生长用培养基为含10%FBS的DMEM/F12,于37℃、5%CO2条件下培养3~4 d,待细胞生长至对数生长期后可用于实验。细胞用0.25%胰酶消化2~3 min后弃去胰酶,用含10%FBS的DMEM/F12培养基重悬,台盼蓝染色法,在显微镜下用血球细胞计数板计数活细胞,调整细胞密度为2×105/mL,接种96孔细胞培养板,100 μL/孔,即2×104/孔,24 h后更换为含1%FBS的DMEM/F12培养基,然后用含1%FBS的DMEM/F12培养基对FSH样品进行1∶3系列稀释,共8个稀释度,将稀释好的样品加入96孔细胞培养板中,100 μL/孔,每个样品2个复孔,于37℃、5%CO2条件下分别培养24、48、72、96 h后检测。
1.3 孕酮含量检测
待FSH作用细胞不同时间后,用DRG公司生产的孕酮含量检测ELISA试剂盒(D450nm的线性范围为0~2.5)检测各孔细胞培养上清中的孕酮含量:分别取各孔细胞上清25 μL,转移至已包被好的ELISA板中,同时每板中加入试剂盒提供的孕酮标准品,室温下摇床孵育5 min,每孔加入200 μL酶联抗体,室温下摇床孵育1 h,弃去各孔液体,用洗液清洗各孔,每孔300 μL,重复清洗3次,每孔加入200 μL显色溶液,室温下反应15 min,每孔加入50 μL终止液终止显色,用酶标仪测定D450nm值,并利用SoftMax软件进行数据计算和分析,制作孕酮标准品曲线,分别计算不同FSH浓度作用下各孔的孕酮含量。
1.4 采用FSH国际标准品确定样品的活性单位
利用SoftMax软件,以国际标准品和样品的浓度为横坐标、对应的D450nm值为纵坐标,绘制国际标准品和样品的剂量-反应曲线,采用四参数方程进行拟合,分别计算标准品和样品的EC50值,用国际标准品的活性对样品活性按下式进行校正:
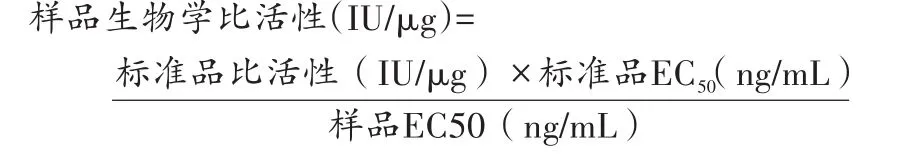
1.5 方法学验证和多批次样品检测
对建立的方法的专属性、线性与范围、准确性、精密度和耐受性进行验证,采用该方法对多批次FSH产品进行检测。
2 结果
2.1 最佳作用时间和浓度的确定
不同浓度的FSH作用KGN细胞24、48、72、96 h后检测细胞的孕酮含量,结果见图1。在不同浓度的FSH作用下,KGN细胞分泌出不同浓度的孕酮,FSH浓度为0.1~200 ng/mL范围内,细胞的孕酮分泌量与FSH浓度呈明显的剂量相关性。随着作用时间的延长,相同浓度FSH作用下KGN细胞的孕酮分泌量逐渐升高,高浓度FSH作用24、48、72、96 h时,诱导 KGN细胞分泌的孕酮量分别为0.4、11.2、96.8和112.5 ng/mL,与培养基对照组相比,孕酮分泌量分别提高了约0.4、10、100和110倍。各浓度FSH作用24 h时细胞基本无孕酮分泌,高浓度FSH作用48 h后显示孕酮含量增加,但幅度不明显,作用72 h后孕酮分泌量明显升高,96 h与72 h相比孕酮分泌量也略有升高。
以FSH浓度为横坐标、D450nm值为纵坐标做图(图2),结果显示作用24 h时D450nm值与阴性对照一致;高浓度FSH作用48 h后D450nm值明显降低,但还未形成良好的S型作用曲线;各浓度FSH作用72和96 h后,D450nm值与FSH浓度形成典型的S型作用曲线。比较后可以看出,作用96与72 h相比孕酮含量并没有明显提高,作用曲线一致。因此,为缩短检测时间,最终确定该方法最佳作用时间为72 h,FSH作用浓度为0.1~200 ng/mL。
2.2 样品检测并采用FSH国际标准品进行标定
对市售重组FSH(默克雪兰诺有限公司)采用最终确定的方法进行检测,选用对数生长期KGN细胞,检测结果(表1)与该市售样品的标示量(13.6 IU/μg)一致。
2.3 方法学验证
2.3.1 专属性 FSH产品中含有一定浓度的辅料,因此考察辅料成分对KGN细胞是否有刺激作用。用超纯水配制不含FSH的辅料溶液,然后按同样方法分别稀释辅料溶液和FSH蛋白溶液,作用KGN细胞72 h后检测孕酮含量。结果显示各稀释率下辅料D450nm值均与阴性对照一致(图3),说明辅料对KGN细胞无刺激作用,对结果不产生影响。
2.3.2 线性与范围 国际标准品、市售重组FSH(批号:BAO21064)和自制样品(批号:R6008DS01)在FSH为0.1~200 ng/mL范围内均存在良好的剂量反应曲线,且符合四参数方程式(表2),呈典型的倒S型,相关系数均在0.99以上。国际标准品和FSH样品的剂量反应曲线见图4,其相关系数分别为0.994、0.996和0.998,三者作用曲线重合,说明3种FSH样品的量效作用关系一致,属于同质样品,其活性结果可以用国际标准品进行校正。
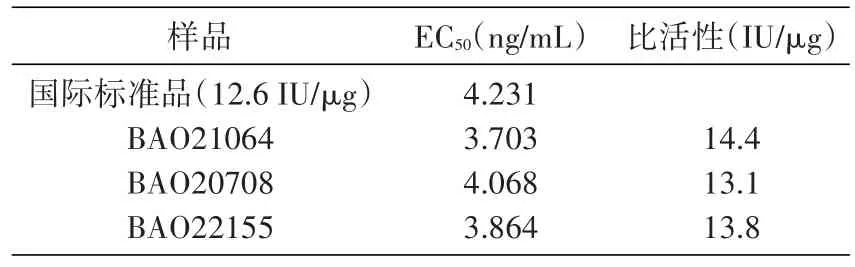
表1 市售样品检测结果

图1 FSH作用不同时间孕酮分泌量比较
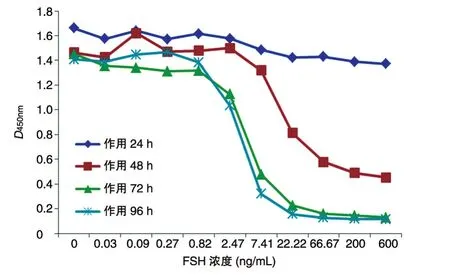
图2 FSH作用不同时间作用曲线比较
2.3.3 准 确 性 试 验 FSH自 制 样 品(批 号 :R6008DS01)与国际标准品按一定比例混合,分别制成50%、100%、150%添加的回收率样品,进行活性测定,并与标准品理论添加值进行比较,每个样品重复测定3次。结果见表3,各样品的回收率为86%~114%(表3),符合生物学活性测定的回收率要求。
2.3.4 精密度实验 对3批市售FSH样品和3批自制FSH样品分别重复测定3次,计算变异系数,其比活性平均值为12.9~14.3 IU/μg(表 4),其变异系数均小于15%。
2.3.5 耐用性试验 市售有不同厂家的孕酮检测试剂盒,检测原理基本相同,但检测灵敏度会有所不同。选用较常用的2个厂家的孕酮检测ELISA试剂盒(分别为Alpha Diagnostic公司和DRG公司产品)进行试验,这2种试剂盒检测原理相同,但说明书显示其检测灵敏度和吸光度值范围有所差异。结果显示,在同样浓度条件下,Alpha Diagnostic公司试剂盒测定的D450nm值为0.2~1.174,DRG公司的则为0.3~1.90(图5),二者的检测灵敏度存在一定差异,但剂量反应曲线非常一致(图6),EC50值一致。经国际标准品校正,得出的结果显示2种试剂盒检测活性一致(表5),说明该方法对不同品牌的试剂盒有很好的耐用性。

表2 FSH活性测定四参数方程
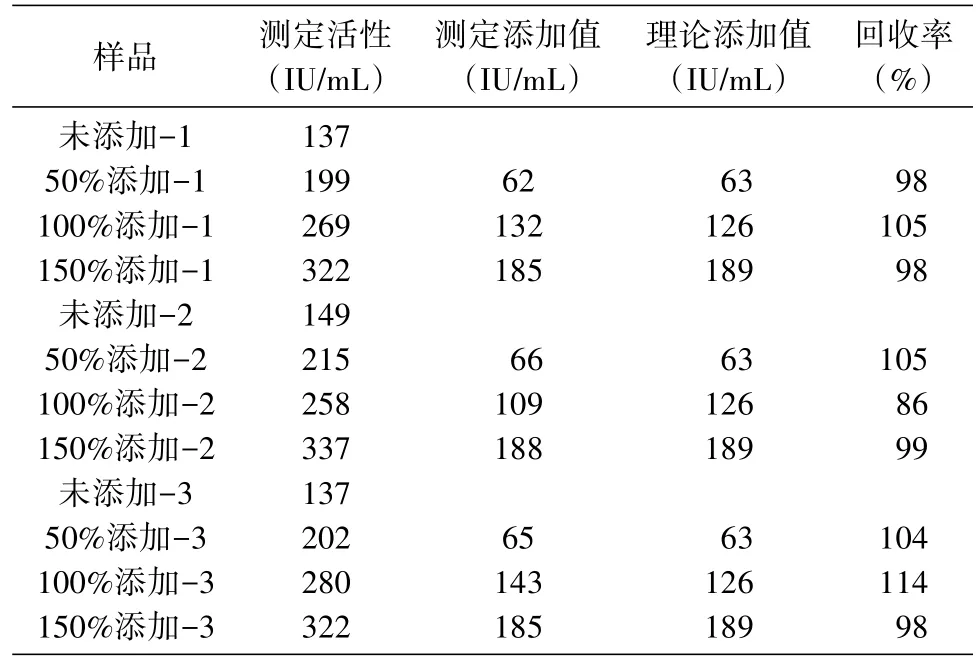
表3 回收率实验结果
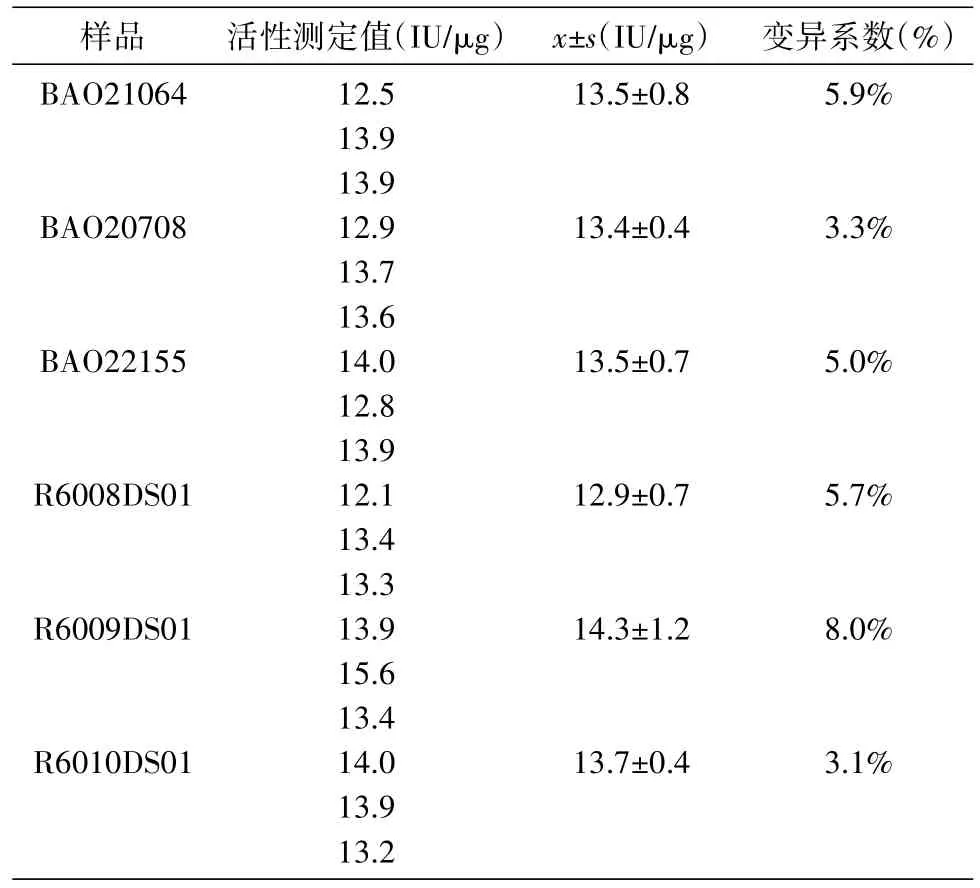
表4 精密度实验结果
2.4 与大鼠卵巢增重法测定结果比较
选择3批市售果纳芬样品和1批尿源FSH国家标准品进行活性测定,并与传统方法(大鼠卵巢增重法)测定结果进行比较,发现KGN细胞活性测定结果与卵巢增重法测定结果一致(表6、7)。
3 讨论
如同促红细胞生成素、人体绒毛膜促性腺激素和人类促黄体生成素,FSH仍是为数不多的需要体内活性测定方法的蛋白质。惟一被国内外相关监管机构批准的体内活性检测方法仍是在1953年建立的大鼠卵巢增重法。该方法有很大的局限性,包括须使用大量动物,试验方法的准确性、精密度,以及较复杂的结果计算方法。此外,有研究表明FSH在其他哺乳动物体内的药代动力学行为与在大鼠体内存在差异,因此采用大鼠卵巢增重法进行FSH生物学活性评价可能存在种属上的差异[13]。
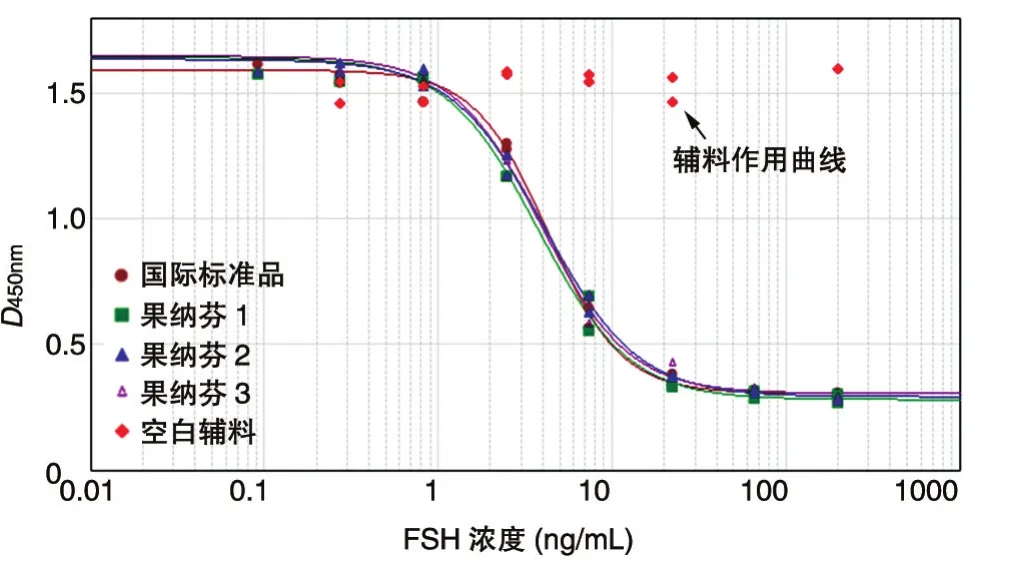
图3 专属性实验结果(辅料影响)
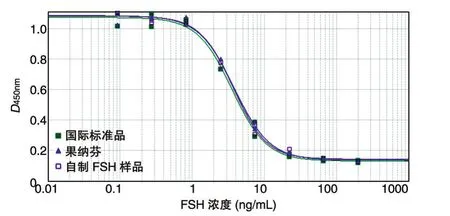
图4 四参数剂量反应曲线
为避免该方法的缺陷,近年尝试采用一些理化方法如凝胶排阻层析法、等点聚焦法及反相色谱法等[8-10]代替体内测定方法,但这些方法都不能很好地反映生物学活性,其结果必须与几十批产品的体内活性结果进行相关性分析。此外,这些理化分析方法对样品的纯度要求很高,其结果与产品的不同工艺相关,所以通用性不是很好。
本研究建立的KGN细胞体外生物活性测定法可以克服上述体内活性测定方法和理化方法的局限性。KGN细胞来源于人,天然表达FSH受体,不需要进行基因转染等修饰[11]。KGN细胞经不同浓度的FSH刺激后产生的孕酮分泌量的变化可以通过商用的孕酮检测ELISA试剂盒进行测定。与体内测定法相同,该方法在检测时可以使用活性测定用FSH国际标准品(92/642或08/282)对结果进行校正[14]。而对于色谱法等理化测定方法,由于该国际标准品辅料中含有大量人血清白蛋白而对结果产生干扰,所以不能用于理化测定方法的校正。与体内活性测定法相比,KGN细胞检测法需要的FSH蛋白剂量范围更宽,为0.1~200 ng/mL。经过完整的方法学验证,结果表明该方法对FSH有很好的专属性,并且不受样品中辅料物质的干扰;在一定的浓度范围内有很好的剂量-反应相关作用曲线,回收率实验结果为80%~120%,精密度试验的变异系数在15%以内,对于生物活性测定方法来说有很高的准确度和精密度;孕酮含量检测考察了2种品牌的商用ELISA试剂盒,虽然有不同的灵敏度,但对结果的测定和计算没有明显差异,表现了很好的耐用性。该方法使用96孔细胞培养板进行检测,可同时进行多个样品的检测,与体内活性检测方法相比,可以大大提高检测效率,同时可显著降低检测成本。更重要的是,与理化测定方法不同,KGN细胞活性测定法对CHO细胞表达的重组人FSH和尿源FSH产品都有很好的适用性,其结果与体内活性测定一致。综上所述,这种KGN细胞体外活性测定法可以对FSH的生物学活性进行很好的评价,其结果可以对临床试验进行很好的预测。
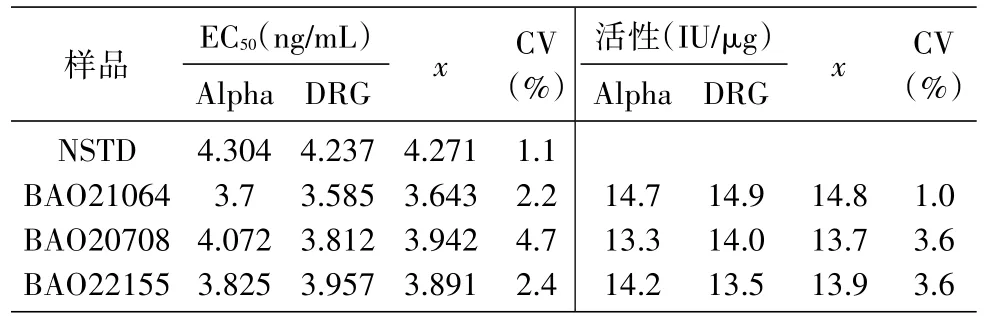
表5 不同品牌试剂盒实验结果
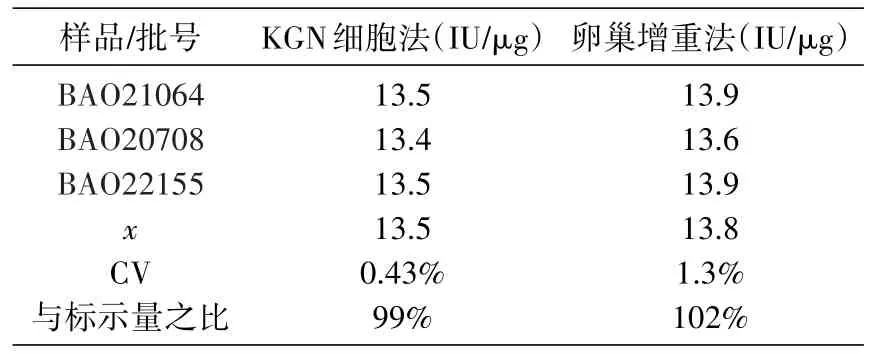
表6 与卵巢增重法结果比较(果纳芬)
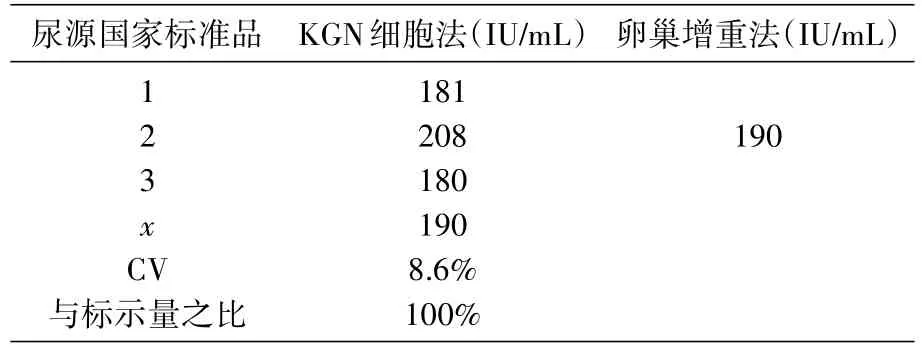
表7 与卵巢增重法结果比较(尿源国家标准品)
国内外药品监管机构一直鼓励开发新的分析方法代替动物实验方法进行生物活性分析[15],但是像FSH这样的激素类糖蛋白,由于其结构的异质性,开发一种体外活性测定方法来代替动物实验方法确实存在很大的挑战性。FSH的不同唾液酸化程度受上游细胞培养条件的影响很大,导致产生很多不同的糖型结构[13,16]。这些不同的结构亚型在体内表现了不同的药代动力学结果,例如不同的唾液酸化程度其在体内的半衰期有很大的不同[17]。本研究开发的基于KGN细胞的体外活性测定方法可以区分不同的结构特征。KGN颗粒细胞系是一个很好的FSH体外作用模型,细胞表面具有天然的FSH受体,无须进行基因转染等改造。FSH作用于KGN细胞,使其产生孕酮,其产生量与FSH浓度具有明显的剂量反应关系,可以很好地反映FSH在体内的生物学活性。综上所述,KGN细胞体外测定方法有诸多优势,有望在将来代替现有的体内活性测定方法,对FSH产品进行生物学活性评价,更易于对FSH产品进行质量控制和一致性比较。
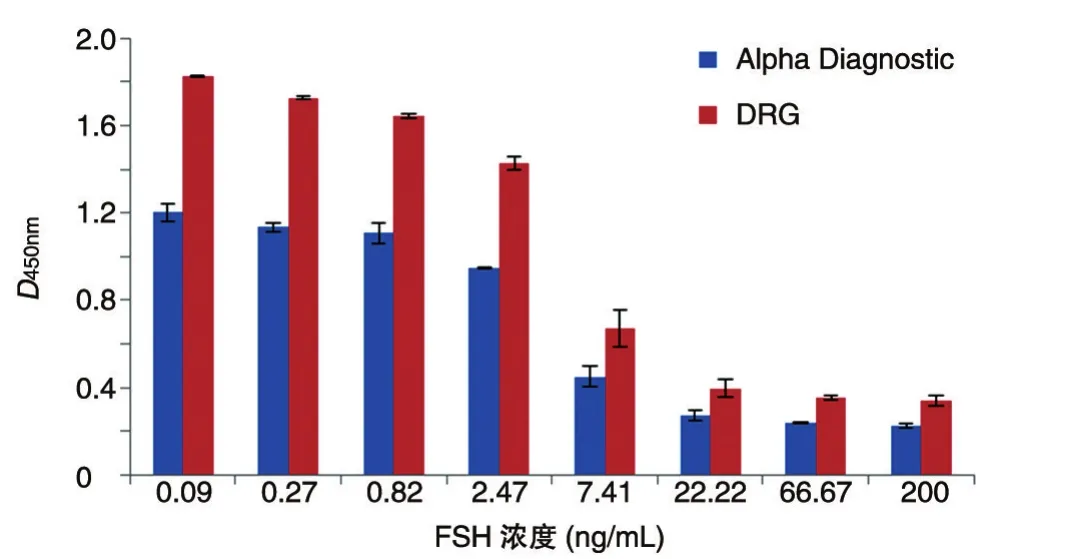
图5 不同品牌孕酮检测试剂盒吸光度值比较
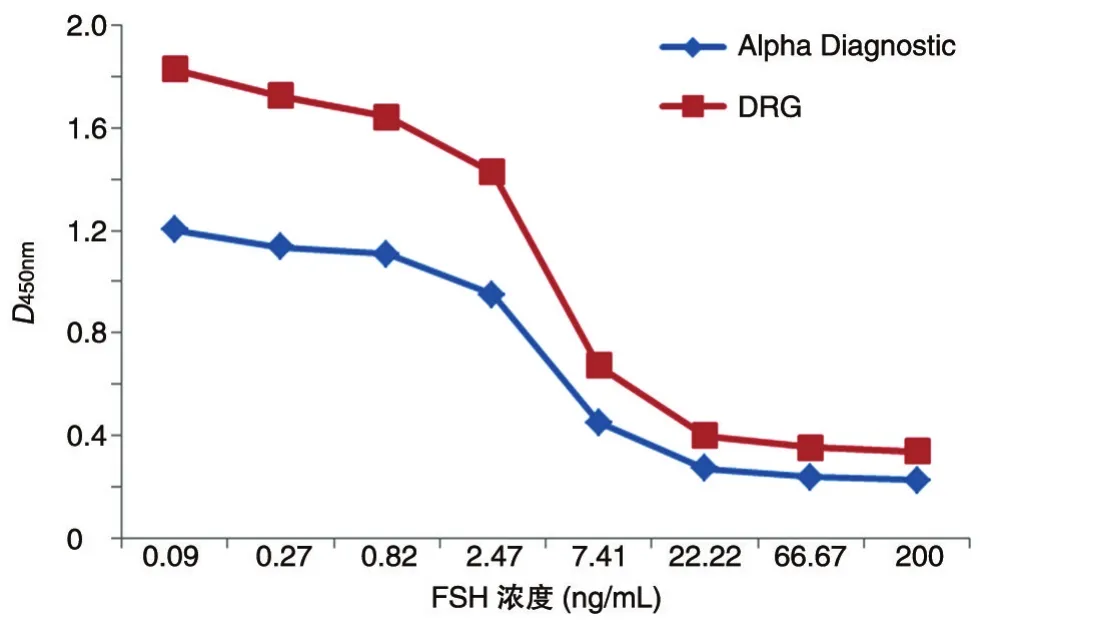
图6 不同品牌孕酮检测试剂盒作用曲线比较
[1] Baenziger J U,Green E D.Pituitary glycoprotein hormone oli⁃gosaccharides:structure,synthesis and function of the aspara⁃gine-linked oligosaccharides on lutropin,follitropin and thyro⁃tropin[J].Biochim Biophys Acta,1988,947(2):287-306.
[2] Gleicher N,Vietzke M,Vidali A.Bye-bye urinary gonadotro⁃phins?Recombinant FSH:a real progress in ovulation induc⁃tion and IVF[J]?Hum Reprod,2003,18(3):476-482.
[3] Steelman S L,Pohley F M.Assay of the follicle stimulating hormone based on the augmentation with human chorionic go⁃nadotropin[J].Endocrinoloy,1953,53(6):604-616.
[4] European Directorate for Quality Medicines.Urofollitropin monography 0958[S]//European Pharmacopoeia 7.0, 2011:31777.
[5] Expert Committee.Biologics and biotechnology proteins and polysaccharides[S]//United States Pharmacopeial Convention.United States Pharmacopeia(USP 29-NF24),2006:1336.
[6] 国家药典委员会.卵泡刺激素生物测定法[S]//中华人民共和国药典(二部).北京:中国医药科技出版社,2010:121-122.
[7] Balls M.The three Rs and the humanity criterion[M].Notting⁃ham:Frame,2009.
[8] Driebergen R, Baer G.Quantification of follicle stimulating hormone(follitropin alfa):is in vivo bioassay still relevant in the recombinant age[J]?Curr Med Res Opin,2003,19(1):41-46.
[9] Mulders J W M,Derksen M,Swolfs A,et al.Prediction of the in vivo biological activity of human recombinant follicle stimulating hormone using quantitative isoelectric focusing[J].Biologicals,1997,25(3):269-281.
[10]Almeida B E,Oliveira J E,Damiani R,et al.A pilot study on potency determination of human follicle stimu¬lating hor⁃mone:A comparison between reversed-phase high-perfor⁃mance liquid chromatography method and the in vivo bioassay[J].J Pharm Biomed,2011,54(4):681-686.
[11]Havelock J C,Rainey W E,Carr B R.Ovarian granulosa cell lines[J].Mol Cell Endocrinol,2004,228:67-78.
[12]Nishi Y,Yanase T,Mu Yi-Ming,et al.Establishment and characterization of a steroidogenic human granulosa-Like tu⁃mor cell line,KGN,that expresses functional follicle stimulat⁃ing hormone receptor[J].Endocrinology,2001,142(1):437-445.
[13]de Leeuw R,Mulders J,Voortman G,et al.Structure-func⁃tion relationship of recombinant follicle stimulating hormone(Puregon)[J].Mol Hum Reprod,1996,2(5):361-369.
[14]Burns C,Tiplady R,Moore M,et al.WHO international col⁃laborativestudy oftheproposed 2nd internationalstandard for follicle-stimulating hormone,human,recombinant,for bio⁃assay[M].Geneva:WHO Press,2010.
[15]Rabouhans M L.Reduction of animal usage:British Pharmaco⁃poeia Commission policy[J].Dev Biol Stand,1986,64:11-16.
[16]Gervais A,Hammel Y,Pelloux S,et al.Glycosylation of hu⁃man recombinant gonadotrophins:characterization and batchto-batch consistency[J].Glycobiology,2003,13(3):179-189.
[17]D'Antonio M,Borrelli F,Datola A,et al.Biological character⁃ization of recombinant human follicle stimulating hormone iso⁃forms[J].Hum Reprod,1999,14(5):1160-1167.
