不同培养基、外源激素和真菌诱导子对北柴胡毛状根生长及柴胡皂苷含量的影响
2015-05-04孙晶高珂王玲吴素瑞杨洪一隋春
孙晶,高珂,王玲,吴素瑞,杨洪一,隋春
1.中国医学科学院 药用植物研究所,北京 100193;2.东北林业大学 生命科学院,黑龙江 哈尔滨 150040;
3.中草药物质基础与资源利用教育部重点实验室,北京 100193
北柴胡(Bupleurum chinense DC.)为伞形科柴胡属植物,是《中华人民共和国药典》(2010年版)规定的药用柴胡基源植物之一,以根入药。柴胡皂苷为其主要药效成分,包括柴胡皂苷A、C和D。柴胡皂苷在镇静、抗炎、免疫调节、抗病毒、抗肿瘤、抗炎、保肝等方面起重要作用[1],同时也是鉴定柴胡原药材质量的重要标准[2]。毛状根培养是20世纪80年代发展起来的基因工程和细胞工程相结合的一项技术,通过将发根农杆菌(Agrobacterium rhizogenes)中Ri质粒含有的T-DNA整合到植物细胞的DNA上,诱导植物细胞产生毛状根。毛状根具有生长迅速、激素自养、生长条件简单、次生代谢产物含量高且稳定、分化程度高、不易变异等特点[3-4]。通过优化毛状根液体培养条件和培养基成分,可以增强毛状根合成天然活性成分的能力,甚至合成原植物没有的、生理活性更强的天然药物成分[5]。目前为止,毛状根大规模培养已应用于丹参(Salvia miltiorrhiza)[6-7]、人参(Panax ginseng)[8]、黄芩(Scutellaria baicalensis)[9]、青蒿(Artemisia annua)[10]和金铁锁(Psammosilene tu⁃nicoides)[11]等多种药用植物。我们对北柴胡毛状根培养中的培养基、外源激素和真菌诱导子等进行了优化,为北柴胡毛状根大规模培养提供重要参考。
1 材料与方法
1.1 材料
从本实验室前期诱导获得的北柴胡毛状根中选取一个长势优良的株系作为实验材料。切取1~1.5 cm长的毛状根根尖,每50条为一份,接种于250 mL锥形瓶(装有100 mL培养液)中。基本培养条件:B5液体培养基(pH5.7),添加20 g/L蔗糖,暗培养,摇床转速为110 r/min,培养温度为25±2℃,每15 d继代一次,继代第3次后第10 d取样。
1.2 培养基、外源激素和真菌诱导子处理条件
实验设置如下多个不同培养条件处理组:①培养基3种,即B5、改良White和WPM,3种培养基均以浓度为20 g/L的蔗糖作为碳源,pH值分别为5.8、5.6和5.7[12]。②外源激素3种,3-吲哚丁酸(IBA)浓度设置为0.2、0.5、1.0、3.0 mg/mL,吲哚-3-乙酸(IAA)浓度设置为0.2、0.5、1.0 mg/mL,6-苄氨基嘌呤(6-BA)浓度设置为 0.2、3.0 mg/mL。③黑曲霉诱导子的制备和筛选:黑曲霉(Aspergillus niger,由中国林业科学研究院森林生态环境与保护研究所提供)接种于马铃薯葡萄糖液体培养基(每升培养基中含葡萄糖2 g、20%马铃薯浸汁100 mL)中,于摇床上120 r/min、25℃、暗培养3 d收获,将悬浮培养的菌球抽滤,加入10倍体积的蒸馏水稀释,匀浆液于高压灭菌,再抽滤,滤液即为可供使用的真菌诱导子[13]。每50 mL B5培养基中分别添加1.0、1.5、2.0、2.5 mL黑曲霉真菌诱导子。
以上每种处理均接种3瓶,培养3个月收获,测定毛状根干重和皂苷含量。
1.3 产量与含量测定分析
将收获的毛状根用蒸馏水清洗4次,用无菌滤纸吸除表面多余水分,42℃烘干48 h,测其干重。以干重为毛状根产量衡量标准,皂苷产量(μg)=(皂苷含量×收获后干重[14])。
1.3.1 总皂苷提取方法 称取干燥的毛状根粉末1 g置于100 mL三角瓶中,用50 mL 5%氨水甲醇溶液超声波提取40 min,抽滤,70℃水浴蒸干后,用色谱甲醇定容至5 mL容量瓶,用0.45 μm微孔滤膜过滤[15]。
1.3.2 HPLC 条件 ASB-vensil C 18 色谱柱(25 cm×4.6 mm,5 μm);流动相A为水/0.05%NH4OH,B为乙腈,流速1.50 mL/min;用LC parameters检测,柱温40±0.15℃,指纹图谱梯度运行时间27 min,进样量 20 μL。梯度洗脱程序:0~15 min,10%~85%(B);15~18 min,85%~85%(B);18~22 min,85%~10%(B);22~27 min,10%~10%(B)。
1.3.3 几种单体皂苷标准曲线的绘制 分别称取柴胡皂苷A、C和D,用色谱甲醇定容成标准品溶液,再配成混合的标准品溶液,以进样浓度C对峰面积进行线性回归,得到各单体皂苷的回归方程。皂苷A:y=1.4097x+16.4560,R2=0.9984,在 0.05~1.0 g/L 线性关系良好;皂苷C:y=1.4182x+16.4145,R2=0.9995,在0.05~1.0 g/L 线性关系良好;皂苷 D:y=1.4366x+16.3654,R2=0.9991,在 0.05~1.0 g/L 线性关系良好。采用上述色谱条件测定各样品柴胡皂苷峰面积,根据回归方程计算柴胡皂苷A、C和D的含量。
2 结果
2.1 3种培养基筛选结果
3种基本培养基对毛状根产量的影响见图1A,北柴胡毛状根在B5液体培养基中生长效果最好,毛状根干重最高,为2.065 g。在柴胡皂苷合成和积累方面,如图1B所示,B5培养基处理组的柴胡总皂苷含量最高,为991.95 μg/g,改良White次之。但图1C表明,B5处理组的柴胡单体皂苷并不是都高于其他处理组,其中B5处理组柴胡皂苷C、A和D含量分别为 130.44、534.0 和 318.54 μg/g,改良 White处理组中柴胡皂苷 D含量为 419.17 μg/g,高于 B5处理组,这也表明不同培养基对柴胡毛状根单体皂苷合成和积累存在不同影响。此外,分析HPLC数据,发现改良White处理组重复间差异很大,较不稳定。综合毛状根产量和柴胡总皂苷产量(图1D),B5培养基处理组的总皂苷含量和产量都最高,分别为991.95 μg/g和2.048 mg。因此,选定B5为柴胡毛状根液体培养基本培养基。
2.2 激素对北柴胡毛状根生长和柴胡皂苷含量的影响
在B5培养基中分别添加激素IAA、IBA、6-BA,均能促进北柴胡毛状根的生长,3种外源激素对毛状根生长的促进作用没有明显的区别。由图2A可知3种激素的最适宜浓度:在添加IBA的培养基中生长量较高,其中浓度为0.5 mg/L的IBA可使毛状根产量最高,干重为2.4 g;浓度为0.2 mg/L的6-BA对毛状根的生长影响次之,干重为2.28 g;浓度为1.0 mg/L的IAA,毛状根干重为2.27 g。在加入激素6-BA的处理组中,发现毛状根有显著的增粗现象,且在生长侧根处变得粗大,呈圆球形,毛状根颜色呈浅黄色,与其他2组生长状况略有不同。
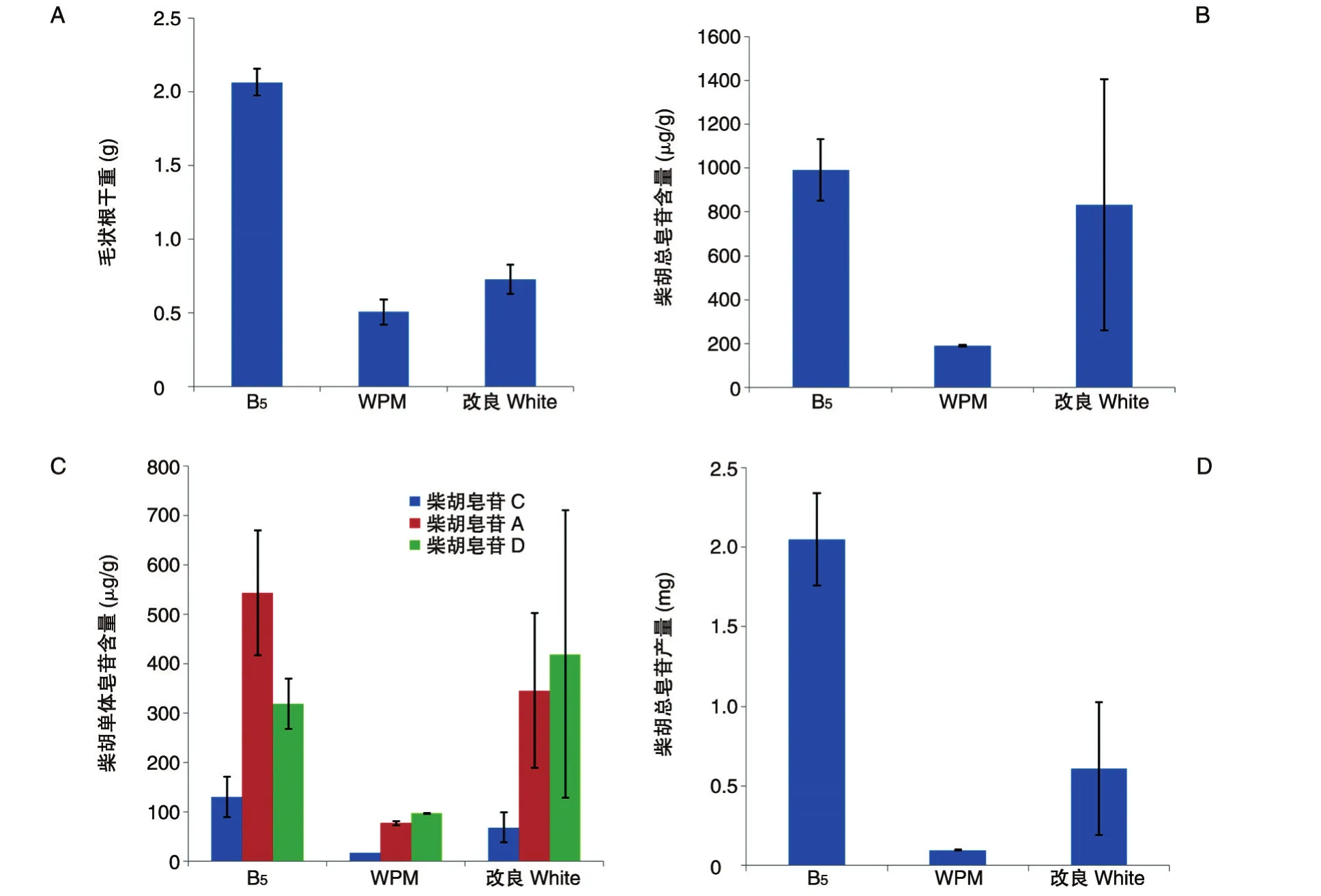
图1 3种基本培养基对北柴胡毛状根生长和皂苷含量的影响A:毛状根干重;B:柴胡总皂苷含量;C:柴胡单体皂苷含量;D:柴胡总皂苷产量
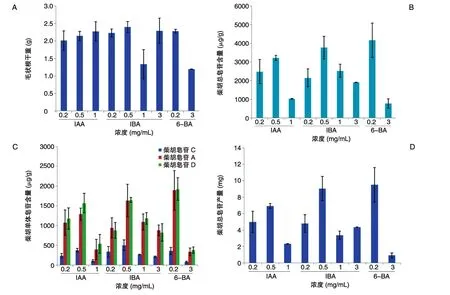
图2 IBA、IAA和6-BA对北柴胡毛状根生长和柴胡皂苷含量的影响A:毛状根干重;B:柴胡总皂苷含量;C:柴胡单体皂苷含量;D:柴胡总皂苷产量
外源激素处理对北柴胡毛状根皂苷合成和积累具有一定影响,不同激素处理组中皂苷含量存在较明显差异。通过测定,IBA、IAA和6-BA对北柴胡毛状根的柴胡皂苷合成均有促进作用。其中,IBA和6-BA处理组柴胡总皂苷含量明显高于IAA处理组(图2B),且6-BA对皂苷合成的影响略高于IBA。通过HPLC检测,6-BA浓度为0.2 mg/L时,柴胡皂苷C、A 和 D 的含量最高,分别为 357.76、1892.46和1924.37 μg/g;IBA 浓度为 0.5 mg/mL 时,柴胡皂苷C、A 和 D 的含量次之,分别为 498.15、1631.84和1644.52 μg/g(图2C)。激素处理组中柴胡总皂苷产量最高的是 6-BA(0.2 mg/L),产量为9.51 mg;IBA(0.5 mg/L)处理组略低,含量为9.05 mg(图2D)。2组处理的总皂苷含量较相近,但实验中发现6-BA(0.2 mg/L)处理组较不稳定,且后期毛状根大多数出现褐化现象,较IBA处理组更易衰老(图3)。因此,综合考虑既可以提高北柴胡毛状根的生产量,又可以增加毛状根中皂苷的积累,选定浓度为0.5 mg/mL的IBA为最适激素条件。
2.3 真菌诱导子对北柴胡毛状根生长和柴胡皂苷含量的影响
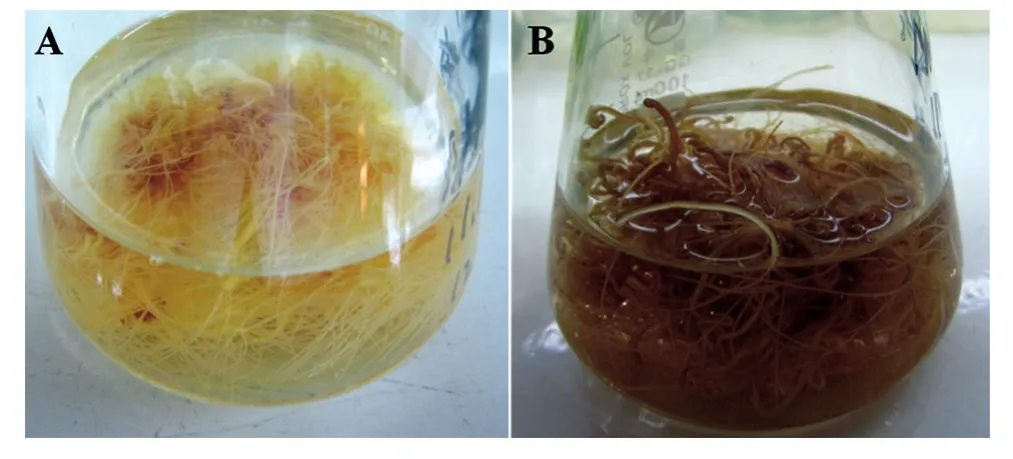
图3 IBA和6-BA对北柴胡毛状根生长的影响A:IBA(0.5 mg/mL)处理组毛状根生长状况;B:6-BA(0.2 mg/L)处理组毛状根生长状况
选用黑曲霉作为真菌诱导子,对北柴胡毛状根的生长没有促进作用,加入真菌诱导子1.0 mL时(图4A),真菌诱导子组毛状根产量最高,为1.15 g,比B5培养基处理组少0.91 g。这表明黑曲霉真菌诱导子对北柴胡毛状根生长存在一定的抑制作用。如图4B所示,HPLC测定毛状根中柴胡总皂苷含量结果,在真菌诱导子浓度为1.0 mL/mL时总皂苷含量最高,为898.09 μg/g,该处理组柴胡皂苷A、C和D的含量也均最高,分别为93.15、364.19和317.41 μg/g(图4C),比增值倍数相同的B5培养基总皂苷含量高30.76%。综合考虑,真菌诱导子对毛状根生长具有一定的抑制作用,但可以有效促进柴胡皂苷的合成。在相同接种量和培养时间下,真菌诱导子处理组比B5处理组总皂苷产量下降了47.8%(图4C、D)。因此,在柴胡毛状根大规模培养中,为得到更高的柴胡皂苷产量,不适合添加黑曲霉真菌诱导子。
综上所述,选定北柴胡毛状根培养条件为:添加0.5 mg/L IBA的B5液体培养基,毛状根产量和柴胡皂苷产量较高,毛状根干重为2.4 g,总皂苷产量为9.05 mg。
3 讨论

图4 黑曲霉真菌诱导子对北柴胡毛状根生长和柴胡皂苷含量的影响A:毛状根干重;B:柴胡总皂苷含量;C:柴胡单体皂苷含量;D:柴胡总皂苷产量
发根农杆菌诱导产生毛状根体系已在26科96种药用植物中得到研究[16]。但是,不同植物毛状根培养条件有很大差异,对于每种植物的培养方法没有固定模式可循,需要针对植株特性来摸索出最适宜的培养条件[17-20]。北柴胡毛状根培养条件优化还未见报道。本实验表明,在北柴胡毛状根液体振荡培养中,选择添加浓度0.5 mg/L IBA的B5培养基,毛状根产量和柴胡皂苷产量较好,毛状根干重为2.4 g,总皂苷产量为9.05 mg。
本实验表明,在北柴胡毛状根B5培养基中添加不同浓度的黑曲霉真菌诱导子,对毛状根生长有抑制作用,对总皂苷的合成有促进作用,但其抑制作用大于促进作用。这与刘俊等[21]报道的黑曲霉诱导子既对人参毛状根皂苷合成起促进作用,又可促进人参毛状根的生长不一致。体现出同样的真菌诱导子对不同植物毛状根的生长作用不同,但都能促进皂苷类成分合成[22-23]。因此,毛状根大规模生产中,对真菌诱导子的选择需要进行实验验证。
总之,我们通过改变培养基、外源激素和真菌诱导子等因素提高了北柴胡毛状根的产量和皂苷的含量,将为北柴胡毛状根大规模培养及活性成分的积累提供借鉴。
[1] Ashour M L,Wink M.Genus Bupleurum:a review of its phy⁃tochemistry,pharmacology and modes of action[J].J Pharmacy Pharmacol,2011,63:305-321.
[2]章佳赟.含柴胡的常用中成药中柴胡皂苷含量的测定及研究[D].上海:复旦大学,2010.
[3] Zheng Z L,Huang C H,Cao L,et al.Agrobacterium tumefa⁃ciens-mediated transformation as a tool for insertional muta⁃genesis in medicinal fungus Cordyceps militaris[J].Fungal Bi⁃ology,2011,115(3):265-274.
[4] Ziemienowicz A.Agrobacterium-mediated plant transformation:factors,applications and recent advances[J]. Biocatalysis Ag⁃ricul Biotechnol,2013,25:1-7.
[5] Lu H Y,Liu J M,Zhang H C,et al.Ri-mediated transforma⁃tion of Glycyrrhiza uralensis with a squalene synthase gene(GuSQS1)forproduction ofglycyrrhizin[J].PlantMolBiol Rep,2008,26(1):1-11.
[6] Wang Q J,Zheng L P,Yuan H Y,et al.Propagation of Sal⁃via miltiorrhiza from hairy root explants via somatic embryo⁃genesis and tanshinone content in obtained plants[J].Industri⁃al Crops Products,2013,50:648-653.
[7] Kai G Y,Xu H,Zhou C C,et al.Metabolic engineering tan⁃shinone biosynthetic pathway in Salvia miltiorrhiza hairy root cultures[J].Metab Eng,2011,13(3):319-327.
[8] Chen X,Zhang J,Liu J H,et al.Biotransformation of p-,m-,and o-hydroxybenzoic acids by Panax ginseng hairy root cultures[J].J Mol Catalysis B Enzymatic,2008,54(3-4):72-75.
[9] Park N I,Xu H,Li X H,et al.Overexpression of phenylala⁃nine ammonia-lyase improves flavones production in transgen⁃ic hairy root cultures of Scutellaria baicalensis[J].Process Bio⁃chem,2012,47(12):2575-2580.
[10]Zhai D D,Supaibulwatana K,Zhong J J.Inhibition of tumor cell proliferation and induction of apoptosis in human lung carcinoma 95-D cells by a new sesquiterpene from hairy root culturesofArtemisia annua[J].Phytomedicine,2010,17(11):856-861.
[11]田思迪,李云芳,张宗申,等.影响金铁锁毛状根生长及皂苷积累的因素[J].时珍国医国药,2012,23(4):824-826.
[12]Wang C Z,Ding J Y.Effects of different media and phytohor⁃mones on the growth and ginsenoside content of Panax quin⁃quefolium L.hairy root[J].J Plant Res Environ,2001,10(4):1-4.
[13]杨世海,刘晓峰,果德安,等.决明毛状根诱导及激素与诱导子对毛状根生长和蒽醌类化合物合成的影响[J].中草药,2005,36(5):752-756.
[14]晏琼,胡宗定,吴建勇.生物和非生物诱导子对丹参毛状根培养生产丹参酮的影响[J].中草药,2006,37(2):262-265.
[15]郑亭亭,隋春,魏建和,等.北柴胡二代新品种“中柴2号”和“中柴3号”的选育研究[J].中国中药杂志,2010,35(15):1931-1934.
[16]李亚璞,闫静辉.药用植物毛状根诱导及其培养技术研究[J].中国农村小康科技,2007,3:60-62.
[17]Hu Z B,Du M.Hairy root and its application in plant genet⁃ic engineering[J].J Integrative Plant Biol,2006,48(2):121-127.
[18]Veena V,Taylor C G.Agrobacteriun rhizogenes:recent devel⁃opment and promising applications[J].In Vitro Cell Dev Biol Plant,2007,43(5):383-403.
[19]Wang J W,Wu J Y.Effective elicitors and process strategies for enhancement of secondary metabolite production in hairy root cultures[J].Biotechnol Hairy Root Systems,2013,134:55-89.
[20]Sharafi A,Sohi H H,Mousavi A,et al.Enhanced morphinan alkaloid production in hairy root cultures of Papaver bractea⁃tum by over-expression of salutaridinol 7-o-acetyltransferase gene via Agrobacterium rhizogenes mediated transformation[J].World J Microbiol Biotechnol,2013,29(11):2125-2131.
[21]刘峻,丁家宜,周倩耘,等.真菌诱导子对人参毛状根皂苷生物合成和生长的影响[J].中国中药杂志,2004,29(4):302-305.
[22]Ludwig-Muller J,Jahn L,Lippert A,et al.Improvement of hairy root cultures and plants by changing biosynthetic path⁃ways leading to pharmaceutical metabolites:strategies and ap⁃plications[J].Biotechnol Adv,2014,31:1-12.
[23]Pitta-Alvarez S I,Spollansky T C,Giulietti A M.The influ⁃ence of different biotic and abiotic elicitors on the production and profile of tropane alkaloids in hairy root cultures of Brug⁃mansia candida[J].Enzyme Microbial Technol,2000,26(2-4):252-258.
