16S核糖体DNA宏基因组测序中细菌核酸提取方法的比较研究
2015-05-04王伟王玉琢舒鹏米志强安小平裴广倩刘文丽袁文俊史套兴童贻刚
王伟,王玉琢,舒鹏,米志强,安小平,裴广倩,刘文丽,袁文俊,史套兴,童贻刚
1.安徽医科大学,安徽 合肥 230032;2.军事医学科学院 微生物流行病研究所,北京 100071;
3.宁夏医科大学,宁夏 银川 750000
人和动物胃肠道内存在大量微生物,它们与宿主的生理功能密切相关,这些微生物群落之间及微生物与动物宿主之间形成了相互依存、相互作用的不可分割的整体。传统的微生物学研究方法主要是对微生物进行培养和分离。到目前为止,绝大多数微生物(99%以上)无法依靠培养的方式获得[1],这极大地限制了人们对微生物的研究。
近年来,随着高通量测序技术的应用[2-3],宏基因组学发展迅速[4],为我们了解环境和人体自身微生物种群提供了新的途径和视野。宏基因组学与传统微生物研究方式的最大区别在于把微生物看成一个整体,摆脱了对单个微生物的培养和分离步骤,直接对环境中所有的微生物进行研究,进而可以全面地对所有微生物进行分析。随着宏基因组学的兴起和发展,人们对人体的肠道、口腔、皮肤组织等中的微生物种群进行了研究[5],发现了多种新的细菌,了解了这些细菌和人体健康之间的关系。
然而,从最初的细菌核酸提取到后期的数据分析,仍然有较多技术性和科学性问题制约着宏基因组学特别是16S核糖体DNA(ribosomal DNA,rDNA)宏基因组学的发展。如细菌核酸的提取[6]、扩增高变区的选择、通用引物的选择[7]、测序平台的选择以及后期数据分析策略的选择,都会对宏基因组测序的结果产生影响。对于来自环境中的复杂样本,细菌核酸提取的效率和质量至关重要,是后续扩增、测序和分析的基础。目前细菌核酸提取的方法有很多种,原理和操作步骤各不相同,各有优缺点[8-10]。在此,我们采用TRIzol法、试剂盒法,以及在试剂盒法基础上进行5种改进,共7种方法对模拟样本进行核酸提取,并特异性地扩增16S rDNA的V1~V2高变区,之后构建测序文库,分析测序结果中16S rDNA的分布,还原模拟样本中各种细菌的含量和相对分布,寻找一种广谱、高效的细菌核酸提取方法。
1 材料和方法
1.1 材料
选取10种在微生物学与分子生物学特征上具有显著差异的细菌,包括革兰阳性和阴性菌,分别是金黄色葡萄球菌(Staphylococcus aureus)、弗氏柠檬酸杆菌(Citrobacter freundii)、肺炎克雷伯菌(Klebsi⁃ella pneumoniae)、奇异变形杆菌(Proteus mirabilis)、肠道沙门菌(Salmonella enterica)、蜡样芽孢杆菌(Bacillus cereus)、摩氏摩根菌(Morganella morga⁃nii)、海藻希瓦菌(Shewanella algae)、宋内志贺菌(Shigella sonei)、粘质沙雷菌(Serratia marcescens)。以上菌种均分离自解放军307医院检验科。
TRIzol(Thermo Fisher Scientific);Roche High PurePCR TemplatePreparationKitVersion 2.0(Roche);溶葡萄球菌酶、溶菌酶(Sigma);DNA Marker(北京全式金公司);Q5 High-Fidelity 2×Master Mix、Fast DNA Library Prep Set for Ion Torrent(New England Biolabs);QIAquick Gel Ex⁃traction Kit(QIGEN)。
PCR 仪(Gene Amp PCR System 9700);Ion torrent测序仪(Thermo Fisher Scientific);NanoDrop system;超声波仪(南京新辰生物公司)。
1.2 细菌培养
将上述菌株分别接种于LB固体培养基上,37℃培养18 h,挑取单克隆菌落接种于LB液体培养基中,37℃、150 r/min振荡培养至对数后期或稳定期后于4℃保存。
1.3 菌种鉴定
分别取以上经液体培养基培养后的菌液500 μL于1.5 mL离心管中,沸水浴10 min后作为16S rDNA PCR鉴定模板。上游引物为27F(5'-AGAGT TTGATCCTGGCTCAG-3'),下游引物为 1492R(5'-TACGACTTAACCCCAATCGC-3'),产 物 1.4kb。PCR 体系:上、下游引物各2 μL,Q5 High-Fidelity 2× Master Mix 25 μL,DNA 模板 2 μL,用无菌ddH2O补足50 μL。PCR条件:预变性95℃ 5 min;变性95℃ 30 s,退火55℃ 30 s,延伸72℃ 1 min(30个循环);延伸7 min。PCR扩增产物经3730测序,进行菌种鉴定。
1.4 细菌铺板计数和等比例混合
将菌液稀释至1/106、1/107、1/108共3个梯度后进行涂布平板计数,根据细菌数将10种菌等量混合于1.5 mL EP管中,12 000 r/min离心3 min,弃上清,用PBS洗涤2次后收集细菌。
1.5 细菌DNA的提取
1.5.1 TRIzol提 取 向 混 合 细 菌 中 加 入1 mL TRIzol后用移液器反复吹打,室温静置15 min,加入0.2 mL氯仿充分振荡混匀,室温静置3 min,4℃、10 000 r/min离心10 min,弃上层水相,保留中间相与下层有机相,向中间相及有机相加入0.3 mL无水乙醇,上下颠倒混匀,室温放置30 min,4℃、2000 r/min离心5 min,弃上清,用1 mL 0.1 mol/L柠檬酸钠溶液(10%乙醇)洗涤沉淀,室温放置30 min,期间振荡数次,4℃、2000 r/min离心5 min,弃上清,用1.5 mL 75%乙醇洗涤DNA沉淀,室温放置30 min,期间振荡数次,4℃、2000 r/min离心5 min,弃上清后充分晾干DNA沉淀,加入50 μL 8 mmol/L NaOH溶液溶解DNA沉淀,-20℃保存。
1.5.2 试剂盒直接提取 按照Roche High Pure PCR Template Preparation Kit Version 2.0 中 Isola⁃tion of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.5.3 溶葡酶处理后试剂盒提取 向混合细菌中加入溶葡酶(终浓度 1 mg/mL)20 μL,按照 Roche High Pure PCR Template Preparation Kit Version 2.0中Isolation of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.5.4 超声波处理后试剂盒提取 将混合细菌置于冰水浴中,间歇超声波处理(超声2 s,间隙5 s,功率20%,总时 5 min),按照 Roche High Pure PCR TemplatePreparation KitVersion 2.0 中 Isolation of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.5.5 超声波处理并加溶葡酶处理后试剂盒提取
将混合细菌置于冰水浴中,间歇超声波处理(超声2 s,间隙5 s,功率20%,总时5 min),加溶葡酶(终浓度 1 mg/mL)20 μL,按照Roche High Pure PCR TemplatePreparation KitVersion 2.0 中 Isolation of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.5.6 匀浆处理后试剂盒提取 将混合细菌匀浆处理(30 Hz,5 min),按照 Roche High Pure PCR TemplatePreparation KitVersion 2.0 中 Isolation of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.5.7 匀浆处理并加溶葡酶处理后试剂盒提取 将混合细菌匀浆处理(30 Hz,5 min),加入溶葡酶(终浓度 1 mg/mL)20 μL,按照Roche High Pure PCR TemplatePreparation KitVersion 2.0 中 Isolation of Nucleic Acids form Bacteria方案提取细菌DNA,于-20℃保存。
1.6 细菌基因组DNA分析
提取后的产物用NanoDrop system检测DNA的浓度和纯度,1%琼脂糖凝胶电泳分析混合细菌基因组DNA的完整性。
1.7 扩增细菌16S rDNA的V1~V2高变区
用通用引物[11]扩增细菌16S rDNA的V1、V2高变区,上游引物为27F(5'-AGRGTTYGATYMTGGC TCAG-3'),下游引物为338R(5'-TGCTGCCTCCCG TAGGAGT-3')。PCR体系:上、下游引物各2 μL,Q5 High-Fidelity 2× Master Mix 25 μL,DNA模板2 μL,用无菌ddH2O补至50 μL。PCR条件:预变性95℃ 5 min;变性 95℃ 30 s,退火 55℃ 30 s,延伸72℃ 30 s(30个循环);延伸7 min。2%琼脂糖凝胶电泳回收目的条带,用QIAquick Gel Extraction Kit纯化。
1.8 测序文库的构建及高通量测序
投入100 ng扩增产物,参照Fast DNA Library Prep Set for Ion Torrent说明书,构建高通量测序文库约400 bp,之后进行PGM测序。
1.9 生物信息学分析
用 NGS QC Toolkit v2.3.3(参 数 :-l 70-s 20-n 8-m 100-c 8)[12]去除低质量及低复杂度序列,依据样品前加的标签序列,用python脚本将7种方法的数据进行分割提取,再用CLC Genomics Workbench v3.6.1(丹麦 CLC Inc,http://www.clcbio.com)将数据比对前期细菌鉴定的16S rDNA全长序列,用MEGA(v.6.0.5)软件[13]构建细菌16S rDNA进化树。
2 结果
2.1 混合样本的细菌组成
本次实验共挑选了10种细菌,这10种菌在微生物学与分子生物学特征上具有显著差异,包括革兰阳性菌和革兰阴性菌。细菌基因组16S rDNA拷贝数为 5~14,16S rDNA 鉴定长度为 1439~1470 bp,16S rDNA GC 含 量 为 51.00% ~55.20% ,扩 增 的V1~V2高变区长度为310 bp,V1~V2的GC含量为51.3%~57.6%,通用引物与细菌16S rDNA的匹配性较好(表1)。
从细菌16S rDNA进化树(图1)可以看出10种菌的进化距离较远,差异较为明显,有利于后续测序数据不同细菌的分类。
2.2 不同方法提取的细菌DNA含量与纯度分析
用不同提取方法得到的细菌DNA含量与纯度不同(表2),TRIzol法提取的细菌DNA含量最高,匀浆处理后试剂盒提取的细菌DNA含量次之;超声波处理后试剂盒提取和匀浆加溶葡酶处理后试剂盒提取的细菌DNA纯度最高,超声波加溶葡酶后试剂盒提取的次之。
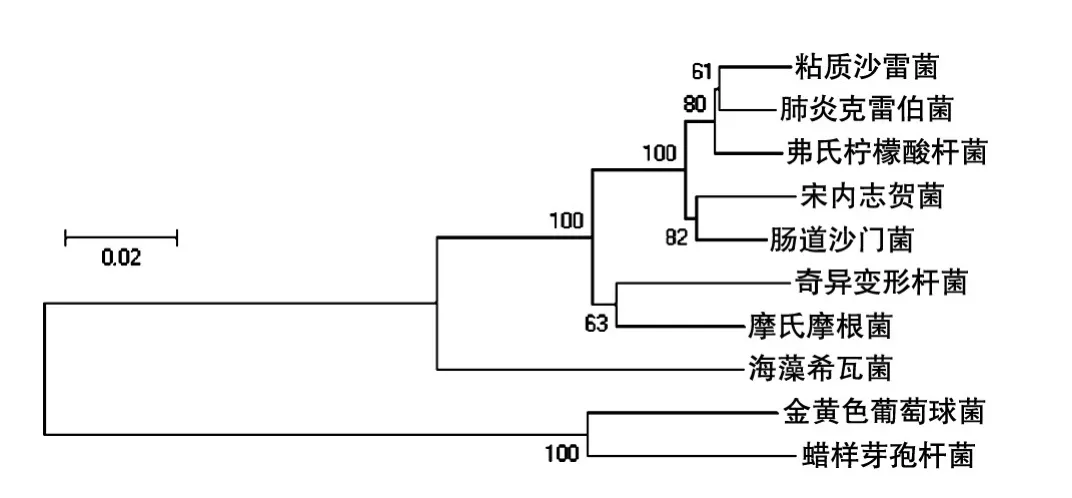
图1 实验所用细菌16S rDNA进化树
2.3 不同方法提取的细菌DNA完整性分析
2%琼脂糖凝胶电泳分析表明,试剂盒提取及超声波结合试剂盒提取的模拟样品细菌DNA具有较好的完整性(图2);TRIzol提取、溶葡酶加试剂盒提取、超声波加溶葡酶加试剂盒提取、匀浆加试剂盒提取及匀浆加溶葡酶加试剂盒提取的模拟样品细菌DNA分子出现了显著的弥散,表明DNA分子产生了断裂,完整性差。
2.4 不同方法的高通量测序结果分析
尽管7种方法中10种细菌是等比例等量投入的,但测序结果差别很大(表3),在TRIzol法和超声波加试剂盒法数据中,前三位细菌相同,分别为蜡样芽孢杆菌、肺炎克雷伯菌和弗氏柠檬酸杆菌;在TRIzol法、试剂盒法、超声波加试剂盒法和匀浆加试剂盒法数据中,含量最低的3种菌为海藻希瓦菌、奇异变形杆菌和金黄色葡萄球菌;而在溶葡酶加试剂盒法、超声波加溶葡酶加试剂盒、匀浆加溶葡酶加试剂盒法中,含量最低的2种菌也是海藻希瓦菌和奇异变形杆菌。在溶葡酶加试剂盒法、超声波加溶葡酶加试剂盒法、匀浆加溶葡酶加试剂盒法数据中,金黄色葡萄球菌的数据量明显高于其他4种提取法。蜡样芽孢杆菌、金黄色葡萄球菌和奇异变形杆菌基因组16S rDNA拷贝数分别为14、5、5,在TRIzol法、超声波加试剂盒法、匀浆加试剂盒法数据中,蜡样芽孢杆菌数据比重要高于金黄色葡萄球菌和奇异变形杆菌,表明细菌16S rDNA拷贝数对于宏基因组检测有影响。弗氏柠檬酸杆菌和肠道沙门菌基因组16S rDNA拷贝数都为9次,通用引物27F与弗氏柠檬酸杆菌和肠道沙门菌的匹配性分别为20/0、16/4,在匀浆加溶葡酶加试剂盒法数据中,弗氏柠檬酸杆菌的数据比重高于肠道沙门菌,表明通用引物与细菌16S rDNA匹配性对于宏基因组检测有影响。
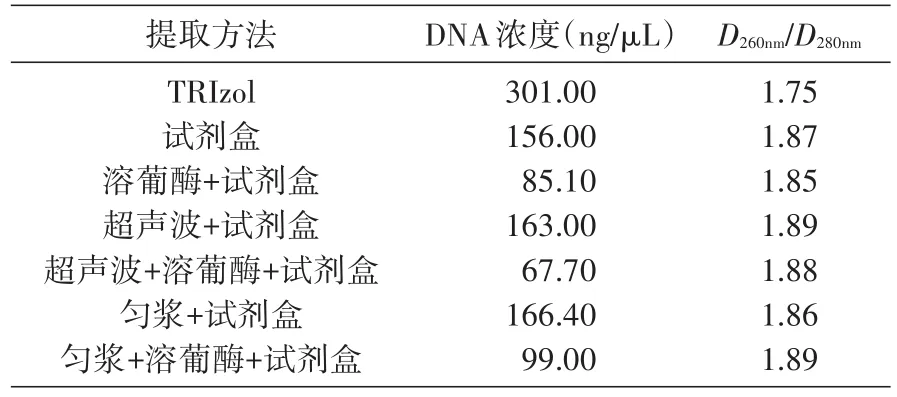
表2 不同提取方法所得细菌DNA含量和纯度测定结果
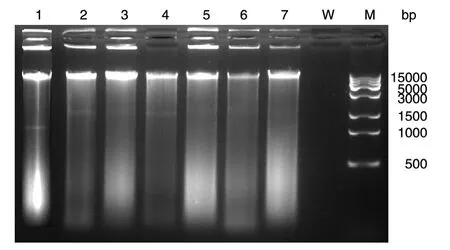
图2 不同提取方法和前处理方法提取细菌DNA电泳分析1:TRIzol提取产物;2:试剂盒提取产物;3:溶葡酶加试剂盒提取产物;4:超声波加试剂盒提取产物;5:超声波加溶葡酶加试剂盒提取产物;6:匀浆加试剂盒提取产物;7:匀浆加溶葡酶加试剂盒提取产物;W:水;M:DNA marker
对7组数据中10种菌的相对分布进行统计和计算,绘制柱形图(图3),可以直观地观察到超声波加试剂盒提取方法中各种菌的数据分布相对均匀。
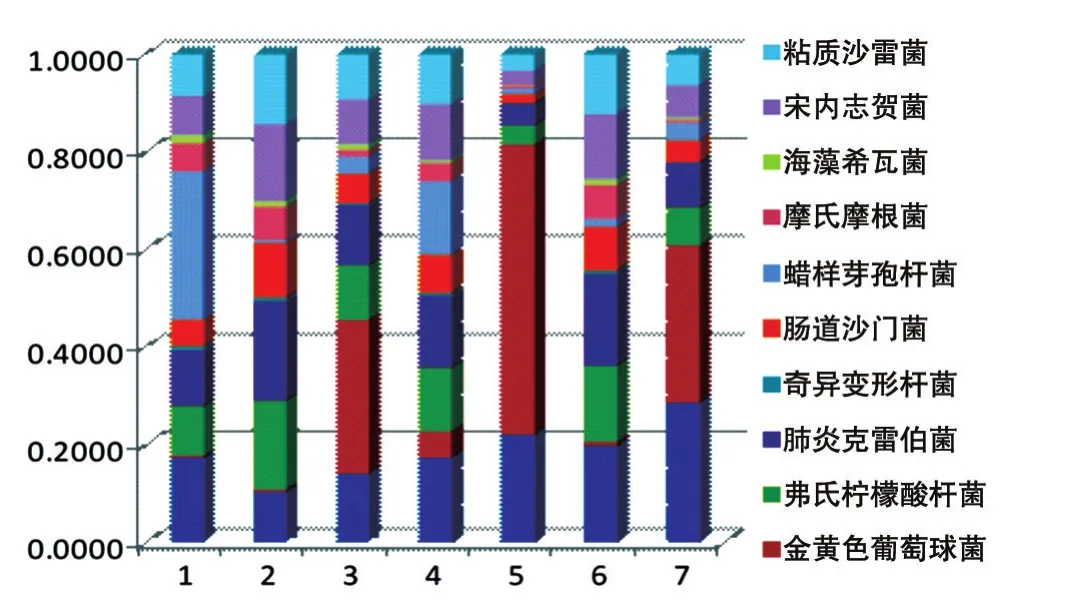
图3 不同方法中各种细菌数据量的相对分布
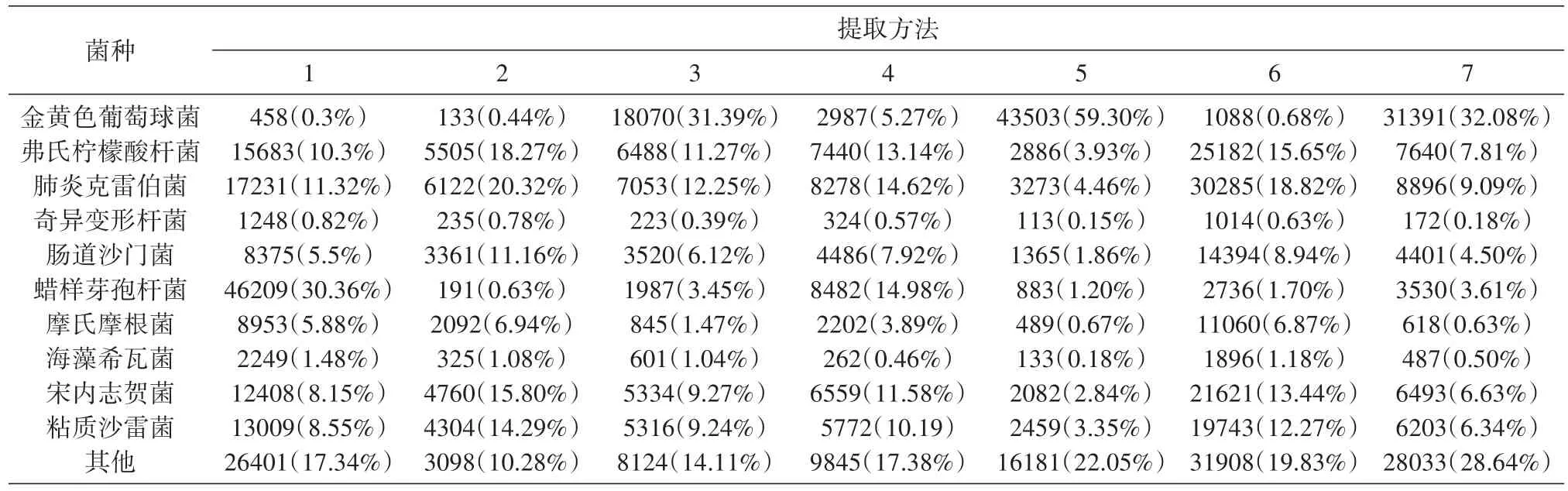
表3 不同方法测序结果中比对上不同细菌的序列条数分布
3 讨论
目前,基于16S rDNA测序的宏基因组学发展迅速。尽管此技术在探索各种环境样本中细菌物种的多样性方面具有无可比拟的优势,但也存在技术上的不足和缺陷,如在样本的收集和保存、核酸的提取、扩增使用的引物、测序平台的选择等方面的不足,进而直接导致实验结果不能真实地反映细菌物种的多样性。本次实验在排除其他影响因素的情况下,探究了细菌DNA提取方法对于16S rDNA测序的影响。结果表明,不同的前处理及提取方法对于细菌DNA的提取影响显著,在同一方法中,不同细菌的提取效果差别很大,对同一种细菌使用不同方法提取的效果差别也很大。在加入溶葡酶的3种方法中,金黄色葡萄球菌的数据量远高于另外4种不加溶葡酶的方法,说明溶葡酶处理对于样本中金黄色葡萄球菌的检测至关重要。同时实验结果显示细菌16S rDNA拷贝数及通用引物与细菌16S rDNA的匹配性对于宏基因组检测也有影响。在超声波加试剂盒提取测序数据中,各种细菌的数据量分布相对均匀,表明对各种细菌的提取效果较好,亦即超声波处理能够改善试剂盒的提取效果。在其他几种提取方法中,各种细菌的数据量差别很大,无明显的规律可循。
对于来自环境中的真实样本,其复杂度远远高于本实验所用的模拟样本。真实样本往往含有更多种类的细菌、不同的化学组分,以及来自其他有机体的细胞和DNA成分,在宏基因组学研究中应当考虑到这些因素。此次实验探索寻找广谱高效的细菌DNA提取方法,提高了宏基因组学测序技术反映真实环境样品中物种多样性的能力。
[1] Kaeberlein T,Lewis K,Epstein S S.Isolating"uncultivable"microorganisms in pure culture in a simulated natural environ⁃ment[J].Science,2002,296(5570):1127-1129.
[2] Mardis E R.Next-generation DNA sequencing methods[J].An⁃nu Rev Genomics Hum Genet,2008,9:387-402.
[3] von Bubnoff A.Next-generation sequencing:the race is on[J].Cell,2008,132(5):721-723.
[4] Handelsman J,Rondon M R,Brady S F,et al.Molecular bio⁃logical access to the chemistry of unknown soil microbes:a new frontier for natural products[J].Chem Biol,1998,5(10):R245-R249.
[5] Qin J,Li R,Raes J,et al.A human gut microbial gene cata⁃logue established by metagenomic sequencing[J].Nature,2010,464(7285):59-65.
[6] Salonen A,Nikkil J,Jalanka-Tuovinen J,et al.Comparative analysis of fecal DNA extraction methods with phylogenetic microarray:effective recovery of bacterial and archaeal DNA using mechanical cell lysis[J].J Microbiol Methods,2010,81(2):127-134.
[7] Hong S,Bunge J,Leslin C,et al.Polymerase chain reaction primersmisshalfofrRNA microbialdiversity[J].ISME J,2009,3(12):1365-1373.
[8] Zhou J,Bruns M A,Tiedje J M.DNA recovery from soils of diverse composition[J].ApplEnviron Microbiol,1996,62(2):316-322.
[9] Lffler J,Hebart H,Schumacher U,et al.Comparison of dif⁃ferentmethodsforextraction ofDNA offungalpathogens from cultures and blood[J].J Clin Microbiol,1997,35(12):3311-3312.
[10]Yen T,Six D L,Burke E J.Evaluation of rapid DNA extrac⁃tion and identification of Phellinus pini associated with Pinus contorta by rDNA assay[J].Forest Products J,2006,56(11/12):107.
[11]Wu G D,Lewis J D,Hoffmann C,et al.Sampling and pyro⁃sequencing methodsforcharacterizingbacterialcommunities in the human gut using 16S sequence tags[J].BMC Microbi⁃ol,2010,10(1):206.
[12]Patel R K,Jain M.NGS QC Toolkit:a toolkit for quality control of next generation sequencing data[J].PloS One,2012,7(2):e30619.
[13]Tamura K,Stecher G,Peterson D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
