重组人B7-H1 IgV疫苗的初步毒理学研究
2015-05-04曹正聪张存吴守振张旺倩张英起张伟
曹正聪,张存,吴守振,张旺倩,张英起,张伟
1.肿瘤生物学国家重点实验室;
2.第四军医大学 a.药学系生物制药学教研室;b.学员一旅四营十四连;陕西 西安 710032
B7-H1是共刺激分子B7家族成员,在正常组织中几乎不表达,但在多种肿瘤组织中高表达,并且与肿瘤的进展程度相关[1-3]。在外周组织,肿瘤细胞表面的B7-H1能诱导肿瘤特异性CTL凋亡,从而抑制机体对肿瘤的免疫反应;而在淋巴器官内,抗原呈递细胞表面的B7-H1与初始T淋巴细胞相互作用诱导T淋巴细胞的无能[4-5]。因此,理论上,B7-H1既可以作为一种肿瘤抗原,又是参与肿瘤免疫逃逸的重要分子;阻断B7-H1,既能直接抑制肿瘤的生长,又能抑制肿瘤的免疫逃避,提高初始T细胞的激活能力和CTL杀伤活性,从而提高其他抗原的免疫反应[6]。
我们课题组一直致力于B7-H1阻断剂的研究,前期用基因工程方法表达并纯化了重组人B7-H1(rhB7-H1)IgV融合蛋白疫苗,已经完成了工程菌菌种的鉴定和中试发酵纯化工艺;相关的动物实验结果也表明该疫苗能够有效抑制B7-H1阳性的肿瘤的生长,并且能够延长荷瘤动物的生存期[7-10]。
为了进行系统的临床前研究,我们对疫苗进行了初步毒理学研究。我们采用与之前实验相同工艺制备的rhB7-H1 IgV疫苗、一致的实验动物(BALB/c小鼠)和免疫流程,考察了疫苗的安全性。分别观察了各组疫苗免疫组小鼠的进食、体重等一般状况,血液学和血清生化学指标,重要脏器组织的大体病理学、组织病理学情况及相对重量,CD4+/CD8+T细胞百分率和比值。
1 材料与方法
1.1 材料
BALB/c小鼠(雌性,15~18 g)购自第四军医大学实验动物中心;FITC-CD4、PE-CD8单克隆抗体及相应的同型对照购自Biolend公司;酵母抽提物为Oxide公司产品;Tris base为Promega公司产品;IPTG为Solon公司产品;TEMED购于Bio-Rad公司;咪唑购于北京鼎国生物公司;丙烯酰胺、N,N'-二甲基双丙烯酰胺、SDS、过硫酸铵、氯化钙、甘油等均为国产分析纯试剂。
1.2 小鼠的分组与免疫
30只BALB/c小鼠按体重随机分为3组,每组10只,分别为生理盐水对照组、佐剂对照组(氢氧化铝佐剂)、B7-H1组(B7-H1+氢氧化铝佐剂)。免疫方法及流程见参考文献[9]。
1.3 小鼠的一般情况监测
入组时各组小鼠体重一致,无统计学差异。于第0、2、4、6、8、10周分别称量体重一次,观察各免疫组小鼠体重是否有变化。在饲养过程中,观察小鼠的进食、毛色、活动等生活状态。
1.4 临床病理学检查
包括血液学和血清生化学检查。免疫4次后2周于小鼠眼球取血,取血前禁食过夜。血液学检查用血用EDTA抗凝后,采用ADVIA 120血液学检查系统进行检测;血清生化学检查用血直接分离血清,采用全自动生化分析仪进行测定。
1.5 组织病理学检查
免疫4次后2周,对各组小鼠采血、放血,剖检动物,对心、肝、脾、肺、肾、脑、胸腺等主要组织、脏器和免疫系统相关组织器官进行大体病理学检查并称重;同时,保存并固定指定的组织脏器,进行组织病理学检查。
1.6 小鼠脾CD4+和CD8+T细胞计数
从制备好的脾细胞中取1×106细胞,用约1 mL FACS洗液洗涤,1500 r/min离心5 min,弃上清,轻弹管底混匀细胞,加入40 μL FACS洗液重悬细胞;将FITC-CD4、PE-CD8单克隆抗体各1 μL加入8 μL FACS洗液中,将抗体溶液加入40 μL上述脾细胞悬液中,冰上避光作用30 min;加1 mL FACS洗液,3000 r/min离心5 min洗涤,弃上清;加500 μL FACS洗液重悬,经200目尼龙网滤至圆底流式测定管中,于4℃储存或直接上FACS Callibur流式细胞仪检测,统计分析CD4+和CD8+T细胞占淋巴细胞的比例,并计算二者的比值。
1.7 统计学分析
数据用SPSS软件分析,采用Dunnett's test进行显著性检验。
2 结果
2.1 小鼠的一般情况监测结果
3个组别30只动物,从免疫开始至恢复期结束,无严重的动物争斗、撕咬及死亡,极少数动物因争斗有轻微外伤但很快恢复。各组摄食量在给药期间和恢复期基本无显著差异;其他动物临床表现无异常。各组在整个免疫期间体重基本保持增长趋势(图1);B7-H1组、佐剂对照组与生理盐水对照组的小鼠体重无明显差异(表1)。
2.2 临床病理学检查
免疫4次后取血,血清生化学分析结果表明,B7-H1组谷丙转氨酶(ALT)水平和血糖(GLU)水平(P<0.05)与生理盐水对照组比较稍有升高;氢氧化铝佐剂组的白蛋白(ALB)水平明显低于生理盐水对照组(P<0.01);上述变化值均在该种鼠动物的正常值范围内;其他各项血清生化指标与生理盐水对照组比较基本无显著差异。结果见表2。
免疫4次后,B7-H1组与佐剂组的白细胞(WBC)水平与生理盐水对照组比较无显著性差异,说明小鼠饲养规范,无感染;B7-H1组的淋巴细胞数及淋巴细胞百分比与生理盐水对照组比较稍有降低(P<0.05),但上述变化在该种鼠动物的正常值范围内;其他各项指标未见明显异常。结果见表3。
图1 BALB/c小鼠免疫期间体重的变化
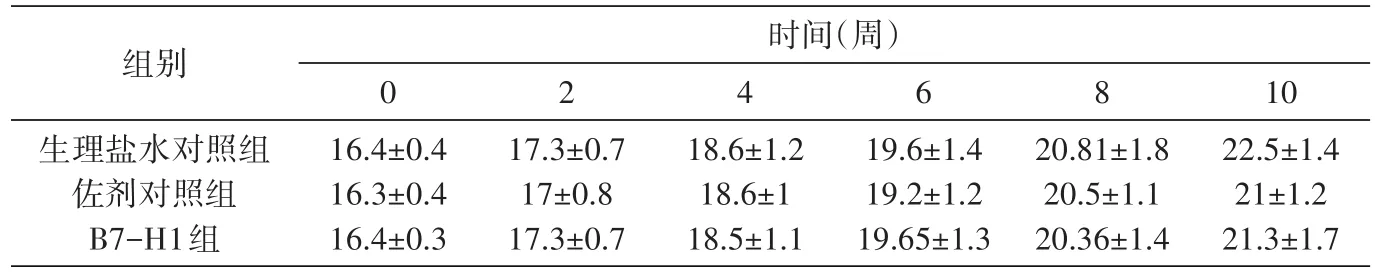
表1 BALB/c小鼠免疫期间体重的变化(g,x±s,n=8)
2.3 组织病理学检查结果
免疫4次后,解剖小鼠,取出心、肝、脾、肺、肾、脑、胸腺各脏器,肉眼观察各组无明显形态、大小的差异和异常。各脏器称重结果显示,佐剂对照组小鼠的脾脏相对重量与生理盐水对照组比较降低(P<0.05);其他各组各脏器相对重量与生理盐水对照组比较均无显著差异。结果见表4。将各组小鼠的心、肝、脾、肺、肾、脑、胸腺脏器用福尔马林固定,石蜡包埋,切片,HE染色观察分析,结果显示,4次免疫后,各免疫组小鼠脏器与对照组相比,没有出现明显的组织病理学病变(图2)。
2.4 小鼠脾CD4+和CD8+T细胞计数结果
免疫4次后,各组小鼠取取脾检测CD4+和CD8+T细胞百分率,结果表明,单纯佐剂组和B7-H1组与生理盐水对照组相比,CD4+T细胞细胞百分率及两者比例均有所增高;尤其是B7-H1组CD4+T细胞百分率显著增高(P<0.01),可能均诱导产生了不同程度的炎性免疫反应(表5)。
3 讨论
疫苗可分为传统疫苗和新型疫苗。传统疫苗包括减毒活疫苗和灭活疫苗,多采用病毒微生物及其代谢产物,经人工减毒、脱毒、灭活等方法制成[11]。由于制作工艺的限制,在保存、使用和接种副反应等方面都容易出现问题。新型疫苗是利用现代生物工程技术,包括单克隆抗体技术、基因工程技术和生物合成技术等研制的抗独特型抗体疫苗、基因工程疫苗和合成多肽疫苗等,其中基因工程疫苗占主导地位[12]。疫苗具有独特的、多样的结构及生物活性,有种属特异性、免疫原性、不可预测的多效性。在理论上,疫苗可能导致的毒性反应主要包括制品成分本身作为毒性物质对机体的直接损伤、诱导免疫系统引起的与免疫相关的毒性、污染物和残余杂质引起的毒性。由于疫苗通过诱导免疫系统产生抗体及/或效应T细胞发挥作用,其最主要的潜在毒性来自与免疫系统相关的毒性,主要包括免疫抑制、免疫刺激、超敏反应、自身免疫[13]。

表2 BALB/c小鼠免疫4次后2周血清生化指标的变化(x±s)

表3 BALB/c小鼠免疫4次后2周血液学指标的变化(x±s)
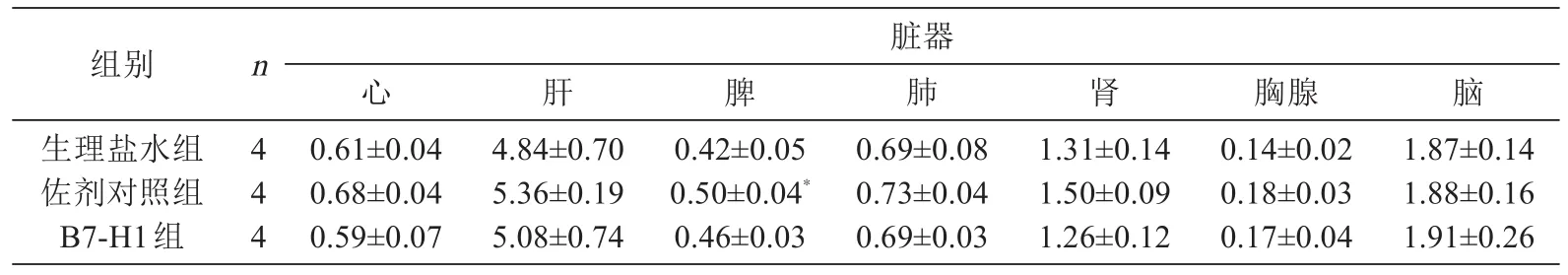
表4 BALB/c小鼠免疫4次后2周脏器相对重量的变化(g/100 g体重,x±s)

图2 各组重要脏器的HE染色结果

表5 BALB/c小鼠免疫4次后2周CD4+、CD8+T淋巴细胞数量及比例的变化(x±s)
本研究中,我们针对重组人B7-H1 IgV疫苗的特点设计独特的毒理学研究方案,充分考虑了佐剂的影响。在一般毒理学指标方面,除个别血液学指标外,疫苗及其所使用的氢氧化铝佐剂对一般毒理学指标未见显著性影响。在免疫毒理方面,疫苗免疫过程中,会引起CD4+T淋巴细胞的升高而CD8+T细胞则无明显波动,这一方面提示B7-H1疫苗可能确实诱导了高滴度的体液免疫反应但未引起有效的细胞免疫反应,与我们之前的结果一致;另一方面由于佐剂也诱导了CD4+T淋巴细胞的升高,所以也有一部分是由于诱导了炎性免疫反应。但从总体上看,疫苗对T淋巴细胞相对数量和比例的影响不大,没有出现比例倒置等现象。总之,该研究对我们课题组进一步设计系统的重组人B7-H1 IgV疫苗的临床前实验提供了重要的参考依据。
[1] Dong H,Zhu G,Tamada K,et al.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and inter⁃leukin-10 secretion[J].Nat Med,1999,5(12):1365-1369.
[2] Dong H,Chen L.B7-H1 pathway and its role in the evasion of tumor immunity[J].J Mol Med(Berl),2003,81(5):281-287.
[3] Thompson R H,Kuntz S M,Leibovich B C,et al.Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J].Cancer Res,2006,66(7):3381-3385.
[4] Iwai Y,Ishida M,Tanaka Y,et al.Involvement of PD-L1 on tumor cells in the escape from host immune system and tu⁃mor immunotherapy by PD-L1 blockade[J].Proc Natl Acad Sci USA,2002,99(19):12293-12297.
[5] Blank C,Brown I,Peterson A C,et al.PD-L1/B7H-1 inhib⁃its the effector phase of tumor rejection by T cell receptor transgenic CD8+T cells[J].Cancer Res,2004,64(3):1140-1145.
[6] Hasan A,Ghebeh H,Lehe C,et al.Therapeutic targeting of B7-H1 in breast cancer[J].Expert Opin Ther Targets,2011,15(10):1211-1225.
[7] 王伟华,张英起,颜真.重组B7-H1 IgV融合蛋白的表达、纯化及活性鉴定[J].中国生物制品学杂志,2007,20(1):9-14.
[8] Zhang C,Wang W,Qin X,et al.B7-H1 protein vaccine in⁃duces protective and therapeutic antitumor responses in SP2/0 myeloma-bearing mice[J].Oncol Rep,2013,30(5):2442-2448.
[9] 陈霖,李晶,侯建伟,等.重组人B7-H1 lgV发酵纯化工艺的建立及其抑瘤活性[J].中国生物制品学杂志,2010,23(6):594-597.
[10]陈霖,李伯安,毛远丽,等.重组人B7-H1 lgV工程菌生物学特性的稳定性[J].中国生物制品学杂志,2012,25(3):273-275.
[11]寇毅.略述疫苗三次革命[J].中华医史杂志,2006,36(2):104-108.
[12]王锦平,吕红线,张伟.新型疫苗研究进展[J].食品与药品,2005,7(6a):11-14.
[13]Brennan F R,Dougan G.Non-clinical safety evaluation of novel vaccines and adjuvants:new products,new strategies[J].Vaccine,2005,23(24):3210-3222.
