帕金森病伴发不宁腿综合征的临床症状研究
2015-04-28朴英善陈泽颉左丽君余舒扬连腾宏
朴英善,陈泽颉,左丽君,余舒扬,扈 杨,王 方,杜 阳,连腾宏,
余秋瑾2,王瑞丹2,张 巍1,2,3,4,5*
(首都医科大学附属北京天坛医院:1老年病科,2神经内科,北京 100050;3国家神经系统疾病临床医学研究中心,北京 100050;4北京脑重大疾病研究院帕金森病研究所,5北京帕金森病重点实验室,北京 100053)
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病,主要表现为运动迟缓、静止性震颤、肌强直和姿势步态异常等。近年来,随着病理学研究的进展,PD的诸多非运动症状(non-motor symptoms,NMS)日益受到关注,包括嗅觉障碍、抑郁、焦虑、认知障碍和便秘等[1]。不宁腿综合征(restless legs syndrome,RLS)是PD患者常见的NMS,也是导致患者生活质量下降的重要因素之一。然而,目前对PD伴发RLS的重视不够,相关研究匮乏[2,3]。本文主要研究PD伴发RLS的临床症状,为认识PD伴发RLS的临床特点和早期诊断及治疗提供依据。
1 对象与方法
1.1 研究对象
连续收集2012年2月至2014年12月就诊于北京天坛医院神经内科和老年病科的PD患者165例为研究对象。其中男性患者90例,女性患者75例。年龄41~85岁(61.19±9.12)岁,病程(3.35±3.09)年;小学及以下、中学、大专及以上文化程度患者数分别为49例(30.06%)、88例(53.99%)和26例(15.95%)。
PD诊断标准:符合1992年英国帕金森病脑库制定的原发性PD诊断标准[4]。必须存在运动迟缓,同时存在下列主征中的1项:静止性震颤、肌强直及步态姿势异常;除外15项排除标准。
1.2 方法
1.2.1 患者一般人口学资料 根据国际不宁腿综合征研究组(The International Restless Legs Syndrome Study Group,IRLSSG)的诊断标准,分为RLS组和非RLS(NRLS)组。采用不宁腿综合征评定量表(restless legs syndrome-rating scale,RLS-RS)评价患者RLS的表现及严重程度。根据Schrag等[5]的方法,将PD患者分为3种临床类型:震颤型、强直−少动型和混合型。
1.2.2 症状评价和生活质量评价 采用统一帕金森病评定量表 Ⅲ(Unified Parkinson’s Disease Rating Scale Ⅲ,UPDRS Ⅲ)和Hoehn-Yahr分期量表评价患者的运动症状;采用UPDRS Ⅳ和剂末现象评定量表评价患者的异动症、剂末现象及开关现象等运动并发症。
采用非运动症状问卷(non-motor symptom quest,NMSQ)对患者的NMS进行筛查,统计NMS发生的例数以及在运动症状期前、期后发生的例数。采用以下量表评价患者的NMS:UPDRS Ⅰ对PD患者的精神、情绪进行测评;汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)对PD患者进行焦虑测评,其中0~14分为非焦虑组,>14分为焦虑组;24项汉密尔顿抑郁量表(24 items Hamilton depression scale,HAMD-24)对PD患者进行抑郁测评,<8分为无抑郁,≥8分为抑郁,其中8~16分为轻度抑郁,17~23分为中度抑郁,≥24分为重度抑郁;蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA):评价患者认知功能;改良淡漠量表评定(modified apathy estimate scale,MAES):评价患者淡漠的表现;匹兹堡睡眠质量量表(Pittsburgh sleep quality index,PSQI):评价患者睡眠质量;爱泼沃斯思睡量表(Epworth sleeping scale,ESS):评价患者日间嗜睡程度;疲劳量表(fatigue scale-14,FS-14):评价患者疲劳症状及其严重程度;疲劳严重程度量表(fatigue severity scale,FSS):评价患者主观疲劳症状;PD自主神经症状量表(the scale for outcomes inPD for autonomic symptoms,SCOPA-AUT):评价患者自主神经症状。采用UPDRS Ⅱ对患者的日常活动进行测评;39项帕金森病生活质量问卷(Parkinson’s disease quality of life questionnaire,PDQL-39)评价患者的生活质量。
1.3 统计学处理
采用SPSS20.0软件进行统计学分析。计量资料符合正态分布用±s 表示,采用t检验进行比较;计量资料为非正态分布用中位数和四分位数间距表示,采用秩和检验进行比较;计数资料采用χ2检验进行比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 RLS组与NRLS组患者一般资料比较
165例PD患者中70例伴发RLS,其RLS-RS为(19.10±8.86)分。两组比较,RLS组的病程长于NRLS组(P<0.05);RLS组震颤型和混合型发病例数所占百分率少于NRLS组(11.11%vs30.68%,74.07 %vs54.55%;均P<0.05)。
2.2 RLS组与NRLS组运动障碍的评价
2.2.1 RLS组与NRLS组运动症状的比较 采用Hoehn-Yahr分期及UPDRS Ⅲ评分对RLS组与NRLS组的运动症状进行比较,结果发现RLS组的UPDRS Ⅲ评分以及Hoehn-Yahr分期均明显高于NRLS组(P<0.05;表2)。
2.2.2 RLS组与NRLS组药物使用情况及运动并发症发生率的比较 对两组药物使用情况进行比较,采用UPDRS Ⅳ和剂末现象量表对两组运动并发症的发生率进行比较,结果发现RLS组左旋多巴使用率、异动症与剂末现象的发生率明显高于NRLS组(P<0.05);两组开关现象的发生率无明显差异(P>0.05;表3)。
2.3 RLS组与NRLS组NMS例数、发生率及NMS相关量表评分比较
2.3.1 RLS组与NRLS组NMS的发生率比较 本研究通过NMS问卷发现RLS组发生NMS的例数明显多于NRLS组,RLS组为7~13例(平均9.5例),NRLS组为4~10例(平均7例)。RLS组NMS发生率最高的是近记忆力减退(74.27%),继之为抑郁(61.43%)和焦虑(57.14%)。进一步对NMS的发生率进行比较发现RLS组近记忆力减退、抑郁、焦虑、注意力下降、淡漠及性生活障碍等NMS的发生率明显高于NRLS组(P<0.05;表4)。
2.3.2 RLS组与NRLS组的NMS评分比较 RLS组与NRLS组NMS相关量表测评结果显示,两组的UPDRS Ⅰ,HAMA,HAMD,PSQI,FS-14,FSS,SCOPA-AUT症状的种类和例数比较,差异具有统计学意义(P<0.05);两组的MoCA,MAES和ESS 3种评分比较,差异无统计学意义(P>0.05;表5)。

表1 两组患者人口学资料的比较Table1 Comparison of demographic information between two groups

表2 两组患者运动症状的评分比较Table2 Comparison of the scores of motor symptoms between two groups
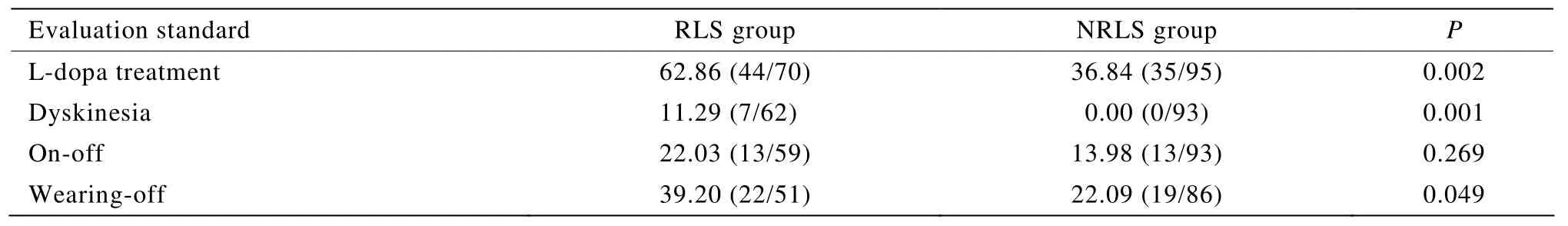
表3 两组患者药物使用率及运动并发症的发生率比较Table3 Comparison of the rates of drug use and complications between two groups [%(n/n)]

表4 两组患者NMS发生率的比较Table4 Comparison of the rates of NMS between two groups [%(n/n)]
2.4 RLS组与NRLS组日常生活能力和生活质量评估
采用UPDRS Ⅱ以及PDQL-39量表研究RLS组与NRLS组日常生活能力和生活质量,结果发现RLS组的评分均明显低于NRLS组(P<0.05;表6)。
3 讨 论
3.1 PD伴发RLS的发生率
PD的运动症状已为人们所熟知,随着病理学研究的进展,发现PD存在多种NMS,包括认知、精神、情感、睡眠、感觉及自主神经功能障碍等[6]。相比之下,NMS中RLS未受到足够的重视[7]。本研究采用RLS-RS评价165例PD患者伴发RLS的临床表现及严重程度,其中伴发RLS的患者占42.4%,略高于以往研究结果。
2003年,IRLSSG确定了RLS的诊断标准,临床医师逐渐提高了对其诊治的认识[8]。高俊华等[9]采用NMS问卷对170例PD患者NMS进行研究,结果显示RLS的发生率为57.1%,在所有NMS中位居第一,运动症状前NMS中RLS发生率为18.6%,在所有NMS中位居第十。Braak等[10]按照PD病理学标志物——路易小体出现的先后顺序将PD分为6期,在第2期已经累及下位脑干,包括脊核、蓝斑等核团,表现为抑郁、快速眼动相睡眠行为障碍、自主神经功能失调、感觉异常及疲劳。根据前面的病理学分期,PD患者早在第2期即可出现RLS等感觉异常的症状,因此,RLS是一种运动症状期前NMS。在本研究70例伴有RLS的PD患者中,1例RLS出现在运动症状之前,低于以往的文献报道,考虑在运动症状出现之前,RLS常常未能引起患者的足够重视。
3.2 PD伴发RLS与运动症状、运动并发症的关系
本研究显示PD患者伴发RLS与性别、文化程度及病程无关,但是,其UPDRS Ⅲ评分及Hoehn-Yahr分期均明显高于NRLS组,反映RLS症状的严重程度与其运动症状及病情的严重程度密切相关,与国内外研究结果一致。Svensson等[11]研究发现PD的严重程度与RLS有关,认为PD和RLS与多巴胺能神经递质系统的病变有关,当PD发展到一定程度,多巴胺的合成与代谢降低,导致RLS加重[12,13]。
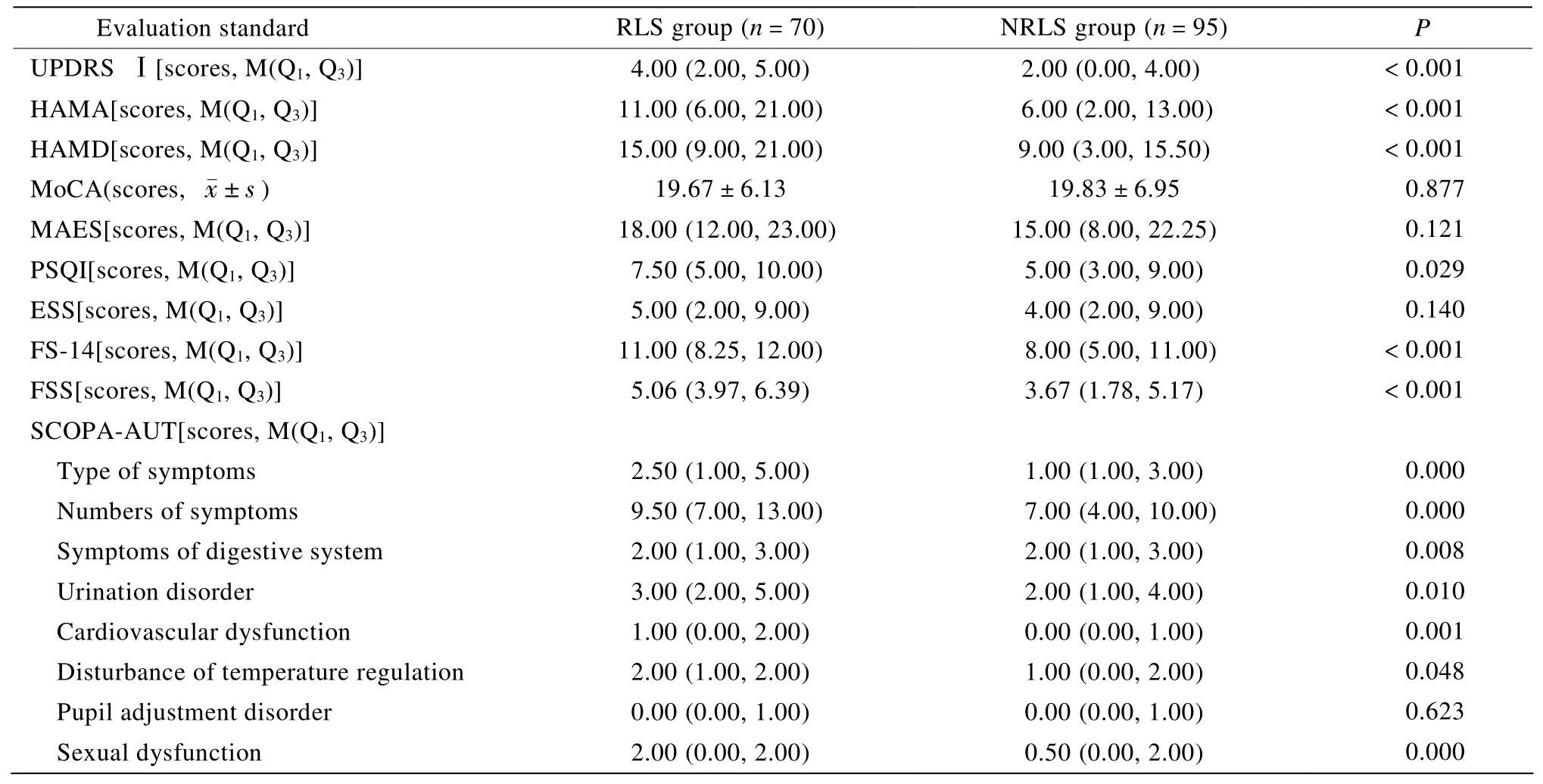
表5 两组患者非运动症状的评分比较Table5 Comparison of the scores of NMS between two groups

表6 两组患者日常生活能力及生活质量的评分比较Table6 Comparison of the scores of living ability and quality of life between two groups
本研究中RLS组剂末现象和异动症的发生率也明显高于NRLS组,提示RLS组的病情较NRLS组更重。两组药物的使用率无明显差异,但RLS组左旋多巴类药物的使用率明显高于NRLS组。因此,RLS组患者脑内多巴胺水平明显不足,导致左旋多巴使用增多,更易出现异动症。两组开关现象的发生率无差异,表明其与RLS无明显关联。运动并发症与RLS的关系及机制有待进一步研究。
3.3 PD伴发RLS与NMS的关系
本研究通过NMS问卷发现RLS组NMS的例数明显多于NRLS组,且与病情的严重程度有关,与性别、年龄、文化程度及临床分型无关。RLS组NMS发生率最高的是近记忆力减退,继之为抑郁和焦虑。与NRLS组相比,RLS组的病变范围可能更广,故出现NMS的例数更多。
3.3.1 精神障碍 抑郁和焦虑是PD患者常伴发的情感障碍,本研究发现RLS组抑郁和焦虑的发生率明显高于NRLS组,且NMS调查问卷显示RLS组抑郁的发生率远高于NRLS组,表明伴有RLS的PD患者易罹患抑郁和焦虑。
认知功能障碍是影响PD患者生活质量的重要NMS之一,近记忆力下降是PD认知障碍早期的表现之一。本研究发现RLS组近记忆力下降的发生率明显高于NRLS组,但MoCA评分未见明显差异,可能是PD患者的RLS出现较早,涉及的神经递质主要与多巴胺有关。而PD认知障碍出现较晚,主要是由乙酰胆碱水平的降低所致。本研究中重度PD患者较少,MoCA评分未见明显变化考虑可能与样本量尚不充足有关,有待扩大样本进一步研究。
淡漠是PD的另一种精神障碍,本研究发现RLS组淡漠的发生率较NRLS组高。研究发现淡漠可能与额叶前部、眶面−纹状体腹侧环路功能受损有关,提示其发生可能与脑内多巴胺水平有关。而RLS亦与多巴胺递质有关,表明RLS与淡漠在神经生化方面存在共性。
3.3.2 自主神经功能障碍 Minguez-Castellanos等[14]发现PD患者的运动症状出现之前,α−突触核蛋白已广泛存在于周围自主神经元中。Probst等[15]用α−突触核蛋白标记研究显示,PD患者脊髓自主神经核和周围自主神经最先出现PD病理改变,其次是延髓和嗅神经。本研究采用SCOPA-AUT量表进行研究,发现RLS组自主神经症状的种类和例数较NRLS组明显增多,其中性功能障碍最明显,其次为心血管功能障碍,继之为消化系统症状、排尿障碍和体温调节障碍,提示RLS组自主神经功能障碍更重,与PD病理发展过程一致。
3.3.3 睡眠障碍 睡眠障碍和觉醒障碍常见于PD患者,其发生率高达70%。Nomura等[16]研究发现RLS组PSQI评分较NRLS组明显增高,表明伴有RLS的PD患者睡眠障碍更重。本研究RLS组与NRLS组的PSQI具有显著差异,表明RLS组睡眠质量更差。我们采用ESS评分评价患者白天嗜睡情况,未见两组明显差异,与以往的报道一致[17]。
3.4 PD伴发RLS对患者生活质量的影响
PD的运动症状及NMS导致患者生活质量明显下降。国内外研究发现影响PD患者生活质量的因素包括运动迟缓、抑郁、焦虑及睡眠障碍等,而高俊华等[9]研究发现RLS是发生率最高的NMS,严重影响患者的睡眠效率及生活质量,提示PD伴发RLS为影响患者生活质量的重要因素。本研究发现RLS组UPDRS Ⅱ以及PDQL-39评分明显低于NRLS组,提示RLS严重损害PD患者的日常生活能力及生活质量。
综上,PD患者RLS的发生率高,可能是由于中枢神经系统多部位进行性变性导致的神经生化异常所致。PD伴RLS患者的运动障碍更重,剂末现象、异动症等并发症更重;NMS的发生率更高、例数更多,精神、情感、自主神经功能及睡眠障碍更突出,日常生活能力及生活质量更差。
【参考文献】
[1]Pont-Sunyer C, Hotter A, Gaig C,et al.The onset of nonmotor symptoms in Parkinson’s disease (the ONSET PD study)[J]. Mov Disord, 2015, 30(2):229−237.
[2]Rijsman RM, Schoolderman LF, Rundervoort RS,et al.Restless legs syndrome in Parkinson’s disease[J].Parkinsonism Relat Disord, 2014, 20(Suppl 1):S5−S9.
[3]Verbaan D, van Rooden SM, van Hilten JJ,et al.Prevalence and clinical profile of restless legs syndrome in Parkinson’s disease[J]. Mov Disord, 2010, 25(13):2142−2147.
[4]Hughes AJ, Daniel SE, Kilford L,et al. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease:a clinico-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992, 55(3):181−184.
[5]Schrag A, Jahanshahi M, Quinn N. What contributes to quality of life in patients with Parkinson’s disease[J]? J Neurol Neurosurg Psychiatry, 2000, 69(3):308−312.
[6]Berg D, Postuma RB, Bloem B,et al. Time to redefine PD? Introductory statement of the MDS Task Force on the definition of Parkinson’s disease[J]. Mov Disord,2014, 29(4):454−462.
[7]Trenkwalder C, Paulus W. Restless legs syndrome:pathophysiology, clinical presentation and management[J].Nat Rev Neurol, 2010, 6(6):337−346.
[8]Allen RP, Picchietti D, Hening WA,et al. Restless legs syndrome:diagnostic criteria, special considerations, and epidemiology. A report from the restless legs syndrome diagnosis and epidemiology workshop at the National Institutes of Health[J]. Sleep Med, 2003, 4(2):101−119.
[9]Gao JH, Yan ZF, Sun L,et al. Non-motor symptoms in Parkinson’s disease[J]. Chin Gen Pract, 2010, 13(8B):2576−2579. [高俊华, 闫兆芬, 孙 莉, 等. 帕金森病患者非运动症状的临床研究[J]. 中国全科医学, 2010,13(8B):2576−2579.]
[10]Braak H, Del Tredici K, Rüb U,et al. Staging of brain pathology related to sporadic Parkinson’s disease[J].Neurobiol Aging, 2003, 24(2):197−211.
[11]Svensson E, Beiske AG, Loge JH,et al. Sleep problems in Parkinson’s disease:a community-based study in Norway[J]. BMC Neurol, 2012, 12:71.
[12]Möller JC, Unger M, Stiasny-Kolster K,et al. Restless legs syndrome(RLS) and Parkinson’s disease (PD)-related disorders or different entities[J]? J Neurol Sci, 2010,289(1−2):135−137.
[13]Allen RP, Ondo WG, Ball E,et al. Restless legs syndrome(RLS) augmentation associated with dopamine agonist and levodopa usage in a community sample[J].Sleep Med, 2011, 12(5):431−439.
[14]Minguez-Castellanos A, Chamorro CE, Escamilla-Sevilla F,et al. Do alpha-synuclein aggregates in autonomic plexuses predate Lewy body disorders? A cohort study[J].Neurology, 2007, 68(23):2012−2018.
[15]Probst A, Bloch A, Tolnay M. New insights into the pathology of Parkinson’s disease:does the peripheral autonomic system become central[J]? Eur J Neurol, 2008,15(Suppl 1):1−4.
[16]Nomura T, Inoue Y, Nakashima K. Clinical characteristics of restless legs syndrome in patients with Parkinson’s disease[J]. J Neurol Sci, 2006, 250(1−2):39−44.
[17]Gómez-Esteban JC, Zarranz JJ, Tijero B,et al. Restless legs syndrome in Parkinson’s disease[J]. Mov Disord,2007, 22(13):1912−1916.
