西安市干休所老年男性肺癌死亡危险因素的23年随访研究
2015-04-21赛晓勇苗凯玲
赛晓勇,苗凯玲,高 峰
西安市干休所老年男性肺癌死亡危险因素的23年随访研究
赛晓勇1,苗凯玲2,高 峰3*
(解放军总医院:1老年医学研究所,2呼吸内科,北京 100853;3总参警卫局卫生保健处,北京 100017)
探讨西安市军队老年男性肺癌死亡的危险因素。研究对象选择1987年建立的西安市22个军队干休所的全部男性离退休干部队列人群,共计1 268人,观察终点指标为肺癌死亡,采用多元Cox比例风险模型计算相对危险度(RR)值和95%CI。截止2009年9月30日,共观察21,300.05人年,平均随访16.80人年。死亡725人,527人存活,16人失访。多元Cox模型分析显示,吸烟指数、既往慢性阻塞性肺疾病(COPD)病史和癌症史与肺癌死亡相关,其RR及95%CI分别为1.001(1.001~1.002)、1.966(1.261~3.065)、6.628(2.399~18.317);死亡风险随既往吸烟量的增多、吸烟年限的延长而升高,存在剂量反应关系;≤17岁开始吸烟者较>17岁开始吸烟者肺癌风险提高了90.8%。吸烟、既往COPD史、既往癌症史是该队列老年男性肺癌死亡的危险因素,尤其是开始吸烟年龄≤17岁的青少年风险高。
老年人;吸烟;肺肿瘤;危险因素;随访研究
近年来癌症发病率呈逐年上升趋势,其中肺癌的发病率和死亡率已居各种肿瘤的首位[1,2]。世界卫生组织(World Health Organization)国际癌症研究署(International Agency for Research on Cancer,IARC)2010年发布的GLOBOCAN2008癌症报告[3,4]显示,2008年全球肺癌新发病例预测约161万例,死亡约138万例,分别占恶性肿瘤新发病例及死亡病例的13%和18%,居恶性肿瘤第一位。大量流行病学调查资料和科学实验证明,肺癌与吸烟的关系最为密切[5]。目前国内关于肺癌危险因素的研究样本主要来源于医院病例,代表性较差,多为回顾性分析,规范的队列设计少见,为进一步探讨肺癌死亡的危险因素及其相互关系,我们在1987年建立的干休所老年队列基础上,于2009年随访调查基础上再次进行了分析,现将结果报告如下。
1 对象与方法
1.1 研究对象
选择1987年西安市22个部队干休所中进行健康现况调查的1 268名男性军队离退休干部为基线人群。纳入标准:全体男性离退休干部,年龄>55岁;排除标准:女性,原因是女性人数过少,为避免性别偏倚剔除;共入选1268人。基线调查内容包括:人口统计学特征、烟酒及体育锻炼习惯、既往6种主要病史[冠心病、高血压、脑卒中、糖尿病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和各类肿瘤]、体检项目包括身高、体质量、血压、血清胆固醇(酶法)及甘油三酯(乙酰丙酮法)等。
研究对象均知情同意。
1.2 诊断标准
吸烟参照WHO1997年标准:吸烟者为既往吸烟每日≥1支、年限>1年者。继续吸烟者为基线调查时仍然吸烟者,戒烟者为基线调查时已停止吸烟≥2年者。吸烟量:一般用吸烟指数表示,吸烟指数=每日吸烟支数×吸烟年数,吸烟指数≤200为轻度吸烟,200~400为中度吸烟,≥400为重度吸烟。高血压参照WHO1999年标准,临界高血压指收缩压在140~149mmHg(1mmHg=0.133kPa)和舒张压在90~94mmHg之间者;确诊高血压指未服用抗高血压药物的情况下,收缩压≥140mmHg和(或)舒张压≥90mmHg。
1.3 研究方法
调查员为经统一培训并考核合格的干休所专职医师,以面对面访谈的方式、采用统一标准问卷对老干部进行面对面访谈调查。每两年随访1次,填写死因登记表,随访终点为2009年9月30日。死因判定根据驻军市级以上医院的死亡病历或死亡证明,并由西京医院两位高年资医师复核死因。死亡按《国际疾病分类》(第10版)编码。
1.4 统计学处理
调查资料采用Foxbase建库,双人录入,自编程序对比查错,多元Cox比例风险模型用于计算各相关因素的相对危险度(relative risk,RR)值和95%CI,统计分析均采用SPSS13.0统计软件完成。
2 结 果
随访截止2009年9月30日,共观察21 300.05人年,平均随访16.80人年;死亡725人,调整死亡率为3404/10万人年,527人存活,16人失访。基线调查资料见既往发表文章[6],前3位死因为恶性肿瘤、心脑血管病和COPD,死因构成比分别为38.07%,29.66%和26.62%。
2.1 肺癌死亡单因素分析
表1结果表明,危险比(hazard ratio,HR)>1且<0.05的变量为年龄、吸烟年数、日吸烟量(支)、吸烟指数、既往病史(COPD和癌症);HR值及95%CI分别为1.058(1.017~1.101)、1.033(1.019~1.047)、1.047(1.027~1.068)、1.001(1.001~1.002)、2.443(1.609~3.708)、5.894(2.161~16.073)。
2.2 肺癌死亡多因素分析
表2结果表明,HR>1且<0.05的变量为吸烟指数、既往病史(COPD和癌症);HR值及95%CI分别为1.001(1.001~1.002)、1.966(1.261~3.065)、6.628(2.399~18.317)。
2.3 吸烟与肺癌风险的分层分析
表3显示的是基线肺癌死亡连续变量的HR值及95%CI。其中,与不吸烟组比,开始吸烟年龄≤17岁组、>17岁组的HR值及95%CI分别为3.053(1.492~6.248)、2.145(1.221~3.768);与不吸烟组比,吸烟指数1~349、350~569、570~749和≥750各组的HR值及95%CI分别为1.439(0.731~2.831)、2.420(1.247~4.694)、2.226(1.074~4.614)、3.963(2.076~7.565);与不吸烟组比较,吸烟年数1~19、20~29、30~39和≥40年各组的HR值及95%CI分别为1.115(0.433~2.874)、1.758(0.849~3.642)、2.355(1.267~4.379)、3.429(1.830~6.427);与不吸烟组比较,日吸烟量1~10、11~20和≥21支各组的HR值及95%CI分别为1.625(0.819~3.225)、2.141(1.175~3.901)、3.907(2.037~7.497)。
3 讨 论
吸烟与相关疾病关系的研究源自英国的Doll医师等[7]。目前吸烟已是公认的肺癌主要致病因素,其对全球80%男性肺癌患者及至少50%女性肺癌患者产生直接影响[3],90%的肺癌与吸烟有关[8]。据WHO统计,全世界每年新发肺癌患者>l20万例,死亡110万例[9]。我国肺癌发病率和死亡率从20世纪70年代末开始,一直呈明显上升趋势,现已居城乡居民恶性肿瘤死因首位[2]。尽管肺癌的各种治疗方法不断改进,但患者的总体5年生存率仅约15%,且与临床分期呈显著负相关[10]。Guerra等[11]报道,手术能为早期老年肺癌患者提供最好的治愈机会,高龄并不是手术禁忌,只要做好充分的术前准备和选择,手术仍能使其生存及预后获益[12]。因此,肺癌的预防与早期诊断尤为重要。COPD是一种累及中央气道、外周气道、肺实质和肺血管的肺部慢性疾病,它和肺癌均与肺部对香烟、烟雾等有害气体或颗粒的异常炎症反应有关,且COPD患者发生肺癌的风险增加[13,14]。此两种疾病有共同的危险因素及高危人群,COPD合并肺癌者误诊率及病死率高。这可能与COPD患者反复发作支气管感染、反复大量应用多种抗生素、患者肺功能、机体免疫功能下降等导致肺癌发病率升高;其次慢性炎症反复刺激局部肺组织,使机体对肿瘤免疫力降低,肿瘤更具侵袭性有关[14,15]。研究表明[16],肺气肿程度越重,肺癌患者的病死率越高,而气流阻塞合并肺气肿也使肺癌发生的风险增高。在我们的随访研究中也得到了相同的结论,既往有COPD的患者死于肺癌的风险较无COPD病史的患者提高了1.443倍。说明COPD可能是肺癌发生的一个独立危险因素,提示我们对有气道阻塞和(或)肺实质破坏的吸烟者定期进行肺癌筛查,有助于提高肺癌检出率、预防肺癌的发生并早期治疗肺癌。
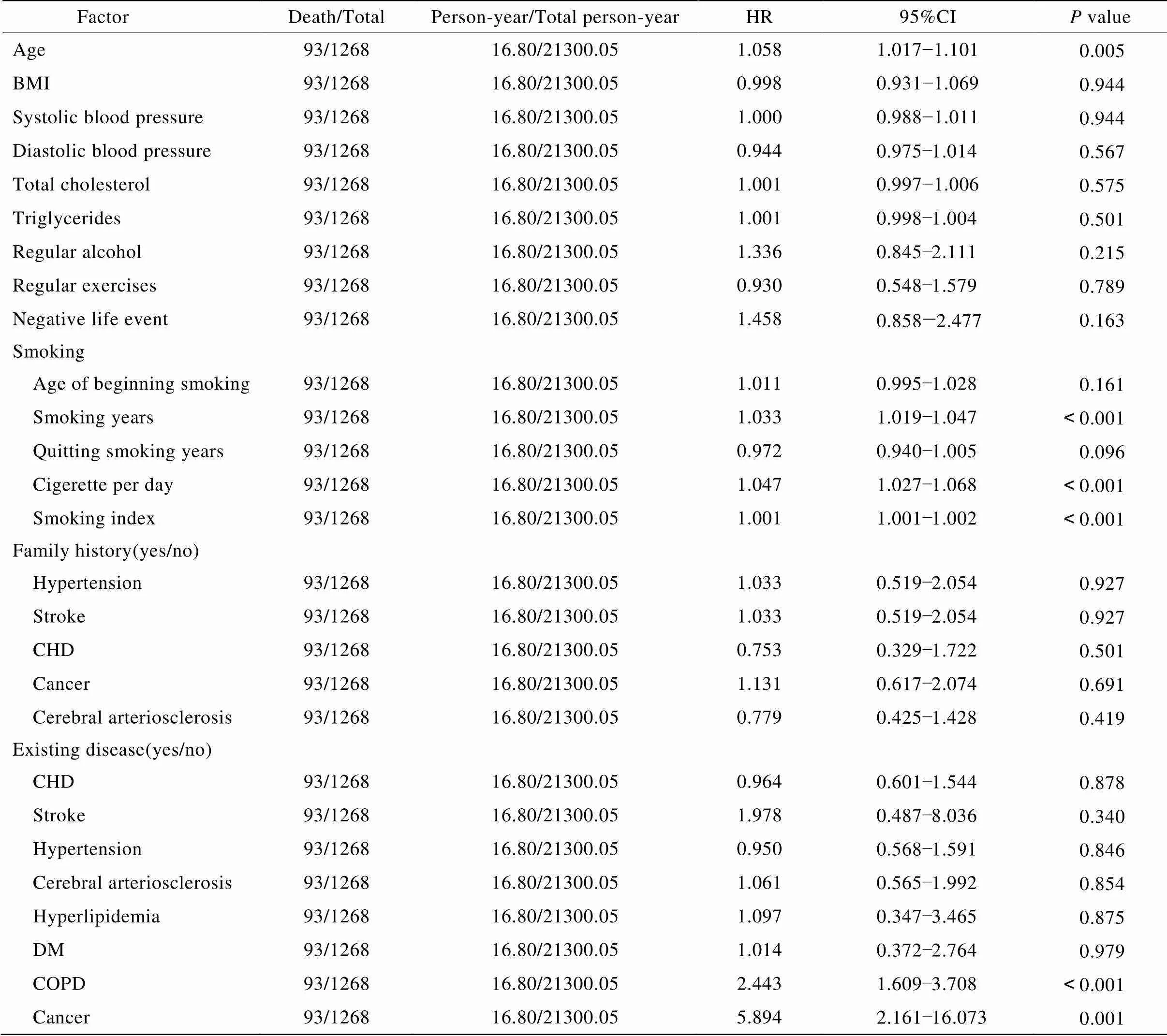
表1 肺癌死亡单因素分析
BMI: body mass index; CHD: coronary heart disease; DM: diabetes mellitus; COPD: chronic obstructive pulmonary disease
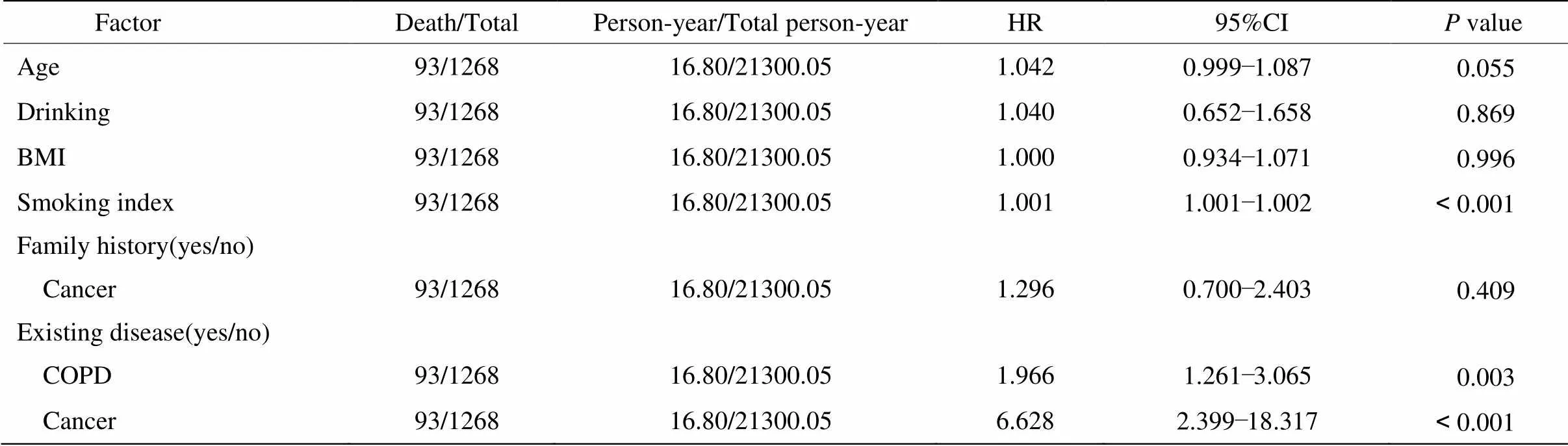
表2 肺癌死亡多因素分析
BMI: body mass index; COPD: chronic obstructive pulmonary disease. Adjusted for age, body mass index, regular alcohol consumption, smoking index, family history of cancer as well as existing disease of COPD and cancer

表3 吸烟变量不同分组的HR值及95%CI
Adjusted for age, body mass index, regular alcohol consumption, smoking index, family history of cancer as well as existing disease of COPD and cancer
我们的研究对象是年龄>55岁的军队老年男性干部,进入队列年龄(62.95±5.18)岁,属于高风险人群,随访便利且较易出现研究结局,平均死亡年龄(76.63±7.42)岁,肺癌死亡单因素分析结果显示,年龄每增加1岁,其肺癌死亡风险增加5.8%。这可能与老年患者身体各项功能减退、器官功能衰减有关。值得一提的是,该研究人群为我军师职以上离退休干部,其社会地位、收入水平、医疗保健水平都较高,按WHO最新年龄划分标准,该研究人群平均死亡年龄已达到老年人标准(75~90岁)。该人群肺癌死亡率可能会低于其他医疗水平及卫生服务资源差的人群。
我们将开始吸烟年龄以17岁为界进行分组,分别与不吸烟者进行对比,发现男性开始吸烟年龄≤l7岁者,其发生肺癌的危险性是不吸烟者的3.053倍(RR=3.053,95%CI:1.492~6.248),>17岁开始吸烟者,其发生肺癌的危险性是不吸烟者的2.145倍(RR=2.145,95%CI:1.221~3.768)。
≤17岁开始吸烟者较>17岁开始吸烟者肺癌风险提高了90.8%。此结果与一项历时14年、观察了681例肺癌患者的研究一致。该研究指出,男性≤l7岁开始吸烟者,肺癌危险性增加48%(RR=1.48,95%CI:1.11~l.96)[17]。另有研究[18]以15岁作为吸烟起始年龄的分界点,所得结果类似。提示我们,未成年人开始吸烟年龄越早,患肺癌的风险就越高,因此青少年戒烟意义重大。
研究[19]表明,吸烟与肺癌的发生呈现一定的剂量−效应关系,吸烟量越多,吸烟年限越长,肺癌的致病风险越高。我们进一步将吸烟指数、吸烟年数、日吸烟量3个连续变量分组,分别与不吸烟者比较,得到如下结果:吸烟指数1~349、吸烟年数1~29年、日吸烟量1~10支的观察者,其肺癌风险与不吸烟者的肺癌风险差异无统计学意义。而当吸烟指数、吸烟年数、日吸烟量进一步增加时,观察者的肺癌风险与不吸烟者相比差异具有统计学意义(<0.05)。我们的研究结果与文献报道一致。
综上所述,本研究对肺癌死亡的危险因素做了单因素、多因素的分析,得到如下结论:年龄、吸烟年数、日吸烟量、吸烟指数、既往病史(COPD和癌症)是肺癌死亡的独立相关因素。吸烟与肺癌的发生呈现一定的剂量−效应关系,开始吸烟年龄越早、吸烟量越多、吸烟年限越长,患肺癌的风险就越高。COPD使肺癌的发病风险增加,是肺癌的高危因素,肺功能损伤增加了肺癌发病风险。对肺癌的高危人群进行定期体检、定期筛查有助于预防肺癌的发生并早期治疗肺癌。尤其要重视的是青少年吸烟率的不断上升,2002年开始吸烟的年龄与1984年比提前了4~5岁[20]。要降低青少年吸烟率,此项工作迫在眉睫。
由于上述队列为军队老年人的生存队列,没有包括因吸烟相关疾病过早死亡的中青年人群,而且该研究人群社会地位、收入水平、医疗保健水平都较高,因此,该队列对肺癌死亡危险性估计低于普通人群,调整因素中未能包括饮食习惯、精神心理因素等,有调查[21,22]显示,大蒜和绿茶是肺癌的保护因素,这些因素可能会对危险性估计值的精度有影响。调查终点没有具体到肺癌的不同类型,具体分型有待进一步分析研究。
[1] Wei S. The analysis of urban malignant tumor mortality trend in 2002−2010[J]. Pract Prev Med, 2013, 20(1): 111−114. [魏 沙. 2002−2010年我国城市恶性肿瘤死亡率变化趋势分析[J]. 实用预防医学, 2013, 20(1): 111−114.]
[2] Liu J, Chen PP, Lou PA,. Analysis on change trend of mortality rate of malignant tumors in 29 years among urban residents in Xuzhou[J]. Pract Prev Med, 2011, 18(12): 2401−2403. [刘 军, 陈培培, 娄培安, 等. 徐州市区居民恶性肿瘤死亡率29年变化趋势分析[J]. 实用预防医学, 2011, 18(12): 2401−2403.]
[3] Jemal A, Bray F, Center MM,. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69−90.
[4] Ferlay J, Shin HR, Bray F,. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893−2917.
[5] Jemal A, Thun MJ, Ries LA,. Annual report to the nation on the status of cancer, 1975−2005, featuring trends in lung cancer, tobacco use, and tobacco control[J]. J Natl Cancer Ins, 2008, 100(23): 1672−1694.
[6] Lam TH, He Y, SHI QL,. Smoking, quitting and mortality in a Chinese cohort of retired men[J]. Ann Epidemiol, 2002, 12(5): 316−320.
[7] Doll R, Peto R. Mortality in relation to smoking: 20 years’ observations on male British doctors[J]. Br Med J, 1976, 2(6051): 1525−1536.
[8] Youlden DR, Cramb SM, Baade PD. The International Epidemiology of Lung Cancer: geographical distribution and secular trends[J]. J Thorac Oncol, 2008, 3(8): 819−831.
[9] Zhou QH. Progress in early diagnosis and screening of lung cancer[J]. Bull Chin Cancer, 2009, 18(9): 705−712. [周清华. 肺癌筛查早诊研究进展[J]. 中国肿瘤, 2009, 18(9): 705−712.]
[10] Strand TE, Malayeri C, Eskonsipo PK,. Adolescent smoking and trends in lung cancer incidence among young adults in Norway 1954−1998[J]. Cancer Causes Control, 2004, 15(1): 27−33.
[11] Guerra M, Neves P, Miranda J. Surgical treatment of non-small-cell lung cancer in octogenarians[J]. Interact Cardiovasc Thorac Surg, 2013, 16(5): 673−680.
[12] Dell’Amore A, Monteverde M, Martucci N,. Early and long-term results of pulmonary resection for non-small-cell lung cancer in patients over 75 years of age: a multi-institutional study[J]. Interact Cardiovasc Thorac Surg, 2013, 16(3): 250−256.
[13] Puntrieri A, Szabo E, Croxton TL,. Lung cancer and chronic obstructive pulmonary disease: needs and opportunities for integrated research[J]. J Natl Cancer Inst, 2009, 10l(8): 554−559.
[14] Duan MC, Zhong XN. Chronic obstructive pulmonary disease and lung cancer: the relative manifestations and pathogenesis[J]. Chin J Tuberc Respir Dis, 2010, 33(12): 921−924. [段敏超, 钟小宁. 慢性阻塞性肺疾病与肺癌的同源性表现及关联发病机制[J]. 中华结核和呼吸杂志, 2010, 33(12): 921−924.]
[15] Han Y, Xu H, Wang AH,. Chronic obstructive pulmonary diseases are risk factors of lung cancer[J]. J Fourth Mil Med Univ, 2005, 26(2): 146. [韩 勇, 徐 晖, 王安辉, 等. 慢性阻塞性肺疾病是肺癌的危险因素[J]. 第四军医大学学报, 2005, 26(2): 146.]
[16] Ueda K, Jinbo M, Li TS,. Computed tomography-diagnosed emphysema, not airway obstruction, is associated with the prognostic outcome of early-stage lung cancer[J]. Clin Cancer Res, 2006, 12(22): 6730−6736.
[17] Hara M, Inoue M, Shimazu T,. The association between cancer risk and age at onset of smoking in Japanese[J]. J Epidemiol, 2010, 20(2): 128−135.
[18] Chen BJ, Li WM, Jia Y,. A cross-sectional investigation on risk factors of lung cancer for residents over 40 years old in Chengdu, Sichuan Province, China[J]. Chin J Lung Cancer, 2010, 13(11): 1021−1026. [陈勃江,李为民, 贾 勇, 等. 成都市40岁以上居民肺癌危险因素现况调查[J]. 中国肺癌杂志, 2010, 13(11): 1021−1026.]
[19] Alberg AJ, Ford JG, Samet JM. Epidemiology of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132(3 Supp1): 29S−55S.
[20] Yang GH, Ma JM, Liu N,. Smoking and passive smoking in Chinese, 2002[J]. Chin J Epidemiol, 2005, 26(2): 77−83. [杨功焕, 马杰民, 刘 娜, 等. 中国人群2002年吸烟和被动吸烟的现状调查[J]. 中华流行病学杂志, 2005, 26(2): 77−83.]
[21] Shukla Y, Kalra N. Cancer chemoprevention with garlic and its constituents[J]. Cancer Lett, 2007, 247(2): 167−181.
[22] Jin ZY, Han RQ, Zhang XF,. The protective effects of green tea drinking and garlic intake on lung cancer, in a low cancer risk area of Jiangsu Province, China[J]. Chin J Epidemiol, 2013, 34(2): 114−l19. [靳子义, 韩仁强, 张晓峰, 等. 江苏省肿瘤低发区绿茶和大蒜对肺癌保护作用的病例对照研究[J]. 中华流行病学杂志, 2013, 34(2): 114−l19.]
(编辑: 周宇红)
Death risk factors for lung cancer in retired males in Xi’an, China: a 23-year-follow-up study
SAI Xiao-Yong1, MIAO Kai-Ling2, GAO Feng3*
(1Institute of Geriatrics,2Department of Respiratory Diseases, Chinese PLA General Hospital, Beijing 100853, China;3Health Care Division, Security Bureau of Headquarters of the General Staff, Beijing 100017, China)
To explore the risk factors for death due to lung cancer in retired military cadres from Xi’an city.A cohort study was carried out on the retired male military cadres from 22 cadre’s sanitariums in Xi’an, China from 1987 to 2009. A total of 1 268 cadres aged 55 years or older were enrolled in 1987 and followed up in the next 23 years. The endpoint was settled as lung cancer death. Multivariate Cox proportional hazards model was employed to calculate relative risk (RR) and 95% confidence interval (CI) values.The total amount of person-year was 21 300.05 in the study until September 30, 2009, and the average person-year was 16.80 years. Among those suffering from lung cancer, 725 cadres died, 527 were alive and 16 lost of follow-up. Multivariate analysis of Cox model showed that smoking index, histories of chronic obstructive pulmonary disease (COPD) and other cancers were risk factors for lung cancer deaths (RR=1.001, 95%CI: 1.001−1.002; RR=1.966, 95%CI: 1.261−3.065; RR=6.628, 95%CI: 2.399−18.317). The risks for deaths were increased significantly with the increasing amount and duration of smoking. Starting smoking before the age of 17 increased the risk of lung cancer by 90.8%.Smoking and histories of COPD and other cancers are the risk factors for lung cancer deaths in the cohort of the elderly males, especially those starting to smoke before the age of 17.
aged; smoking; lung neoplasms; risk factors; follow-up studies
(W2013BJ32)(10BJZ20).
R592; R734.2; R195.1
A
10.11915/j.issn.1671-5403.2015.06.098
2015−04−11;
2015−05−04
中央保健委员会保健专项(W2013BJ32);军队医药卫生科研基金(10BJZ20)
苗凯玲,为共同第一作者
高 峰,E-mail: luckygf2004@163.com
