全饥饿对脑皮质细胞凋亡及Bcl-2、Bax、Caspase-3表达的影响
2015-04-04李媛媛张小平刘铁军李建民张树波程光
李媛媛 张小平 刘铁军 李建民 张树波 程光
相关研究证明饥饿对神经系统的影响非常明显[1,2],大脑与学习记忆功能、呼吸、运动以及摄食、生殖、情绪控制等行为有关,因此饥饿状态对脑细胞损伤可能最终造成大脑功能的损害。在人类中各种疾病引起的患者昏迷或其他原因患者长期不能进食,严重消化道疾病导致营养吸收障碍,或者某些灾难(如矿井、建筑物坍塌、野外迷路等)、自然灾害(如地震、海啸、山体滑坡等)发生时,常造成遇难人员得不到食物,以及人为的长期过度节食等均可因严重营养缺乏造成大脑组织结构和功能损害,从而影响患者脑功能的恢复。因此,对于这类患者应重视支持疗法,保证维持脑功能所必需的营养供给,从而有利于脑功能保护和恢复。本实验通过制备全饥饿模型,观察全饥饿状态对大脑皮质凋亡相关因子Bcl-2、Bax和Caspase-3的表达变化,探讨饥饿时限对脑组织损害机制及程度的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康成年雄性SD大鼠60只,清洁级,体重(350±30)g,12周龄,由河北联合大学动物实验中心提供[动物合格证号:SCXK(冀)2009-0003]。
1.1.2 试剂:实验所需的仪器由河北联合大学临床医学院临床实验中心提供。TUNEL试剂盒(Millipore公司);PCR反应试剂盒、逆转录试剂盒和引物(Invitrogen公司);BCA蛋白浓度测定试剂盒(碧云天公司);Bcl-2一抗(上海Bioworlde公司);兔抗Caspase-3(Active)一抗、兔抗Bax一抗、兔抗GAPDH一抗、山羊抗兔IgG二抗、ECL发光液(Affinity公司)。
1.2 方法
1.2.1 动物分组:60只SD大鼠随机分为6组,分别为正常对照组、饥饿3 d、5 d、7 d、9 d和11 d组。其后又将每组随机分为2个亚组Ⅰ、Ⅱ,每个亚组5只。每组Ⅰ组应用TUNEL法检测皮质区的凋亡细胞,Ⅱ组用RT-PCR和Western blot法检测皮质区 Bcl-2、Bax和Caspase-3的mRNA及蛋白表达。
1.2.2 全饥饿模型的复制:大鼠实验前置(25±2)℃室温,自由饮食,分笼适应性喂养2周后进行实验。正常对照组给予正常饮食,饥饿3 d、5 d、7 d、9 d、11 d 组在相应的饥饿天数内禁食,但给予足量的饮水。每组Ⅰ组大鼠在达到饥饿天数后,立即以10%水合氯醛以0.30 ml/100 g体重腹腔内注射麻醉动物,在深度麻醉下用0.9%氯化钠溶液、4%多聚甲醛溶液经左心室、主动脉灌注,之后断头。用特制的咬骨钳从枕骨大孔处钳开,仔细分离整个大脑组织,在视交叉和乳头体处将脑组织垂直横断后,将含顶叶脑组织(厚约4 mm)置于4℃0.1 mol/L的4%多聚甲醛溶液浸泡后固定以备制作石蜡标本,用于Tunel检测。Ⅱ组大鼠在深麻下断头取脑,分离皮质,用于 RT-PCR和Western blot检测。
1.2.3 皮质神经元凋亡检测:采用TUNEL法检测大鼠皮质神经元凋亡情况。切片入水,滴加新鲜稀释的蛋白酶K(20 g/ml),室温消化15 min;3%H2O2孵育5 min,PBS冲洗5 min×2次;加入平衡液,4℃孵育60 min;加入TdT酶反应液,37℃孵育60 min;加入终止液,室温孵育10 min;PBS冲洗1 min×3次,加入Anti-digoxigenin,室温孵育30 min;PBS冲洗2 min×4次,DAB显色。高倍镜下大脑皮质顶叶区截图(来自不同切片),采用Image-ProPlus 6.0图像分析软件进行凋亡细胞计数。
1.2.4 RT-PCR法检测大鼠皮质:Bcl-2、Bax、Caspase-3 mRNA的表达 PCR反应体系(参考PCR说明书):Taq Master Mix 17 μl,上下游引物各 1 μl,模板 DNA 1 μl,共 20 μl。PCR 反应条件:预变性 94℃ 4 min,变性 94℃ 30 s、退火58℃ 30 s、延伸72℃ 1 min(39个循环),终延伸72℃ 5 min。PCR反应产物经2%琼脂糖凝胶电泳检测,用LeicaQ5100W型全自动图像分析仪分析电泳结果。用全自动数码成像分析系统对结果进行分析。见表1。
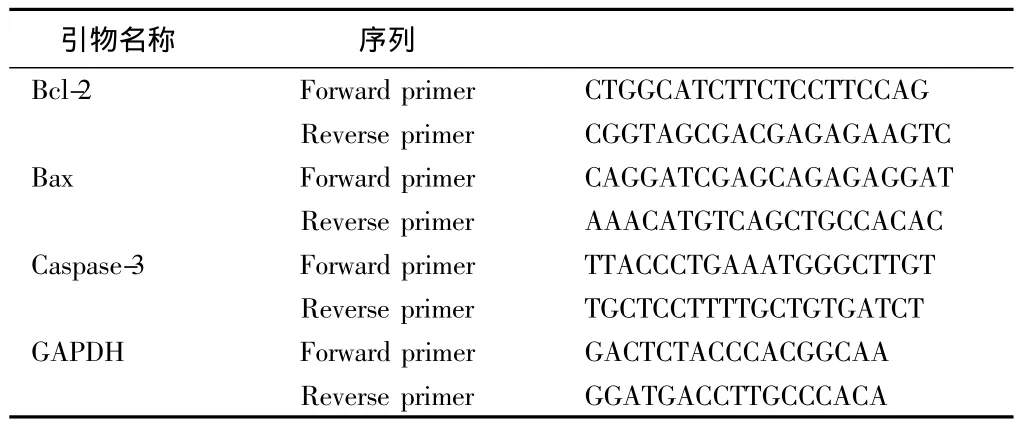
表1 引物序列
1.2.5 Western blot检测大鼠皮质 Bcl-2、Bax、Caspase-3蛋白表达:按照WIP组织细胞裂解液说明书提取蛋白,用BCA法检测样本蛋白浓度。样品的上样体积为30 μl(总蛋白量为25 μg),用15%的分离胶进行SDS-PAGE电泳;转膜后以5%的脱脂奶封闭液封闭1 h;一抗(1∶500)孵育4℃过夜;用TBST洗膜3次(5 min/次);二抗(11∶3 000)孵育1 h;洗膜。用ECL发光试剂盒发光、显影、定影。
1.3 统计学分析 应用SPSS 17.0统计软件,计量资料以表示,采用单因素方差分析,相关性采用Pearson法分析,P<0.05为差异有统计学意义。
2 结果
2.1 皮质神经细胞凋亡情况 与正常对照组比较,饥饿3 d组凋亡细胞百分比无明显增加(P>0.05),饥饿5 d组稍有增加(P<0.05),而饥饿7 d、9 d和11 d组明显增加(P<0.01)。见表2,图1~8。
表2 大鼠皮质区TUNEL阳性细胞及凋亡细胞阳性率n=5,±s
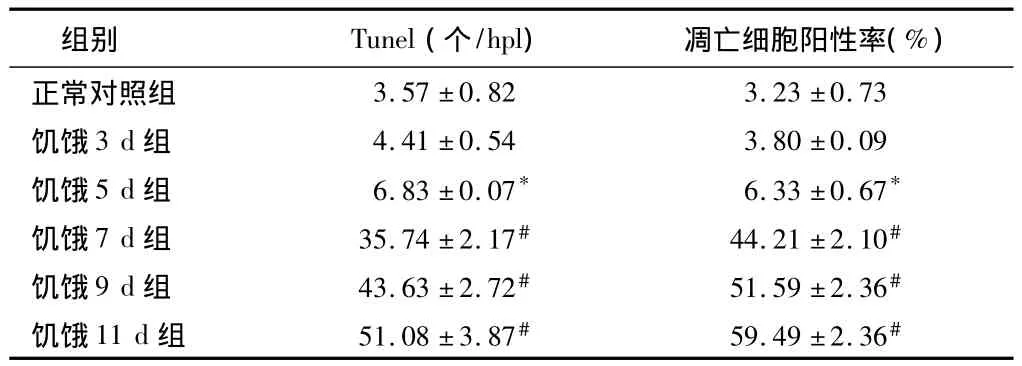
表2 大鼠皮质区TUNEL阳性细胞及凋亡细胞阳性率n=5,±s
注:与正常对照组比较,*P <0.05,#P <0.01
组别 Tunel(个/hpl) 凋亡细胞阳性率(%)正常对照组3.57±0.82 3.23±0.73饥饿3 d组 4.41±0.54 3.80±0.09饥饿5 d组 6.83±0.07* 6.33±0.67*饥饿7 d组 35.74±2.17# 44.21±2.10#饥饿9 d组 43.63±2.72# 51.59±2.36#饥饿11 d组 51.08±3.87# 59.49±2.36#
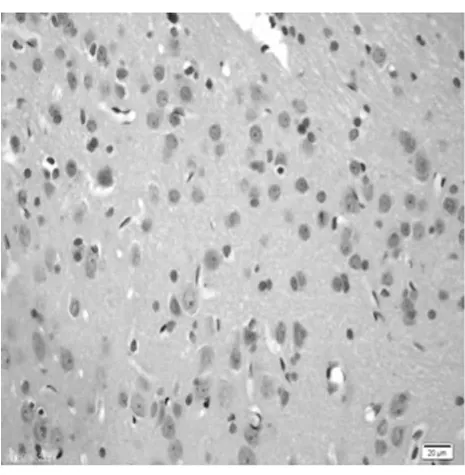
图1 阴性对照皮质区(TUNEL×400)
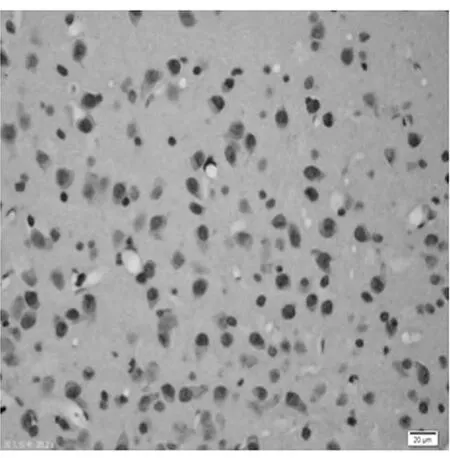
图2 阳性对照皮质区(TUNEL×400)
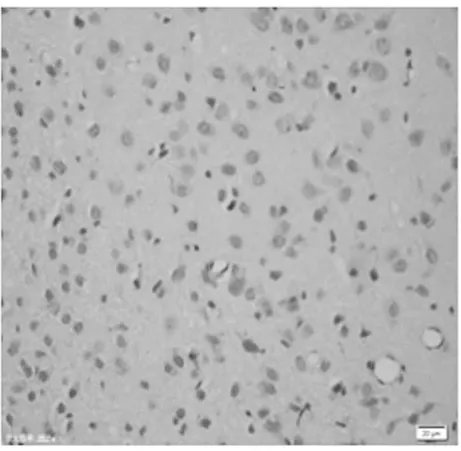
图3 正常对照组皮质区(TUNEL×400)
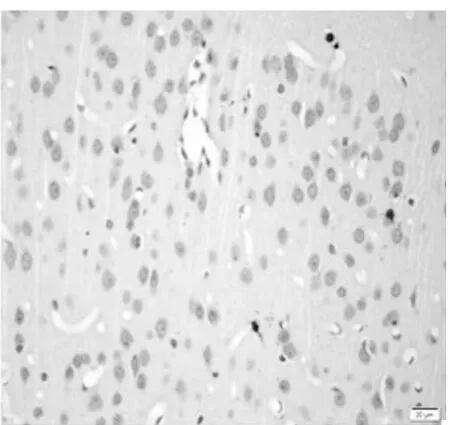
图4 饥饿3 d组皮质区(TUNEL×400)
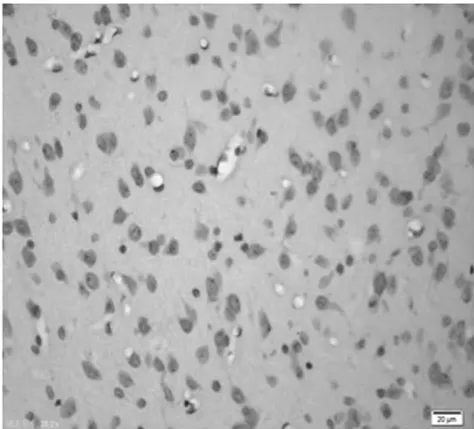
图5 饥饿5 d组皮质区(TUNEL×400)
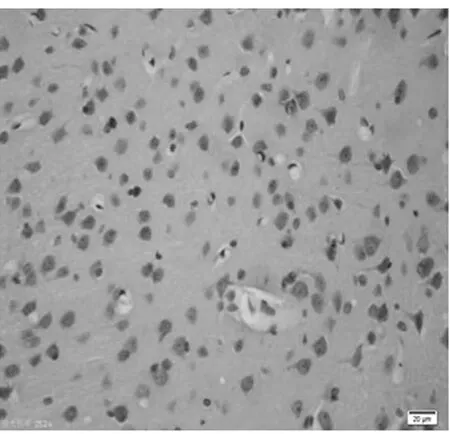
图6 饥饿7 d组皮质区(TUNEL×400)
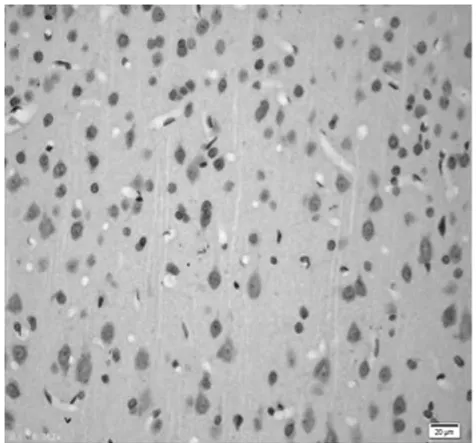
图7 饥饿9 d组皮质区(TUNEL×400)
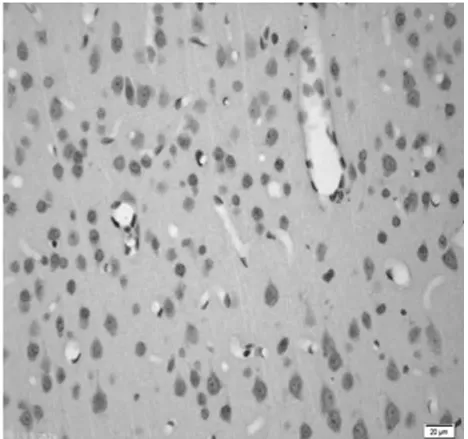
图8 饥饿11 d组皮质区(TUNEL×400)
2.2 RT-PCR法检测大鼠皮质 Bcl-2、Bax、Caspase-3 mRNA的表达 与正常对照组比较,饥饿3 d组Bax和Caspase-3 mRNA表达无明显增加(P>0.05),而饥饿5 d、7 d、9 d、11 d 组Bax和Caspase-3 mRNA 表达均明显增加(P<0.01);饥饿3 d、5 d、7 d组 Bcl-2 mRNA的表达均增高(P<0.05),5 d组表达量最高(P<0.01),9 d、11 d 组表达降低(P<0.05),11 d组表达量最低(P<0.01)。见表2,图9。
表2 大鼠皮质区Bcl-2、Bax、Caspase-3mRNA相对表达量n=5,±s
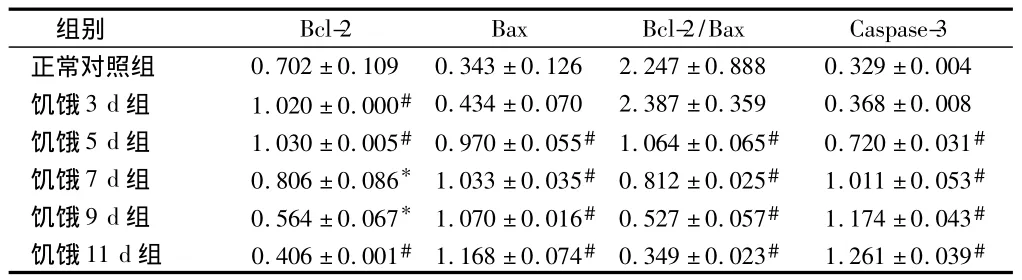
表2 大鼠皮质区Bcl-2、Bax、Caspase-3mRNA相对表达量n=5,±s
注:与正常对照组比较,*P <0.05,#P<0.01
组别Bcl-2 Bax Bcl-2/Bax Caspase-3正常对照组 0.702±0.109 0.343±0.126 2.247±0.888 0.329±0.004饥饿3 d组 1.020±0.000# 0.434±0.070 2.387±0.359 0.368±0.008饥饿5 d组 1.030±0.005# 0.970±0.055# 1.064±0.065# 0.720±0.031#饥饿7 d组 0.806±0.086* 1.033±0.035# 0.812±0.025# 1.011±0.053#饥饿9 d组 0.564±0.067* 1.070±0.016# 0.527±0.057# 1.174±0.043#饥饿11 d组 0.406±0.001# 1.168±0.074# 0.349±0.023# 1.261±0.039#
图9 各组大鼠皮质区Bcl-2、Bax、Caspase-3 mRNA的表达水平
2.3 Western Blot检测 Bcl-2、Bax、Caspase-3 蛋白表达
与正常对照组比较,饥饿3 d组Bax和Caspase-3蛋白表达无明显增加(P>0.05),饥饿5 d组Caspase-3表达增加(P<0.05),Bax蛋白表达明显增加(P<0.01),而饥饿7 d、9 d、11 d组 Bax和 Caspase-3 蛋白表达均明显增加(P<0.01);饥饿3 d、5 d、7 d组Bcl-2蛋白的表达均明显增高(P<0.01),5 d组表达量最高,9 d、11 d组表达降低,11 d组表达量最低(P<0.01)。见图10,表3。

图10 各组大鼠皮质区Bcl-2、Bax、Caspase-3蛋白的表达水平
表3 大鼠皮质区Bcl-2、Bax、Caspase-3蛋白相对表达量n=5,±s
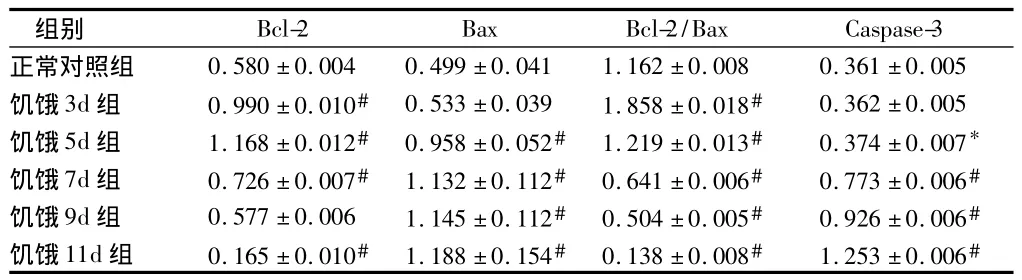
表3 大鼠皮质区Bcl-2、Bax、Caspase-3蛋白相对表达量n=5,±s
注:与正常对照组比较,*P <0.05,#P <0.01
组别Bcl-2 Bax Bcl-2/Bax Caspase-3正常对照组 0.580±0.004 0.499±0.041 1.162±0.008 0.361±0.005饥饿3d组 0.990±0.010# 0.533±0.039 1.858±0.018# 0.362±0.005饥饿5d组 1.168±0.012# 0.958±0.052# 1.219±0.013# 0.374±0.007*饥饿7d组 0.726±0.007# 1.132±0.112# 0.641±0.006# 0.773±0.006#饥饿9d组 0.577±0.006 1.145±0.112# 0.504±0.005# 0.926±0.006#饥饿11d组 0.165±0.010# 1.188±0.154# 0.138±0.008# 1.253±0.006#
2.4 对细胞凋亡与Bcl-2、Bax、Bcl-2/Bax和Caspase-3蛋白之间的相关性进行分析 见表4。

表4 大鼠皮质区细胞凋亡与Bcl-2、Bax、Caspase-3及Bcl-2/Bax比值之间的相关性(r值)
3 讨论
相关研究证明饥饿对神经系统的影响非常明显[1],可引起脑细胞内钙增加,导致细胞内钙超载,而钙超载被认为是导致神经元迟发型死亡的关键因素之一。本实验结果显示饥饿可引起脑皮质区神经细胞凋亡数增加,饥饿后期数目明显增多,提示可能已存在凋亡过度。细胞凋亡是涉及多基因调控的复杂的严格控制的主动死亡过程,Bcl-2家族是一个参与细胞死亡调控的基因家族,由两组功能相互拮抗的蛋白组成,在细胞凋亡的调控过程中具有重要作用[3]。
本研究显示,饥饿7 d内大鼠Bcl-2基因的表达增加,而随着饥饿期延长,Bcl-2的表达明显减少。结果表明短期的饥饿应激后皮质神经元中Bcl-2被诱导表达,提示Bcl-2可能是成年脑组织中的一种可诱导的内源性神经保护剂。相关研究证明饥饿早期时大鼠学习记忆能力稍有增强。Bcl-2蛋白可以降低细胞膜通透性、减少细胞色素C释放、减少内质网释放钙,在内源性细胞凋亡的过程中起着关键性的调控作用[4,5]。饥饿后期Bcl-2表达减少可能会是皮质区凋亡增加的影响因素之一。
Bax具有孔形成能力,并能诱导细胞色素C的释放,使 Bcl-2与 Apaf-1分离,然后 Apaf-1激活Caspase[6,7],启动凋亡级联反应[6]。饥饿 3 d 时大鼠Bax基因的表达略有增加,而随着饥饿期延长大鼠皮质区Bax基因的表达明显增加。结果提示在全饥饿状态下Bax的表达受到影响,结合Bax基因表达具有促进凋亡的作用,考虑全饥饿状态下皮质区细胞凋亡增加可能与Bax表达增加相关,而相关性分析显示二者呈正相关。
Caspase蛋白酶家族在凋亡发生时瀑布式启动过程中Caspase-3是凋亡的最终执行者,在凋亡信号传递中起关键作用[8,9]。本研究检测各组大鼠皮质的Caspase-3基因的表达,与正常对照组比较发现,各组皮质Caspase-3 mRNA表达均上调,Caspase-3活性增高,其在饥饿后期7 d、9 d、11 d组中变化更显著,故可知饥饿后期更容易诱导细胞凋亡。
目前有研究认为,Bcl-2与Bax的比值是决定细胞是否发生凋亡的基本检验点[10]。当二者的比率<1,Bax起到的作用占优势,细胞色素C从线粒体释放,从而导致细胞凋亡发生的一连串瀑布反应。当二者比率≥1,Bcl-2起到的作用占优势,细胞色素C不再释放,线粒体途径的凋亡不起作用,细胞凋亡因此大大减少[11,12]。本实验中饥饿 3 d、5 d 组皮质区 Bcl-2/Bax比值较正常对照组明显增加,而饥饿7 d、9 d、11 d组较正常对照组比较明显下降。说明在饥饿早期,大鼠Bcl-2/Bax比值明显增加,抑制神经细胞的凋亡,而随着饥饿期延长,在饥饿后期大鼠皮质区Bcl-2/Bax比值明显减少。相关性分析显示凋亡细胞数与二者比值呈负相关。在不同疾病模型研究中,Bcl-2/Bax比值的大小与TUNEL阳性细胞数的增减呈现出相互平行的变化关系,说明 Bcl-2/Bax比值有可能成为判断细胞凋亡程度及与相关疾病发生的一个预示指标。在不同组织细胞凋亡的相关研究中,Bcl-2和Bax虽单独具有调控细胞凋亡的功能,但在二者共表达的细胞中,其相互间的比例对细胞凋亡的影响更为重要。在不同刺激因子作用下,这些都提示Bcl-2家族成员间的动态平衡可能是决定细胞命运的核心机制之一,尤其是这一家族的两个代表性成员Bcl-2和Bax。
综上所述,短期饥饿应激可能有一定的脑保护作用;长期饥饿应激可能通过上调大鼠皮质细胞Bax、Caspase-3的表达,抑制 Bcl-2的表达,破坏了 Bcl-2/Bax的平衡,进而诱导细胞凋亡。
1 安翠红,张小平,程爱国.全饥饿状态以及复食后对大鼠脑损伤的影响.医学信息,2014,27:64-65.
2 谢静涛,唐晋.饥饿状态对注意力的影响.湖南中医学院学报,2004,24:53-54.
3 Tichy A.Apoptotic machinery:the Bcl-2 family protein in the roleof inspectors and su-perintendents.Acta Medica(Hradec Kralove),2006,49:13-18.
4 Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia.Stroke,2009,40:331-339.
5 兴桂华,李雪岩,林春荣,等.老年性痴呆模型大鼠海马区 Bcl-2、Bax的表达及七福饮的干预作用.中国老年学杂志,2010,30:1389-1391.
6 Mendoza-Paredes A,Liu H,Schears G,et al.Resuscitation with 100%,compared with 21%,oxygen following brief,repeated periods of apnea can protect vulnerable neonata1 brain regions from apoptotic injury.Resuscitation,2008,76:261-270.
7 Tan KO,Fu NY,Sukumaran SK,et al.MAP-1 is a mitochondrial effector of Bax.Proc Natl Acad Sci USA,2005,102:1462-1468.
8 张雪梅,李景亮,吕德华.Caspase-3、Bcl-2与皮肤病.中国麻风皮肤杂志,2008,24:291-294.
9 Sultana R,Banks WA,Butterfield DA.Decreased levels of PSD95 and two associated proteins and increased levels of BCl-2 and caspase-3 in hippocampus from subjects with amnestic mild cognitive impairment:Insights into their potential roles for loss of synapses and memory,accumulation of Abeta,and neurodegenera-tion in a prodromal stage of Alzheimer’s disease.J Neurosci Res,2010,88:469-477.
10 王卫东,陈正堂.bcl-2/bax比率与细胞“命运”.中国肿瘤生物治疗杂志,2007,4:393-395.
11 Swerdlow S,Mccoll K,Rong Y,et al.Apoptosis inhibition by Bcl-2 gives way to autophagy in glu cocorticoid-treated lymph cytes.Autophagy,2008,4:612-620.
12 Salah-Eldin AE,Inous S,Tsukamoto S,et al.An association of Bcl-2 phosphotylation and Bax localizes their functions after hyp erthermia and paclitaxel treatment.Int J Cancer,2003,103:53-60.
