兔泪道置管术拔管后的临床及病理变化
2015-04-01胡文学付新录
白 蒙 胡文学 付新录 姜 健 莫 莉
1.广东省深圳市福田区中医院病理科,广东深圳 518040;2.广东省深圳市龙岗区人民医院眼科,广东深圳 518172;3.中山大学实验动物中心,广东广州 510006
鼻泪管阻塞及泪囊炎多采用手术治疗。泪道置管术操作较简单,面部不留瘢痕,但拔管后存在一定的复发率[1-3]。 拔管后复发的机制,拔管后抗瘢痕治疗的时机和疗程,临床存在争议[1-10]。 本研究拟通过电灼损伤结合缝合法,制造兔鼻泪管阻塞的模型,对兔鼻泪管阻塞模型行泪道置管术2 周,观察拔管后鼻泪管组织的病理变化,探讨拔管后复发的可能机制。
1 材料与方法
1.1 材料
实验仪器、器材准备及试剂:WZC-Ⅲ泪道治疗仪一套,选用1 mm 探针,头部刮出2 mm 无绝缘层区,兔头固定器,实验用手术器械。 普利灵6-0 可吸收性缝线,5-0 丝 线,BD IntimateⅡ22GA1.0 型 静 脉 留 置针,穿刺端剪平备用。 20%乌拉坦溶液[上海恒远生物科技有限公司,申药字(2010)070031582];0.5%丙美卡因滴眼液(进口药品注册证号:H2009008.2)。 光学显微镜 (日本Olympus,BX-51);Motic 数字切片扫描系统;德国Leica-RM 2245 切片机。
实验动物:取无溢泪、无面部异常的2 月龄健康纯种新西兰大白兔25 只(由中山大学动物实验室提供),体重2.0~2.5 kg,雌雄兼用。
1.2 方法
泪道阻塞模型的制作:使用带少许荧光素钠的生理盐水注射液冲洗双眼泪道证实通畅后,新西兰大白兔适应性饲养1 周。 结合兔泪道高频电灼方法[10]对新西兰大白兔用20%乌拉坦溶液,按5 mL/kg 耳缘静脉麻醉,并用0.5%丙美卡因结膜表面麻醉3 次后,眼部消毒,沿裂隙状泪点适当剪开泪囊至可直视鼻泪管泪囊开口,将探针探入1 侧眼鼻泪管泪囊开口处2~3 mm,方向指向同侧上切牙牙冠顶端,20 W 功率通电后适当旋转并摇摆,通电10 s,完成后予6-0 可吸收缝线缝合鼻泪管泪囊开口处1 针, 制作鼻泪管阻塞模型。术后兔饲养1 周左右,出现溢泪及溢脓症状,此时使用不带针头的针管直接对鼻泪管口冲洗,冲洗液带少许荧光素钠,手术侧冲洗不通,对侧眼通畅即考虑鼻泪管阻塞模型建立成功。鼻泪管阻塞模型建立成功后继续观察1 周,准备置管术前每只兔予氯霉素眼药水双眼点眼,4 次/d,共3 d,控制泪囊炎症。
置管及固定方法:同样用乌拉坦全身麻醉及丙美卡因结膜表面麻醉,用泪道探针自鼻泪管泪囊开口处沿鼻泪管走行方向探入6 mm 后, 将剪平穿刺端的5号静脉留置针植入已探通的鼻泪管内8 mm, 拔出针芯,泪囊内暴露2 mm 左右的留置针套管,剪掉多余部分,5-0 丝线缝合固定于泪囊壁, 缝合尽量达骨质表面骨膜并加宽针距,防止脱落。 泪道冲洗证实通畅后,置管完成。
拔管方法:置管2 周后,丙美卡因结膜表面麻醉后,固定器内固定兔头,剪线并拔管,支架管拔出后立即行泪道冲洗,判断鼻泪管是否通畅。 拔管后予氯霉素眼药水双眼点眼,4 次/d,共1 周(1 周内处死的动物处死前用药)。
对照与分组:采用自身对照方法,左右眼随机分为实验组及对照组,实验组制作泪道阻塞模型,植入静脉留置针作为支架管,对照组适当剪开泪囊后不做任何处理。分别于拔管后0(即拔管当天)、3、7、14、28 d处死5 只。
观察项目:观察建模成功后,泪道置管后及拔管后兔的临床表现。 采用麻醉后放血法处死兔,自睑裂到口裂剪开皮肤皮下,暴露上颌骨、前颌骨及部分颧骨,自上颌骨口侧咬开骨质,取出两侧鼻泪管近泪囊侧的部分。与鼻泪管走行垂直方向切片,苏木精-伊红(HE)染色后,采用光镜观察泪囊结合部位管壁组织病理特点,使用数字切片观察鼻泪管管壁的相对厚度(以下简称“管壁厚度”),每平方毫米成纤维细胞数量(以下简称“细胞密度”),增殖细胞核抗原(PCNA)染色后观察成纤维细胞PCNA 阳性率。
量化方法:切片扫描系统将切片扫描后,结合瘢痕增生指数的计算方法[11],采用低倍视野下(2×)用直尺测量鼻泪管的最大直径及与之垂直方向上的最大直径,两者的平均值为A,相应方向上管腔直径的平均值为B,以1-A/B 作为鼻泪管管壁厚度。 高倍视野下(20×)观察随机5 个0.1 mm×0.2 mm 网格内的成纤维细胞数乘以10,代表每平方毫米成纤维细胞密度,只计数成纤维细胞,剔除血管内皮细胞、中性粒细胞、淋巴细胞、脂肪细胞、上皮细胞等。 成纤维细胞PCNA阳性率同样只计数成纤维细胞,计数阳性率最高5 个0.1 mm×0.2 mm 网格内的成纤维细胞数量和其中的阳性细胞数量,计算其阳性率。
1.3 统计学方法
采用SPSS 19.0 统计软件对数据进行分析和处理,计量资料以均数±标准差()表示,采用t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 临床表现
建模成功的鼻泪管阻塞眼,均有溢泪,泪道冲洗不通,但分泌物较少,经抗生素眼液治疗炎症容易控制。 泪道置管后溢泪症状逐渐减轻,1 周后均无溢泪,拔管后泪道冲洗通畅。 支架管拔出后观察0、3、7、14、28 d 实验兔均无溢泪。
2.2 病理变化
对照组鼻泪管组织黏膜下层往往有较多海绵状血管组织 (图1), 而实验组海绵状血管组织相对较少,胶原纤维相对较多,以7 d 时最为明显(图2)。 实验组及对照组淋巴滤泡样组织均较少见。黏膜层均较完整,未见明显上皮脱落。
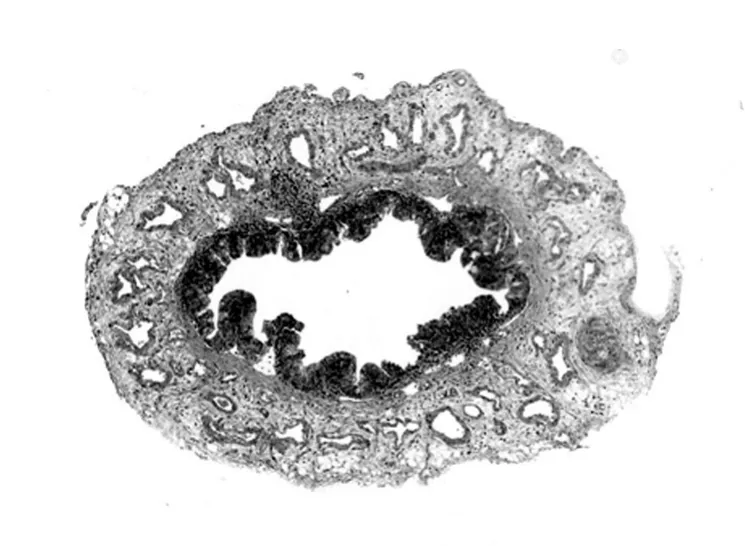
图1 对照组的病理学改变(HE 染色,20×)

图2 实验组7 d 时的病理学改变(HE 染色,20×)
2.3 两组拔管后不同时间管壁厚度的变化
拔管7 d 时, 实验组管壁厚度明显大于对照组,差异有统计学意义(P <0.05)。 对照组管壁厚度不同时间点比较,差异无统计学意义(均P >0.05)。 实验组7 d 时管壁厚度与0 d 时比较,差异有统计学意义(P <0.05)。 见表1。

表1 两组拔管后不同时间管壁厚度的变化(±s)
2.4 两组拔管后不同时间成纤维细胞密度的变化
拔管7 d 时, 实验组成纤维细胞密度明显高于对照组,差异有统计学意义(P <0.05)。 对照组成纤维细胞密度不同时间点比较, 差异均无统计学意义(均P >0.05)。 实验组7 d 时的成纤维细胞密度与0、14、28 d 时比较,差异均有统计学意义(P <0.05)。见表2。
表2 两组拔管后不同时间成纤维细胞密度的变化(细胞数/mm2,)

表2 两组拔管后不同时间成纤维细胞密度的变化(细胞数/mm2,)
注:与对照组比较,*P <0.05;与实验组7 d 时比较,△P <0.05
组别 0 d 组 3 d 组 7 d 组 14 d 组 28 d 组实验组对照组1294±132△1308±123 1414±115 1274±166 1774±243*1330±173 1336±107△1298±120 1324±182△1304±133
2.5 两组拔管后不同时间成纤维细胞PCNA 阳性率的变化
拔管3 、7 d 时, 实验组与对照组成纤维细胞PCNA 阳性率比较,差异均有统计学意义(P <0.05)。对照组成纤维细胞PCNA 阳性率在不同时间点差异无统计学意义(均P >0.05)。 实验组3 d 时的成纤维细胞PCNA 阳性率与0 、14、28 d 时比较, 差异有高度统计学意义 (P <0.01);7 d 与14 d 成纤维细胞PCNA 阳性率比较,差异有统计学意义(P <0.05)。 见表3。
表3 两组拔管后不同时间成纤维细胞PCNA 阳性率的变化(%,)

表3 两组拔管后不同时间成纤维细胞PCNA 阳性率的变化(%,)
注:与对照组比较,*P <0.05;与实验组3 d 时比较,△P <0.01;与实验组7 d 时比较,▲P <0.05
组别 0 d 组 3 d 组 7 d 组 14 d 组 28 d 组实验组对照组16.08±3.08△14.32±3.32 31.14±9.62*15.48±3.69 24.14±5.23*15.56±3.12 17.02±5.44△▲15.52±5.25 14.30±3.32△14.10±4.08
3 讨论
3.1 兔是鼻泪管阻塞研究较好的实验动物
兔可作为鼻泪管阻塞研究的实验动物[12-13],其鼻泪管骨内段虽然走行较直,但骨壁较薄,极易形成假道。 本实验探通时选择直视鼻泪管泪囊开口,且仅探入8 mm,同时注意手法轻柔,保证不形成假道。
兔泪点为泪滴状,而非圆形,泪道冲洗时较易反流。在鼻泪管电灼、缝合和探通时,必须将泪囊自泪点开始剪开,否则极易形成假道或操作无法完成。 泪囊剪开后,无法采用常规7 号针头行泪道冲洗,本实验采用针管直接对鼻泪管口冲洗,冲洗液中加少量的荧光素钠能直观地反映鼻泪管是否通畅,同时避免假道形成。
3.2 鼻泪管阻塞的动物模型特点
尽管Rehorek 等[12]、胡文学等[13]认为兔鼻泪管骨内段的解剖组织结构与人体相似,可作为人鼻泪管研究的动物模型,但鼻泪管阻塞的动物模型较难建立。 预实验时采用搔刮后注入硬化剂的方法成功率较低(1/4),改用低能量电灼加可吸收缝线缝扎法成功率达100%,但自然状态下存在泪囊炎的兔,80%存在牙咬合不良[14]。 因兔的鼻泪管下段(鼻内段)与上中切牙相邻且较为狭窄,推测咬合不良可导致鼻泪管下段损伤,进而阻塞及感染,发生泪囊炎[14]。 本研究模拟的人阻塞模型的阻塞部位位于鼻泪管泪囊开口处,与兔自然状态下存在的泪囊炎(鼻泪管阻塞)其阻塞部位位于鼻泪管下段不同。 同时因为阻塞部位较高,阻塞部位以上的泪道死腔仅局限于泪囊。 兔第三眼睑发达,泪囊位于第三眼睑下,瞬目反射挤压泪囊概率较大, 同时兔泪囊被部分切开,泪囊内潴留的泪液容易反流排出,因而泪囊炎症反应较轻,分泌物少。 适当抗生素眼药局部应用,炎症易于控制。
3.3 拔管后存在增殖期
置管治疗兔鼻泪管阻塞的疗效较好, 治愈率为100%,拔管后阻塞均没有复发,考虑与制作的阻塞模型阻塞部位的长度较短、置管相对较粗有关。 拔管当天, 实验组与对照组管壁厚度与成纤维细胞密度相似,考虑实验选用的置管材料直径较为合适,同时与组织相容性好,对组织的影响较小。 拔管7 d 后,成纤维细胞数量达到最多,之后逐渐下降,考虑解除置管压迫后,阻塞部位的成纤维细胞增殖在一段时间内会较活跃。PCNA 在G0~G1 期细胞中无明显表达,在G1晚期,其表达大幅度增加,S 期达到高峰,其量的变化与DNA 合成一致, 可作为评价细胞增殖状态的一个敏感指标[15-17]。成纤维细胞PCNA 阳性率拔管后3 d明显升高,14 d 后逐渐下降, 同样提示拔管后存在成纤维细胞的增殖。如阻塞的部位较长,置管相对较小,拔管损伤了黏膜上皮,拔管后成纤维细胞的增殖未得到有效控制,拔管后复发的概率将大大增加。 兔鼻泪管骨内段与人鼻泪管组织结构相似, 临床泪道置管患者,拔管后可能同样存在成纤维细胞增殖过程,结合兔鼻泪管纤维细胞增殖的规律,拔管后应用2 周左右的抗增殖药是合适的。
总之,泪道置管术后拔管早期,存在明显的成纤维细胞增殖过程,此时适当应用抗增殖药,有望减少拔管后复发的可能性。
[1] Connell PP,Fulcher TP,Chacko E,et al. Long term follow up of nasolacrimal intubation in adults[J].Br J Ophthalmol,2006,90(4):435-436.
[2] 张敬先,邓宏伟,颜波,等.新型泪道逆行插管术治疗鼻泪管阻塞[J].中华眼科杂志,2007,43(9):806-808.
[3] Memon MN,Siddiqui SN,Arshad M,et al.Nasolacrimal duct obstruction in children:outcome of primary intubation [J].J Pak Med Assoc,2012,62(12):1329-1332.
[4] Dotan G,Ohana O,Leibovitch I,et al. Early loss of monocanalicular silicone tubes in congenital nasolacrimal duct obstruction:incidence,predictors,and effect on outcome[J]. Int J Pediatr Otorhinolaryngol,2015,79(3):301-304.
[5] Andalib D,Mansoori H.A comparison between monocanalicular and pushed monocanalicular silicone intubation in the treatment of congenital nasolacrimal duct obstruction [J].Int J Ophthalmol,2014,7(6):1039-1042.
[6] Wang X,Bian Y,Yan W,et al.Endoscopic endonasal dacryocystorhinostomy with ostial stent intubation following nasolacrimal duct stent incarceration[J].Curr Eye Res,2014,11(12):1-10.
[7] Sabermoghaddam AA,Hosseinpoor SS. Preventing silicone tube extrusion after nasolacrimal duct intubation in children [J]. J Ophthalmic Vis Res,2010,5(4):280-283.
[8] Al-Faky YH,Mousa A,Kalantan H,et al. A prospective,randomised comparison of probing versus bicanalicular silastic intubation for congenital nasolacrimal duct obstruction [J]. Br J Ophthalmol,2015,99(2):246-250.
[9] Kashkouli MB,Pakdel F,Kiavash V. Assessment and management of proximal and incomplete symptomatic obstruction of the lacrimal drainage system [J]. Middle East Afr J Ophthalmol,2012,19(1): 60-69.
[10] 胡文学,张晓农,白蒙.易贝滴眼液对兔泪道高频电灼术后愈合过程的影响[J]. 眼视光学杂志,2004,6(3):161-164.
[11] 曹为,王萍.黑布药膏对兔耳瘢痕疙瘩模型瘢痕增生指数及成纤维细胞数密度和胶原纤维面密度的影响[J].中国中医基础医学杂志,2010,16(12):1133-1135.
[12] Rehorek SJ,Holland JR,Johnson JL,et al. Development of the lacrimal apparatus in the rabbit (oryctolagus cuniculus) and its potential role as an animal model for humans [J]. Anat Res Int,2011:623186.
[13] 胡文学,张晓农,白蒙.兔鼻泪管解剖学实验研究[J].华中科技大学学报,2004,43(2):210-212.
[14] Marini RP,Foltz CJ,Kersten D,et al. Microbiologic,radiographic,and anatomic study of the nasolacrimal duct apparatus in the rabbit (Oryctolagus cuniculus) [J]. Lab Anim Sci,1996,46(6):656-662.
[15] Gerits N,Johannessen M,Tümmler C,et al. Agnoprotein of polyomavirus BK interacts with proliferating cell nuclear antigen and inhibits DNA replication [J]. Virol J,2015,12(1):7-9.
[16] Li H,Luo K,Hou J.Inhibitory effect of Puerariae radix flavones on platelet-derived growth factor-BB-induced proliferation of vascular smooth muscle cells via PI3K and ERK pathways [J]. Exp Ther Med,2015,9(1):257-261.
[17] Pramod R,Pandit S,Desai D,et al. Immunohistochemical assessment of proliferating cell nuclear antigen protein expression in plaque,reticular and erosive types of oral lichen planus [J].Ann Med Health Sci Res,2014,4(4):598-602.
