杭州市狭叶小羽藓遗传多样性研究
2015-03-20陆文怡潘江杰张晓勤吴玉环薛大伟
陆文怡,张 军,潘江杰,张晓勤,吴玉环,薛大伟
(1.杭州师范大学生命与环境科学学院,浙江 杭州310036;2.山东省蒙阴第一中学,山东 蒙阴276200)
当前,生物多样性保护己经引起各国政府的高度重视,生物多样性包括其组成、分布、结构和功能.遗传多样性是生物多样性的重要组成部分,是地球上所有生物携带的遗传信息的总和,是生态系统多样性和物种多样性的基础.
狭叶小羽藓(H.angustifolium)隶属于羽藓科(Thuidiaceae)小羽藓属(Haplocladium).狭叶小羽藓多着生背阴湿润的草丛下具土岩面、腐木或树干基部,其植物体较大,呈羽状分支、交织状匍匐延伸,是良好的环境污染的指示植物[1-2,11].关于杭州市苔藓植物的报道,最早可追溯到1931年,国内学者也曾在杭州市进行苔藓植物采集,但未见关于不同生境下苔藓遗传多样性的研究.苔藓植物分子遗传多样性研究国际上起步较晚,国内涉及较少.
本研究以杭州市不同生境下狭叶小羽藓为实验材料,用ISSR、RAPD、SRAP等分子标记研究不同居群狭叶小羽藓遗传多样性差异,分析其与环境因子的关系,为苔藓植物在不同生境条件下的居群分子遗传多样性研究提供基础资料.
1 材料与方法
1.1 材料
本实验采集杭州市不同生境下的狭叶小羽藓居群,编号并保存.所采材料编号及生境见表1.
1.2 DNA提取及PCR 扩增
取新鲜的狭叶小羽藓植物体枝条,用无菌水冲洗,除去泥土等杂质,用75%的乙醇浸泡5 min后取出,用无菌水冲洗干净.将植物体放入研钵中加入液氮充分研磨后移至1.5 ml离心管.分别用SDS法,CTAB法和CTAB-Free法提取狭叶小羽藓DNA.
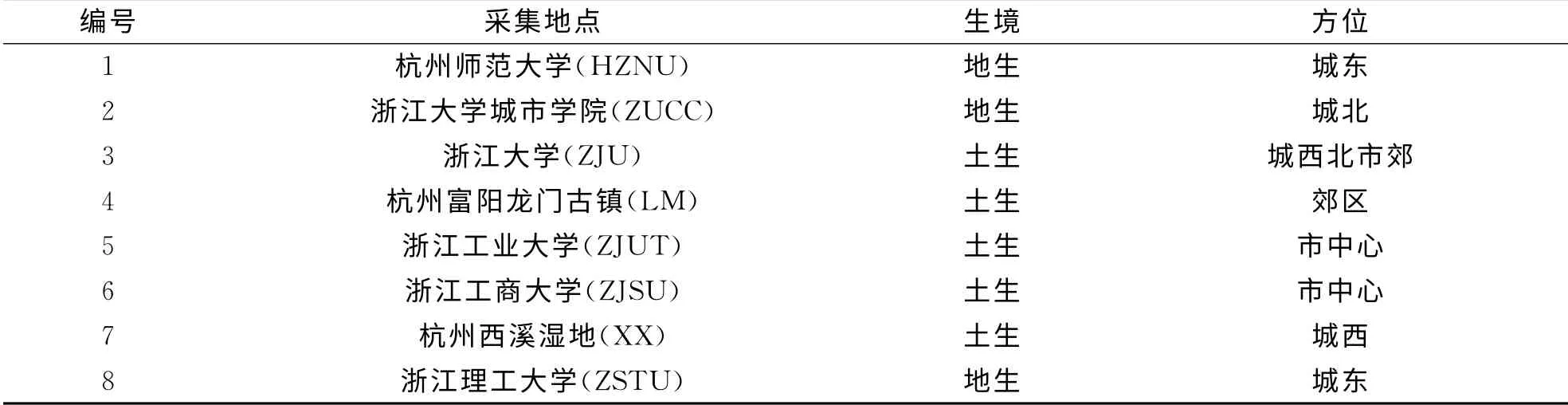
表1 狭叶小羽藓材料来源Tab.1 The source of H.angustifolium
PCR 总反应体系20μL,模板DNA 1μl,2×Taq Master Mix 10μl(购自SinoBio公司),引物2μl,dd H2O 7μl.RAPD-PCR反应热循环程序为:95 ℃4 min;94 ℃30 s,38 ℃45 s,72 ℃90 s,39个循环;72 ℃延伸7 min,4 ℃保存.SRAP-PCR 反应热循环程序为:95 ℃4 min;94 ℃30 s,40 ℃45 s,72℃90 s,38个循环;72 ℃延伸7min,4 ℃保存.ISSR-PCR 反应热循环程序为:95 ℃5 min;94 ℃60 s,53℃40 s,72℃90 s,9个循环;94℃60 s,48℃40 s,72℃90 s,34个循环;72℃延伸7 min,4℃保存.PCR 产物用新型染料Dured染色,在1.2%的琼脂糖凝胶上检测,120 V 下电泳1 h.
1.3 数据统计与分析
琼脂糖凝胶电泳获得图谱,根据各条谱带的有无统计得到所有位点的二元数据:有DNA 扩增带的记为1(强带和弱带均记为1),无带的记为0.将ISSR、SRAP、RAPD 三种标记所得数据分别输入EXCEL中,并建立相对应的原始表征数据0-1矩阵.利用POPGENE v.1.31程序,计算分析居群遗传多样性指数.用算术平均数的非加权成组配对法(unweighted pair-group method using arithmetic average,UPGMA)对居群间的遗传距离进行聚类分析,使用的软件为NTSYS-pc software 2.0.
2 结果
2.1 苔藓DNA提取方法的优化
将三种DNA 提取方法进行比较,采用SDS法提取的DNA 虽然含量较高,但其中含有较多的多酚类物质.而CTAB法优点是提取的DNA 较纯,含有杂质少,但得到的DNA 含量很少.CTAB-Free法在加入CTAB抽提液之前加入CTAB-Free缓冲液,从而去除了总DNA 中大部分杂质,采用这种办法提取的DNA 条带清晰明亮.
2.2 SRAP、ISSR、RAPD 引物的筛选
本实验从50条ISSR 随机引物中筛选出11 条引物;90 条RAPD 引物中筛选出12 条引物;20 对SRAP引物全部用于扩增反应.这些引物在居群中都具有良好的多态性,11条ISSR 引物共扩增出27条带,平均每个引物扩增出2.45条带;12条RAPD 引物共扩增33条带,平均每个引物扩增出2.75条带;20对SRAP引物共扩增出67条带,平均每对引物扩增出3.35条带.因此共有43个引物检测到127条带,平均每个引物扩增出2.95条带.扩增片段长度范围为260~1700 bp(图1).
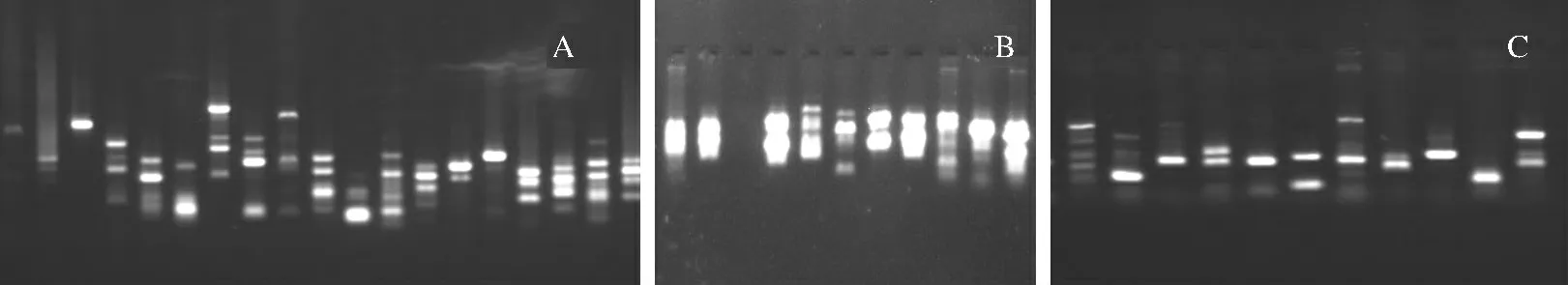
图1 ISSR(A)、RAPD(B)、SRAP(C)引物的扩增结果Fig.1 PCR results of ISSR(A)、RAPD(B)、SRAP(C)
2.3 遗传多样性分析
对杭州市不同生境下8个居群间的遗传多样性分析表明:居群间的遗传分化为35.98%.居群间的遗传一致度(I)为0.3038~0.7658,平均值0.5305±0.033.说明杭州市狭叶小羽藓居群间表现出较高的遗传多样性.
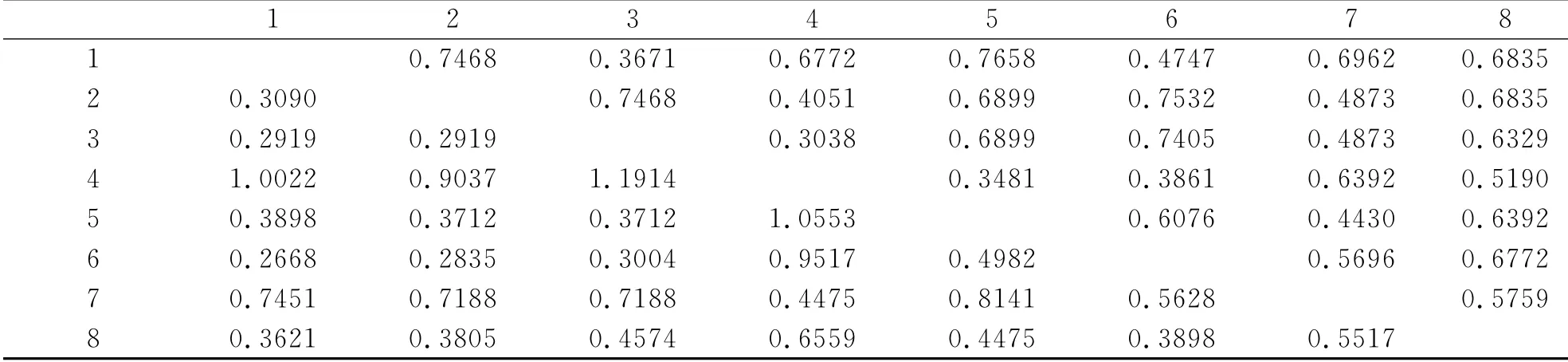
表2 杭州市8个狭叶小羽藓居群间的遗传一致度和遗传距离Tab.2 The genetic consistency and genetic distance in between eight populations of H.angustifolium in Hangzhou
不同生境下8个居群的遗传距离通过UPGMA 聚类分析得到树状图(图2).由聚类图可以看出8个居群可分为两大类,其中4(LM)和7(XX)在一个进化分支上,而1(HZNU)、2(ZUCC)、3(ZJU)、5(ZJUT)、6(ZJSU)和8(ZSTU)位于另外一个分支上,其中1(HZNU)和6(ZJSU),2(ZUCC)和3(ZJU)有较近的亲缘关系.

图2 8个狭叶小羽藓居群间遗传距离UPGMA树状图Fig.2 Genetic distance UPGMA tree in between eight H.angustifolium
3 讨论
生物多样性保护的关键之一就是保护物种,更具体地说就是保护物种的遗传多样性和进化潜力,种内遗传多样性或变异性越丰富,物种对环境变化的适应能力就越大,其进化的潜力就越大,有助于保护物种和整个生态系统的多样性,或可以减慢由于适应和进化所导致的灭绝过程[5].本文以杭州市不同生境下8个狭叶小羽藓巨群为实验材料,优化了苔藓DNA 提取的方法,运用ISSR、RAPD、SRAP等技术研究不同居群狭叶小羽藓遗传多样性差异.
根据三种不同的DNA 提取方法可以得出:改良后的CTAB-Free提取法使提取的基因组DNA 纯度得到了有效的提升,PCR 效果最好,条带明显、清晰,因此采取CTAB-Free法提取苔藓植物的基因组DNA 较好.CTAB-Free法改进是在CTAB提取液加入前先加入CTAB-Free缓冲液,抽提出其中的杂质,离心后去掉上清,加入CTAB(含β-巯基乙醇),β-巯基乙醇可以有效的抑制酚类物质使DNA 褐变.这种方法提取的DNA 浓度和纯度均比较高,凝胶电泳显示无明显降解现象.
采用筛选出的引物对DNA 样品进行PCR 扩增,结果表明不同分子标记的扩增效果存在一定差异(图1),ISSR 与SRAP的扩增效果较RAPD 好,其中ISSR 的15对引物中成功扩增出的有8条,SRAP引物可成功扩增出全部DNA 样品,RAPD 引物8对中仅2对能扩增出条带,并且ISSR 与SRAP的引物扩增条带清晰,无明显拖尾现象,便于观察与统计.而RAPD 引物扩增条带则很模糊,这将造成数据处理的误差,从而导致结果不准确.根据以上实验结果分析,这三种分子标记中,最适于苔藓植物的分子标记为ISSR 与SRAP,RAPD 标记效果较差可作为补充引物进行实验.
植物的遗传多样性水平不一定与其地理分布的范围具有必然联系,它还与类群的起源、进化历史、生殖特点、生物特性、环境条件等很多因素有关[3].Gregory等[4]用等位酶分析金发藓(Polytrichumcommune)的遗传多样性时发现居群间具有较高的遗传多样性,认为是孢子的散发受到了限制的缘故.李朝阳等[6]采用RAPD 技术对梵净山的尖叶拟船叶藓(Dolichomitriopsisdiversiformis)14个居群进行遗传多样性分析发现,居群间遗传多样性较高,分析可能是尖叶拟船叶藓的遗传多样性受小生境的影响较大,遗传漂变和环境适应可能是影响居群分化的主要原因.刘丽等[7]在分析鼠尾藓(Myurocladamaximowiczii)的遗传多样性时发现不同居群间的遗传距离和空间距离在一定范围内存在一定的相关性,但如果生存小环境相似,即使空间位置相距较远,也可能在分子水平上具有较高的相似性.而李倩影等[8]对上海市狭叶小羽藓居群进行遗传多样性和遗传分化分析,初步发现小羽藓种群表现出较高的遗传多样性,居群间的变异程度远远大于居群内的变异程度,其主要原因是有限的基因流导致种群间出现较大的遗传分化.本实验研究结果与前人的研究结果基本一致,杭州市8个狭叶小羽藓居群间的遗传分化为35.98%,遗传一致度为0.5305,表现出较高的遗传多样性,这可能与其居群间的基因流有关,由于狭叶小羽藓的孢子扩散是居群间基因流动的主要方式,孢子扩散受阻,就会导致居群间的基因交流受阻,从而导致居群间分化程度明显,遗传多样性较高.
研究表明,居群间的遗传分化与环境因子的选择和基因流的阻隔有关,而生态小环境的变异也可能导致不同种群间在遗传结构上的差异[6-7,10].从表1和图2中可以看出,人为干扰较大的6个居群(均位于市区的6所大学)遗传距离相对较近,聚类图上反映的是它们聚在一起;而两个生态环境较好的居群,富阳龙门古镇(LM)和西溪湿地(XX),与上述6个居群遗传关系较远,二者聚为一类,虽然二者空间距离较远,可能是由于这两个居群为了适应独特的、类似的小生境而产生了适应性变异,导致这两个居群与其他居群间的分化更为强烈,这也说明生境与基因互作导致的适应性变异可能是影响居群分化的主要原因之一.
[1]安丽,曹同,俞鹰浩.上海市小羽藓属植物重金属含量及其与环境的关系[J].应用生态学报,2006,17(8):1490-1494.
[2]崔明昆.附生苔植物对城市大气环境的生态监测[J].云南师范大学学报:自然科学版,2001,21(3):54-57.
[3]葛颂.酶电泳资料和系统与进化植物学研究综述[J].武汉植物学研究,1994,12(1):71-84.
[4]Derda G S,Wyatt R.Levels of genetic variation and its partitioning in the wide-ranging mossPolytrichumcommune[J].Systematic Botany,1999,24:512-528.
[5]中国科学院生物多样性委员会.生物多样性研究的原理与方法[M].北京:中国科学技术出版社,1994.
[6]李朝阳,李菁,田向荣,等.梵净山尖叶拟船叶藓的遗传多样性分析[J].植物分类与资源学报,2008,30(2):168-172.
[7]刘丽,朱永青,王幼芳.鼠尾藓不同居群间形态及RAPD分析[J].云南植物研究,2006,28(6):570-574.
[8]李倩影,曹同,于晶,等.不同种群狭叶小羽藓(Haplocladiumangustifolium)重金属含量及遗传多样性[J].上海师范大学学报:自然科学版,2010,39(2):194-199.
[9]Rohlf F J.NTSYS-pc 2.0 Numerical Taxonomy and Multivariate Analysis System[M].New York:Exeter Software,1998.
[10]Turkington R,Harper J L.The growth,distribution and neighbour relationships ofTrifoliumrepensin a permanent pasture:I.Ordination,pattern and contact[J].Journal of Ecology,1979,67:201-218.
[11]吴鹏程.苔藓生物学[M].北京:科学出版社,1998.
