不同抗原诱导后小鼠调节性T 淋巴细胞趋化特性动态研究①
2015-03-18叶艾竹骆姝琳刘水和
郭 音 李 伟 叶艾竹 安 宇 骆姝琳 刘水和 袁 军
(贵州省贵阳医学院免疫学教研室,贵阳 550004)
CD4+CD25+调节性T 细胞(Regulatory T cell,Treg)是重要的免疫调节细胞,可以特异性抑制活化T 细胞功能[1],且该抑制作用没有MHC 限制性,无论是捐献者或是第三方的Treg 都可以抑制效应性CD4+T 细胞和CD8+T 细胞的活化[2]。Treg 细胞作为潜在工具细胞防止移植排斥发生,引起移植免疫学研究的关注。Treg 细胞在皮肤同种异体移植物排斥反应的独特能力,更证实了这一特点[3]。Treg 细胞需要游走至移植局部方能发挥作用,然而目前,对器官移植后趋化因子在体内介导CD4+CD25+Treg 细胞定向游走的机制尚未完全了解。因此,本项目旨在探索不同抗原诱导后趋化因子受体CCR4、CCR6 在Treg 细胞上的表达情况,并在体外观察抗原诱导后Treg 细胞的趋化特性,以期为CD4+CD25+Treg 细胞定向游走机制提供线索。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级近交系,BALB/c(H-2d)和C57BL/6(H-2b)雌性小鼠,6~8 周龄,体重18~20 g,购于重庆滕鑫生物技术有限公司。
1.1.2 主要试剂 卡介苗;荧光标记抗体:Percp-AntiCD4、FITC-AntiCD25、PE-AntiCD127(BD 公司);趋化因子:MIP-3alpha(CCL20),MDC(CCL22)(Pep roTech 公司);趋化因子受体:Alex Flour 647-AntiCCR4,Alex Flour 647-AntiCCR6(Biolegend 公司);小鼠淋巴细胞分离液;趋化结合液(Binding medium,BM)(1640 500 ml,胎牛血清白蛋白5 g,青、链霉素各5 万单位,HEPES 3.6 g,谷胺酰胺1.5 g),利用配好的BM 液,据试剂盒提供IC50 值,配制各趋化因子工作液,分装并保存于-20℃。配制过程中所有操作均在冰浴环境进行。
1.1.3 主要仪器 FACS AriaTM流式细胞仪(BD 公司);BILON-R1200 型非接触式超声细胞粉碎机(上海比郎仪器有限公司)。
1.2 方法
1.2.1 C57BL/6 小鼠皮肤抗原的制备 颈椎脱臼处死C57BL/6 小鼠,剃去其背部毛发。取背部皮片,生理盐水洗3~4 次,剪碎研磨后,用超声细胞粉碎机做超声匀浆6 个循环(0.5 Kw,0.6 秒1 个循环),制成皮肤抗原悬液。用200 目灭菌滤网过滤后分装,-20℃冻存备用。紫外分光光度法测定蛋白质含量,按以下公式计算[4]:蛋白质浓度(mg/ml)=1.45A280 -0.74A260,(A260 和A280 分别为蛋白质溶液在260 和280 nm 处测得的吸光度值,代入公式测得皮肤抗原的蛋白质浓度为1.033 mg/ml)。
1.2.2 Treg 的体内抗原诱导
1.2.2.1 皮肤抗原诱导 分为四组,每组3 只BALB/c 小鼠。每只小鼠腹腔注射皮肤抗原悬液1 ml(C57BL/6 小鼠皮肤抗原)。诱导后第1、2、3、4周颈椎脱臼处死小鼠,取脾脏分离单个核细胞,做趋化试验并利用流式细胞术检测Treg 细胞趋化因子受体的表达情况。
1.2.2.2 卡介苗诱导 分组同上,每只小鼠腹腔注射卡介苗活菌液体(17.4 ×104活菌/只)[5]。诱导后第1、2、3、4 周处死小鼠,取脾脏分离单个核细胞,做趋化试验并利用流式检测Treg 趋化因子受体的表达情况。
1.2.2.3 灭菌生理盐水组 分组及处理同上,每只小鼠腹腔注射0.5 ml 灭菌生理盐水(0.9%NaCl),作为对照组。
1.2.3 脾脏单个核细胞悬液的制备 颈椎脱臼法处死小鼠,用75%酒精消毒小鼠胸腹部,无菌操作取出脾脏,去除脂肪及结缔组织。加入1 ml 灭菌生理盐水,剪碎研磨脾脏。用200 目滤网过滤后,1 500 r/min 离心5 min,弃上清,加入1 ml Hank's 液制备细胞悬液。取1 ml 小鼠淋巴细胞分离液,沿管壁缓缓加入上述细胞悬液,保持界面清晰。水平离心机,1 500 r/min 离心20 min,离心后小心吸取中间白膜层,即为小鼠单个核细胞层。
1.2.4 趋化因子受体的检测 加入100 μl 脾脏单个核细胞悬液(含1 ×106个单个核细胞),流式抗体试剂Percp-AntiCD4,FITC-AntiCD25,PE-AntiCD127,Alex Flour-AntiCCR4 或Alex Flour-AntiCCR6 各2 μl,到入流式绝对计数管中,避光染色30 min,用流式细胞仪进行不同诱导组趋化因子受体CCR4、CCR6 的检测。
1.2.5 趋化试验 将5 μm 孔径的TransWell 上室移开,下室按照试验设计方案加入600 μl 趋化因子工作液或BM 液对照。小心盖上TransWell 上室,每孔加入100 μl 细胞悬液(含1 ×106个单个核细胞)放入细胞培养箱孵育4 h。混匀下室细胞,用流式细胞仪对穿膜细胞作绝对计数,按以下公式计算趋化指数:趋化指数=(穿膜细胞数/自然穿膜细胞数)×100%[6]。
1.3 统计学分析 结果用SPSS11.5 软件进行统计处理。所得结果采用单因素方差分析进行两两比较;P <0.05 或P <0.01 表示有显著性差异或极显著性差异。
2 结果
2.1 趋化因子受体CCR4、CCR6 在Treg 细胞的表达
2.1.1 CD4+CD25-T、CD4+CD25+CD127-T 亚群细胞CCR4 的表达情况 如图1 所示,两种抗原诱导的CD4+CD25-T 细胞在前3 周其表面趋化因子受体CCR4 的表达均随着时间的延长呈下降趋势,到第4 周又有所回升。其中皮肤抗原诱导组CD4+CD25-T 细胞在4 周时平均荧光强度值比3 周有显著性差异(P <0.05),第4 周与第1 周平均荧光强度接近(图1A)。
皮肤抗原诱导的CD4+CD25+CD127-T 细胞CCR4 的表达在前3 周随时间的延长呈缓慢下降趋势,而到第4 周时平均荧光强度值升高且与前3 周相比具有统计学意义(P <0.05)。卡介苗和生理盐水诱导的CD4+CD25+CD127-T 细胞CCR4 的表达在各时间点均无显著变化(P >0.05)(图1B)。
2.1.2 CD4+CD25-T、CD4+CD25+CD127-T 亚群细胞CCR6 的表达情况 如图2 所示,两细胞亚群CCR6 的表达呈现相似的趋势。皮肤抗原诱导组平均荧光强度在2 周达到最高而后呈下降趋势。卡介苗诱导组第4 周时CD4+CD25-T 细胞的表达明显高于前3 周(P <0.05),CD4+CD25+CD127-T 细胞CCR6 表达第2、4 周强于1、3 周。

图1 诱导后CD4 +CD25 -T 细胞和CD4 +CD25 +CD127 -T 细胞表达CCR4 的平均荧光强度Fig.1 Average fluorescence intensity of CCR4 on CD4 +CD25 -T and CD4 +CD25 +CD127 -T cells after induced
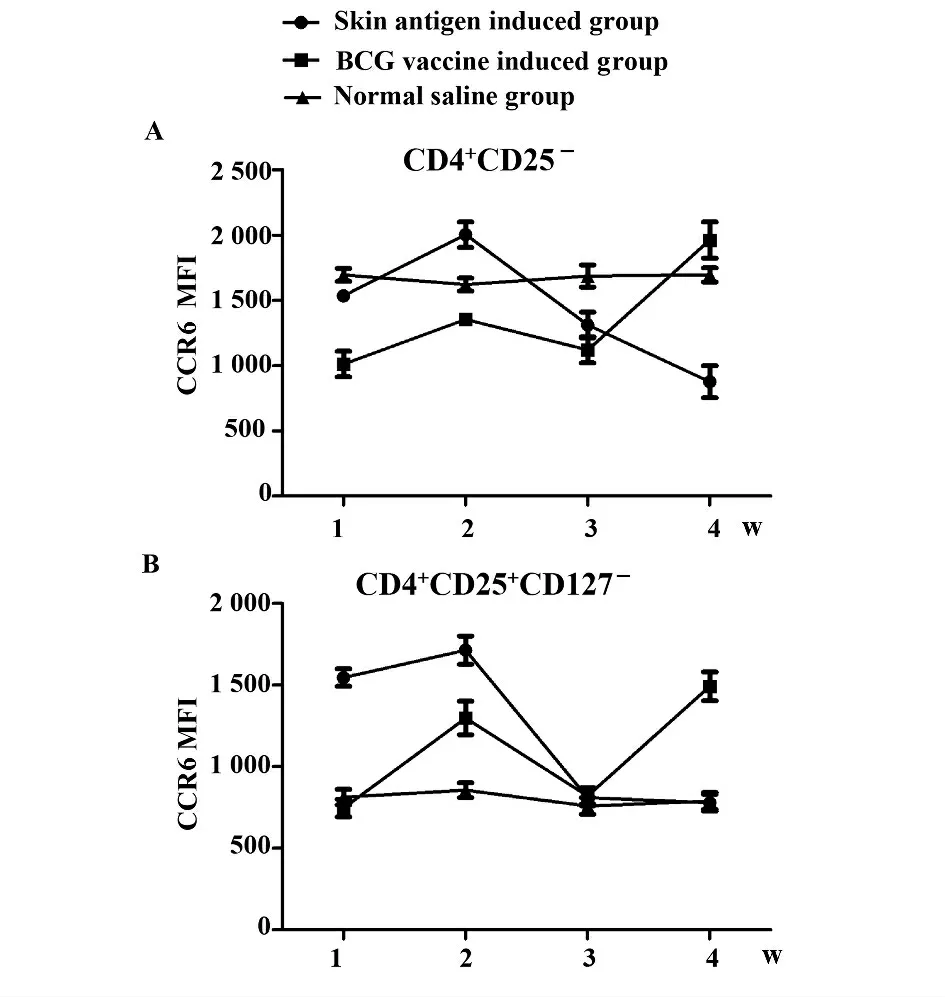
图2 诱导后CD4 +CD25 -T 细胞和CD4 +CD25 +CD127 -T 细胞表达CCR6 的平均荧光强度Fig.2 Average fluorescence intensity of CCR6 on CD4 +CD25 -T and CD4 +CD25 +CD127 -T cells after induced

图3 CCL20 趋化下不同抗原诱导后不同亚群CD4 +T 淋巴细胞的趋化指数动态观察Fig.3 Dynamic observation of chemotactic index of different CD4 +T lymphocytes subsets induced by different antigens by CCL20

图4 CCL22 趋化下不同抗原诱导后不同亚群CD4 +T 淋巴细胞的趋化指数动态观察Fig.4 Dynamic observation of chemotactic index of different CD4 +T lymphocytes subsets induced by different antigens by CCL22
2.2 趋化实验结果
2.2.1 CCL20 趋化下CD4+CD25-T、CD4+CD25+CD127-T 细胞的趋化指数 如图3 所示,皮肤抗原诱导组CD4+CD25-T 细胞趋化指数随时间而升高,而CD4+CD25+CD127-T 细胞2、4 周明显高于1、3周(P <0.05)。卡介苗诱导组CD4+CD25-T 细胞和CD4+CD25+CD127-T 细胞在4 周时的趋化指数要显著高于其他时间点(P <0.05)。
2.2.2 CCL22 趋化下CD4+CD25-T、CD4+CD25+CD127-T 细胞的趋化指数 如图4 所示,皮肤抗原诱导组CD4+CD25-T 细胞前3 周随时间而增高,第3周达高峰;CD4+CD25+CD127-T 细胞的趋化指数在第1 周显著高于CD4+CD25-T 细胞组(P <0.05)。卡介苗诱导组前3 周CD4+CD25+CD127-T 细胞比CD4+CD25-T 趋化指数高(P <0.05),第4 周时各细胞亚群趋化指数变化无统计学意义(P >0.05)。
3 讨论
CD4+CD25+Treg 细胞为调节性T 细胞中目前研究最广泛、功能最确切的一种,鉴于其对效应性T细胞的特异性抑制功能,能否将其运用到移植免疫耐受的诱导,成为我们感兴趣的问题。调节性T 细胞(Treg)在维持免疫稳态中发挥了重要作用,Treg的功能发挥需要其向组织或二级淋巴组织的迁移,Treg 恰当的迁移定位对其免疫抑制功能有效的发挥至关重要。Treg 在移植物局部激活后,在CCR2、CCR4、CCR5 和CCR7 的作用下又会通过输入淋巴管向引流淋巴结迁移,完成整个迁移过程的Treg 才能获得最有效的抑制功能[7,8]。Treg 具有很强的迁移能力,在从血液到移植物局部再引流淋巴结的迁移过程中其功能及表型逐渐成熟,此过程依靠不同趋化因子受体和黏附分子的表达[9]。趋化性细胞因子在正常的免疫系统中对淋巴细胞的迁移、归巢、激活、分化发育及炎症的发生、血管生成、肿瘤生长的过程中起着非常重要的作用,上调趋化因子CCL17 和CCL22 的表达可以增强调节性T 细胞的迁移[10];细胞趋化因子介导的Treg 细胞迁移可以抑制过敏性炎症[11]。体外实验发现成熟的树突状细胞可通过分泌CCR4 配体CCL17 及CCL22 引导CD4+CD25+Treg 细胞游走[12]。Iellem 等[13]在研究中发现CCL17 和CCL22(均为CCR4 的配体)对CD4+CD25+Treg 细胞的趋化特异性较强。CCL20招募的主要是一些抗原提呈细胞,可趋化CCR6 表达细胞向抗原出现的组织部位定向迁移。
为了进一步了解趋化因子受体在Treg 上的表达是否与抗原活化过程有关,以及抗原诱导活化对Treg 趋化特性的影响,我们在小鼠体内利用不同抗原刺激后,分离脾脏单个核细胞,选用CCR4 配体CCL22、CCR6 配体CCL20 进行了趋化实验,动态观察了不同活化状态下,调节性T 细胞在这些趋化因子作用下的趋化特性及CCR4 与CCR6 的表达情况。文献报道了BCG 具有明显的免疫抑制能力,主要是通过增强Treg 的能力,但是关于BCG 对调节性T 细胞的表面趋化因子受体和对CCL20 和CCL22 趋化能力影响的研究并不多。本研究比较了皮肤抗原和BCG 对于调节性T 细胞和效应T 细胞的趋化能力。
从本实验的结果来看,BCG 诱导组效应T 细胞CCR6 的趋化因子受体在第4 周的表达明显上调,趋化指数也在第4 周达到最强。另外,BCG 在第4周明显地增强Treg 细胞CCR6 表达,而且在第4 周Treg 细胞对CCL20 的趋化能力也最强。但是皮肤抗原第4 周Treg 细胞的CCR4 表达水平最高,但是皮肤抗原诱导组在第4 周Treg 细胞的趋化能力却不是最强。皮肤抗原诱导组Treg 细胞的CCR6 第4周表达降低,但是趋化指数却并没有降到最低。而对于效应T 细胞来说,皮肤抗原诱导组并没有随着趋化因子受体CCR4 和CCR6 表达水平的降低使趋化指数也随之降低,趋化指数反而增加。而调节性T 细胞则在第4 周和第2 周的趋化能力一致。因此,提示我们利用皮肤抗原可以在第3 周和第4 周时明显地增强效应T 细胞对CCL20 的趋化能力。CCL20、CCL22 对各组中CD4+CD25+CD127-T 细胞的趋化效率随时间变化有不同趋势,且与细胞表面相应趋化因子受体表达的不完全同步,这说明趋化效率的高低可能与趋化因子受体的活性状态有关,趋化因子受体的活性状态和趋化因子的表达不完全一致。我们将在进一步的实验中探讨其可能存在的相关机制。先前的研究表明CCL20/CCR6 介导着调节性T 细胞的迁移[14,15],CCL22/CCR4 在控制Treg 细胞的迁移方面也具有重要作用[16]。但是本研究发现虽然趋化因子受体的表达升高,但是趋化指数并不一定随着增高,提示我们在趋化实验中趋化指数可能较趋化因子受体表达能更好地反映细胞的趋化能力。
另外,我们还发现CD4+CD25+Treg 细胞趋化特性与抗原性质有关,在接受抗原刺激后,其表面趋化因子受体的表达与趋化能力随时间呈动态变化。皮肤抗原诱导的CD4+CD25+CD127-T 细胞CCR4的表达在前3 周随时间的延长呈缓慢下降趋势,而到第4 周时平均荧光强度值升高,且与前3 周相比具有统计学意义(P <0.05)。两细胞亚群CCR6 的表达呈相似趋势,皮肤抗原诱导组平均荧光强度在2 周达到最高后呈下降趋势。卡介苗诱导组第4 周时CCR6 的表达明显高于第3 周(P <0.05),提示趋化因子受体表达变化与抗原性质有关,不同抗原引起的CD4+T 细胞上趋化因子受体表达不同,若利用CD4+CD25+Treg 诱导耐受则须考虑上述因素。抗原诱导早期CCL22 对Treg 细胞的趋化作用明显,诱导后期CCL20 作用明显。因此,我们可以在皮肤移植中,在皮肤移植部位早期可以利用CCL22 对Treg 细胞进行定向趋化,增强机体对移植皮肤的免疫抑制,降低免疫排斥。而在4 周后,则利用CCL20对Treg 的趋化能力较好,这对我们合理的利用趋化因子在局部增强免疫抑制提供了参考。
本研究表明了不同抗原可以通过调节免疫细胞表面的趋化因子受体来影响其趋化能力。在下一步的实验中,我们需要进一步探讨异体皮肤抗原对不同组织,特别是皮肤组织中趋化因子表达的影响,这对于我们在皮肤移植中合理利用皮肤抗原具有重要意义。
[1]Tang Q,Bluestone JA,Kang SM.CD4+Foxp3+regulatory T cell therapy in transplantation[J].J Mol Cell Biol,2012,4(1):11-21.
[2]Colonna L,Alvarez M,Schneidawind D,et al.Donor requirements for CD4+CD25+FoxP3+regulatory T cells capable of suppressing CD4+and CD8+conventional T cell proliferation and graft versus host disease[J].Blood,2013,122(21):4484-4484.
[3]Issa F,Hester J,Goto R,et al.Ex vivo-expanded human regulatory T cells prevent the rejection of skin allografts in a humanised mouse model[J].Transplantation,2010,90(12):1321-1327.
[4]曹红翠.紫外分光光度法测定蛋白质的含量[J].广东化工,2007,34(8):93-94.
[5]李 睿,刘恩梅,杨锡强,等.新生期小鼠卡介苗接种对脾脏T细胞功能亚群发育的影响[J].中华儿科杂志,2005,43(2):124-127.
[6]袁 军,王树辉,杨永红,等.ConA 刺激对CD4+CD25+调节性T 细胞趋化特性及其表面趋化因子受体CCR4/CCR6 表达的影响[J].中国免疫学杂志,2008,24(7):579-587.
[7]Koreth J,Matsuoka K,Kim HT,et al.Interleukin-2 and regulatory T cells in graft-versus-host disease[J].N Engl J Med,2011,365(22):2055-2066.
[8]Faustino L,da Fonseca DM,Takenaka MC,et al.Regulatory T cells migrate to airways via CCR4 and attenuate the severity of airway allergic inflammation[J].J Immunol,2013,190(6):2614-2621.
[9]Zhang N,Schroppel B,Lal G,et al.Regulatory T cells migrate from the graft to the draining lymph node partially inhibit the allograft rejection[J].Immunity,2009,30(3):458-469.
[10]Riezu-Boj JI,Larrea E,Aldabe R,et al.Hepatitis C virus induces the expression of CCL17 and CCL22 chemokines that attract regulatory T cells to the site of infection[J].J Hepatol,2011,54(3):422-431.
[11]Afshar R,Strassner JP,Seung E,et al.Compartmentalized chemokine-dependent regulatory T-cell inhibition of allergic pulmonary inflammation[J].J Allergy Clin Immunol,2013,131 (6):1644-1652.
[12]Valmori D,Liénard D,Waanders G,et al.Analysis of MAGE-3-specific cytolytic T lymphocytes in human leukocyte antigen-A2 melanoma patients.[J].Cancer Res,1997,57 (4):735-741.
[13]Iellem A,Colantonio L,D'Ambrosio D.Skin-versus gut-skewed homing receptor expression and intrinsic CCR4 expression on human peripheral blood CD4+CD25+suppressor T cells[J].Eur J Immunol,2003,33(6):1488-1496.
[14]Cook KW,Letley DP,Ingram RJ,et al.CCL20/CCR6-mediated migration of regulatory T cells to the Helicobacter pylori-infected human gastric mucosa[J].Gut,2014,63(10):1550-1559.
[15]Yamazaki T,Yang XO,Chung Y,et al.CCR6 regulates the migration of inflammatory and regulatory T cells[J].J Immunol,2008,181(12):8391-8401.
[16]Gobert M,Treilleux I,Bendriss-Vermare N,et al.Regulatory T cells recruited through CCL22/CCR4 are selectively activated in lymphoid infiltrates surrounding primary breast tumors and lead to an adverse clinical outcome[J].Cancer Res,2009,69(5):2000-2009.
