脑胶质瘤患者围手术期外周血树突状细胞亚群变化及意义*
2015-03-15谢明祥刘后银遵义医学院附属医院神经外科贵州遵义5600四川省眉山市仁寿县人民医院神经外科60500蚌埠医学院第一附属医院神经外科安徽蚌埠000
谢明祥,王 伟,刘后银(.遵义医学院附属医院神经外科,贵州遵义 5600;.四川省眉山市仁寿县人民医院神经外科 60500;.蚌埠医学院第一附属医院神经外科,安徽蚌埠 000)
脑胶质瘤患者围手术期外周血树突状细胞亚群变化及意义*
谢明祥1,王 伟2,刘后银3(1.遵义医学院附属医院神经外科,贵州遵义 563003;2.四川省眉山市仁寿县人民医院神经外科 620500;3.蚌埠医学院第一附属医院神经外科,安徽蚌埠 233000)
目的 应用流式细胞分析技术对脑胶质瘤患者围手术期外周血树突状细胞(DC)亚群变化进行分析,探讨其数量、变化规律及不同恶性程度胶质瘤患者免疫功能的差异。方法 检测试验组及对照组DC1、DC2,抽取外周血,应用流式细胞仪检测外周血DC1、DC2。结果 外周血流式细胞仪结果分析,两组DC1/PBMC(外周血单个核细胞)、DC2/PBMC比较,差异有统计学意义(P<0.05)。胶质瘤患者术后早期外周血DC1/PBMC、DC2/PBMC百分比与术前比较有所下降,差异有统计学意义(P<0.05)。脑胶质瘤患者术后晚期外周血DC1/PBMC的百分比高于术后早期,差异有统计学意义(P<0.05)。恶性程度高的胶质瘤患者围手术期DC1/PBMC、DC2/PBMC低于恶性程度低的胶质瘤患者。结论 脑胶质瘤患者与健康人比较,外周血中DC1/PBMC、DC2/PBMC比例下降,表明脑胶质瘤患者较健康人免疫功能降低;胶质瘤患者外周血DC亚群数量与胶质瘤恶性程度呈负相关。
脑胶质瘤; 外周血; 树突状细胞亚群; 围手术期
胶质瘤是颅内最常见的恶性肿瘤,虽然免疫治疗取得一定进展,但疗效不确切。树突状细胞(DC)是体内重要的抗原递呈细胞,能对肿瘤加以识别及对抗,在外周血中含量为白细胞总数的1%。胶质瘤能分泌多种免疫抑制因子和免疫逃逸因子,使宿主的免疫系统对肿瘤抗原无法加以识别,有研究发现,DC能够高表达MHC-Ⅰ和MCH-Ⅱ类分子、共刺激分子和黏附分子,从而克服肿瘤细胞免疫原性弱及共刺激分子和黏附分子表达的缺陷。外科手术可以最大限度地减少胶质瘤的体积,降低胶质瘤分泌的多种免疫抑制因子和免疫逃逸因子的量,改善胶质瘤患者免疫功能。本课题应用流式细胞分析技术,研究胶质瘤患者围手术期外周血DC亚群变化与手术治疗及恶性程度的关系,为脑胶质瘤免疫治疗提供依据,现报道如下。
1 材料与方法
1.1 材料及试剂 试验耗材包括:一般固定液、棉签、纱布、医用消毒液、医用石蜡、乙二胺四乙酸(EDTA)抗凝管、75%医用乙醇等。实验试剂包括:CD123-PE、CD11C-PE、anti-HLA-DR-PECy5(美国BD公司);洗液:磷酸盐缓冲液pH7.43;固定液:1%多聚甲醛(实验室自配);碱性粒细胞、白细胞溶解液STROMATOLYSER-FB、白细胞溶解液STROMATOLYSER-4DL、白细胞染液 STROMATOLYSER-4DS、清洗液CELLCLEAN(日本Sysmex公司)。主要试剂配制:PBS缓冲液、1%多聚甲醛。主要实验仪器及设备:BD-FACB Calibu流式细胞分析仪、振荡混匀器、离心机、石蜡切片机、普通显微镜等。
1.2 方法
1.2.1 分组 试验组患者15例:住院行肿瘤切除术,术后病理学检查确定为脑胶质瘤患者,术前(1 d)及术后(1、3、5、7 d)外周血DC1、DC2细胞百分比。对照组:无相关肿瘤、无免疫性疾病史及无各种过敏史的健康人群组15例,同法进行相关检测。
1.2.2 排除标准 有免疫系统疾病或感染性疾病;60 d内接受放、化疗或使用影响免疫功能的药物;合并肿瘤并发症(肿瘤卒中、脑疝等),手术中输血均不纳入研究对象。所有入组患者均知情同意。
1.2.3 外周血流式细胞术检查 试验组与对照组血样均采用EDTA抗凝管采集2 mL并暂时保存于4 ℃冰箱,采集后的新鲜血样于24 h之内送至本院细胞工程实验室,采用流式细胞仪检测血液中的DC1、DC2,并收集原始数据。
1.2.4 肿瘤患者手术切除肿瘤组织的病理检查 手术中切除的新鲜肿瘤组织经10%甲醛固定,常规石蜡包埋,每个蜡块按照20~40 μm的间隔连续切片,切片厚度4 μm;然后从不同代表平面的10张切片中选取2张进行常规病理HE染色,由病理科协助完成。
1.3 统计学处理 所得数据采用SPSS 17.0软件进行统计学分析,统计方法采用单因素方差分析(one-way ANOVA),组间两两比较采用t检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 健康人群及脑胶质瘤患者组外周血DC1和DC2检测结果 见表1、图1。

表1 健康人群及脑胶质瘤患者组外周血DC1和DC2的检测结果

图1 健康人群与脑胶质瘤患者术前、术后早期、术后晚期DC1/PBMC、DC2/PBMC比较
2.2 不同恶性程度脑胶质瘤患者围手术期外周血DC1和DC2检测结果 见表2、图2。

表2 不同恶性程度脑胶质瘤患者围手术期外周血DC1和DC2检测结果
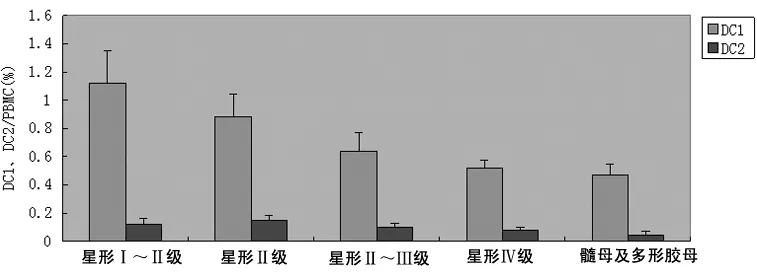
图2 不同恶性程度的脑胶质瘤患者围手术期6次外周血流式细胞仪检测DC1/PBMC、DC2/PBMC比较(%)
3 讨 论
研究表明,脑肿瘤患者的免疫功能与其他肿瘤患者一样,有所降低。在手术切除肿瘤后,降低的免疫功能则逐渐恢复,而当肿瘤复发时,患者的免疫水平又可再次降低。因此,了解脑肿瘤患者的免疫功能状态,对其病情判断和预后有重要意义。而外周血DC的数值和性状常反映出生理和病理状况下DC在免疫应答中的地位,进而反馈出机体的免疫状况[1]。
结果显示,(1)脑胶质瘤患者术前外周血DC1、DC2占单个核细胞的百分含量均明显低于健康者,差异有统计学意义(P<0.05)。DC1、DC2百分含量的下降表明脑胶质瘤患者机体的抗原递呈细胞减少,激活T淋巴细胞的能力降低,提示脑胶质瘤存在保护性免疫反应减弱,机体免疫功能降低。(2)脑胶质瘤患者术后1~3 d外周血DC1、DC2占单个核细胞的百分比明显低于术前及健康者,差异有统计学意义(P<0.05),表明脑胶质瘤患者免疫功能的降低一方面可能是手术出血,另一方面手术创伤对机体细胞免疫功能也有显著的抑制作用,尤其是脑胶质瘤手术创伤较大,可使儿茶酚胺、糖皮质激素等多种内源性激素释放入循环血液中,损害T细胞的增殖;并可导致前列腺素、血清抑制活性多肽等的产生和释放,从而抑制患者的免疫功能。(3)脑胶质瘤患者术后5~7 d外周血DC1占单个核细胞的百分比高于术后1~3 d,差异有统计学意义(P<0.05)。表明胶质瘤患者在手术后一定时间段后机体的免疫功能抑制减少,患者肿瘤组织减少,肿瘤分泌的免疫逃避因子减少,免疫状态好转,而已知的研究结果表明术后的各种抑制作用在术后可持续4~10 d,然后才逐渐恢复[2-4]。作者认为,一方面是脑肿瘤切除术后时间较短,尽管机体的细胞免疫功能有所恢复,但仍未达到正常水平;另外,由于手术创伤使患者细胞免疫反应抑制等所致,这种抑制可长达3周,但这种抑制并非是细胞分化和发育异常,可能与淋巴细胞的异常分布有关。由于手术对机体组织的损伤及麻醉等均会造成严重干扰,可能在目前尚未明确的某种机制调节下,外周血淋巴细胞中的辅助T细胞较多地进入淋巴结、扁桃体、脾脏等组织,而抑制性T细胞则较多地从上述组织中释出,造成外周血辅助T细胞与抑制T细胞比值的相应改变[5]。(4)脑胶质瘤患者术后1~3 d及术后5~7 d患者外周血DC1/PBMC、DC2/PBMC均低于术前及健康者,差异有统计学意义(P<0.05),表明虽然胶质瘤患者在手术后一定时间段机体的免疫功能抑制减少,免疫状态好转,但可能由于脑手术创伤及胶质瘤无法完全切除,导致肿瘤细胞继续分泌免疫抑制因子等,致使患者免疫状态仍然低于术前。(5)不同恶性程度的脑胶质瘤患者在围手术期行DC1及DC2检测分析提示,低级别胶质瘤患者DC1/PBMC、DC2/PBMC分别高于高级别胶质瘤患者,原因可能是高级别胶质瘤患者瘤体生长更旺盛,浸润性更高,造成手术切除肿瘤困难,瘤体能够分泌更多的免疫抑制及免疫逃避因子。
结果提示,脑胶质瘤患者机体存在DC细胞亚群数量下降,从而影响病程。至于DC1、DC2下降的原因可能因脑内存在DC或DC的前体细胞但含量很少,而在荷瘤宿主中肿瘤细胞还释放一些免疫抑制因子,诸如血管内皮生长因子、白细胞介素10等可使DC凋亡或使其表面的分子表达发生变化,主要组织相容性复合体-Ⅱ类分子表达低,降低某些共刺激分子CD80、CD86等的表达,进而导致DC的功能缺陷使其无法有效递呈肿瘤抗原,不能激活T细胞以识别和杀伤[6-7]。近年来,DC应用于胶质瘤疫苗的研究报道较多,虽然取得了较大进展,但目前仍然处于动物实验及临床前期阶段[8-9]。大量研究表明,依据DC的生物学特性,可望制备相应的DC疫苗,根据患者在围手术期不同时间的免疫功能的变化及免疫功能与胶质瘤恶性程度的关系,为脑胶质瘤的生物免疫防治提供一定的理论依据。
[1]Reid SD,Penna G,Adorini L.The conlrol of T Cell responses by dendrilie cell subsets[J].Current Opinion in Immunol,2000,12(1):114-121.
[2]傅德良,倪泉兴,虞先浚,等.围手术期胰腺癌患者细胞免疫功能的表达[J].中国临床医学,2001,8(4):339-340.
[3]邢雪,吴在德,陈孝平,等.肝癌患者免疫功能的临床研究[J].中华实验外科杂志,1996,13(6):333-334.
[4]胡智勇,陈庆廉,胡劲,等.手术对淋巴细胞亚群细胞周期的影响[J].浙江大学学报:医学版,2000,29(1):36-39.
[5]O′Mahony JB,Palder SB,Wood JJ,et al.Depression of cell ularimmunity after multiple trau main the absence of sepsis[J].J Trauma,1984,24(10):869-874.
[6]Held FJ,Lütjohann B,Ungefroren H,et al.Interaction of transforming growth factor-beta(TGF-beta) and epidermal growth factor(EGF) in human glioma cells[J].J Neuro-oncol,2003,63(2):117-127.
[7]Yang T,Witham TF,Villa L,et al.Glioma-associated hyaluronan induces apoptosis in dendritic cells via inducible nitric oxide synthase:implications for the ues of dendritic cells for therapy of gliomas[J].Cancer Res,2002,62(9):2583-2591.
[8]Newton PJ,Weller IV,Williams IG,et al.Monocyte derived dendritic cells from HIV-1 infected individuals partially reconstitute CD4 T-cell responses[J].AIDS,2006,20(2):171-180.
[9]李艳佳,齐凤英.在防治HPV感染中树突状细胞的应用研究[J].国外医学皮肤性病学,2004,30(3):197-199.
贵州省科学技术基金资助项目[黔科合J字(2008)2201号]。
10.3969/j.issn.1672-9455.2015.08.034
A
1672-9455(2015)08-1112-02
2014-10-10
2014-11-20)
