GFAP启动子介导EGFP靶向肝星状细胞治疗肝纤维化的价值探索
2015-03-15范建华徐曼妮上海市黄浦区中心医院消化内科200002同济大学医学院预防医学教研室上海200092
范建华,徐曼妮(.上海市黄浦区中心医院消化内科 200002;2.同济大学医学院预防医学教研室,上海 200092)
GFAP启动子介导EGFP靶向肝星状细胞治疗肝纤维化的价值探索
范建华1,徐曼妮2△(1.上海市黄浦区中心医院消化内科 200002;2.同济大学医学院预防医学教研室,上海 200092)
目的 探索体内特异性靶向肝星状细胞(HSC)治疗肝纤维化的技术方法。方法 建立四氯化碳诱导的小鼠肝纤维化模型,构建胶质纤维酸性蛋白(GFAP)启动子调控增强绿色荧光蛋白(EGFP)表达载体,采用尾静脉高压注射方法将EGFP表达裸质粒转染到纤维化小鼠的肝脏。荧光显微镜观察EGFP在肝脏的表达及免疫荧光共定位,观测EGFP与HSC标志蛋白(DESMIN)和α-平滑肌肌动蛋白(α-SMA)的共定位。结果 EGFP与DESMIN和α-SMA共定位说明EGFP主要在HSC中表达,GFAP启动子能够调控外源基因在体内靶向HSC。结论 GFAP启动子介导体内靶向HSC,治疗肝纤维化策略具有临床应用的潜力。
胶质纤维酸性蛋白启动子; 增强绿色荧光蛋白; 肝星状细胞; 肝纤维化
肝纤维化是各种慢性肝病向肝硬化发展共有的病理改变和必经途径,其是一个复杂的过程,包括肝细胞的凋亡、间质细胞的增殖、细胞外基质沉积等过程,但其是可逆的,若能及早发现、积极治疗、及时终止和逆转纤维化的发生和发展,则有可能避免肝硬化发生[1]。诸多研究发现,肝星状细胞(HSC)的活化和增殖是肝纤维化发生的中心环节[2]。因此,抑制HSC的激活、增殖与促进HSC凋亡是防治肝纤维化的两条重要途径。HSC作为抗纤维治疗的靶细胞,已成为目前肝纤维化研究的热点[3]。但是现在基因治疗的探索和尝试很难在临床治疗上得到应用,一个最主要的原因是抗纤维化因素很难进行特异性的HSC靶向。虽然存在很多困难,近年来靶向HSC的抗纤维化基因治疗也有了初步的发展。一些HSC特异表达基因的启动子用于调控外源基因靶向HSC表达[4-5]。其中胶质纤维酸性蛋白(GFAP)启动子被发现可以用作HSC特异表达的调控元件,GFAP是一种中间丝蛋白,主要存在于星形细胞内,在中枢神经系统的星形细胞中特异性高表达,在肝脏的星形细胞中,GFAP也存在特异性的高表达。研究发现,鼠GFAP启动子调控的单纯疱疹病毒胸苷激酶基因(HSK-Tk)的转基因小鼠,用药物更昔洛韦处理后,能够特异性地清除小鼠肝脏的HSC[6]。在体外大鼠HSC系 (HSC-T6)的研究发现,GFAP启动子调控的转化生长因子-β(TGF-β)干扰核糖核酸(RNA),降低TGF-β表达,从而在信使核糖核酸(mRNA)和蛋白水平上降低胶原的合成[7]。已有研究证明,GFAP启动子能够作为调控外源基因特异性表达的基因治疗靶向调控元件,但是现在的研究大都停留在体外细胞系或是转基因鼠的研究,考虑到临床基因治疗的作用途径,需要外源导入抗纤维化药物。因此在本研究中,作者建立四氯化碳(CCl4)诱导的小鼠肝纤维化模型,激活HSC,构建GFAP启动子调控EGFP表达载体,采用尾静脉高压注射方法将增强绿色荧光蛋白(EGFP)表达裸质粒转染到纤维化小鼠的肝脏,通过观察EGFP在肝脏的表达分布,与HSC标志蛋白(DESMIN)和α-平滑肌肌动蛋白(α-SMA)的共定位,探讨GFAP启动子介导体内靶向HSC治疗策略的可行性。
1 材料与方法
1.1 试验材料
1.1.1 细胞系及试验动物 人HSC系LX-2由其建造者上海中医药大学徐列明教授惠赠,人肝细胞L-02购自中国科学院上海生命科学院细胞库;Bal/c小鼠购自同济大学医学院实验动物中心。
1.1.2 主要试剂 DESMIN兔抗体(Cell Signaling,P17661),α-SMA兔抗体 (Abcam,ab5696),CY3荧光二抗(美国Earthox荧光二抗,E031620),HE染色试剂盒(上海百蕊生物科技有限公司),Masson染色试剂盒(上海杰美基因医药科技有限公司)。
1.2 试验方法
1.2.1 GFAP启动子调控EGFP真核表达载体的构建 提取小鼠肝组织DNA,并以此为模板扩增小鼠基因GFAP启动子区5′-DNA序列,扩增引物为上游:5′-CCT CGC TAG C(NheⅠ)TCA CTG CTT ACG CCC AGG TC-3′,reverse:5′-CCT CAA GCT T(HindⅢ)GCG AGC AGC GGA GGT GAT-3′。构建到载体pCDNA3.1的NheⅠ和HindⅢ位点,筛选的阳性克隆经过测序确认,构建成载体pCDNA3.1-mGFAP-p。以pEGFP-N1为模板扩增EGFP cDNA序列,扩增引物为上游:5′-CCT GGA TCC(KpnⅠ)AAT GGT GAG CAA GGG CGA-3′,下游:5′-CCT GGA TCC(BamHⅠ)TTA CTT GTA CAG CTC GTC CAT G-3′。插入到pCDNA3.1-mGFAP-p的KpnⅠ和BamHⅠ位点,测序确定,构建成GFAP启动子调控EGFP的真核生物表达载体pCDNA3.1-mGFAP-p-EGFP。
1.2.2 EGFP在体外细胞系的表达验证 LX-2、L-02细胞用含10%胎牛血清的DMEM培养基于37 ℃,5% CO2培养箱中进行培养。将对数生长期的细胞消化铺板24孔板,铺板24 h后,细胞的生长密度大约为60%,用转染试剂lipo2000转染pCDNA3.1-mGFAP-p-EGFP及对照质粒pCDNA3.1-mGFAP-p,转染质粒的用量为0.8微克/孔,转染后的48 h,细胞置于荧光显微镜下观察。
1.2.3 CCl4诱导建立小鼠肝纤维化模型 试验动物BALB/c小鼠20只,每只小鼠的重量大约为16~18 g,试验小鼠分四组,分别为正常组(normal,N)、模型组(model,M)、对照组(control,C)及试验组(treatment,T),每组5只小鼠。每只小鼠每3天进行1次腹腔注射,模型组、对照组和试验组注射橄榄油稀释的CCl4溶液(按体积比,CCl4∶橄榄油=1∶4),第一次注射量为0.5 mL/kg小鼠,随后每次注射量为0.25 mL/kg小鼠。正常组注射同样量的橄榄油。CCl4处理4周后,取肝组织进行肝纤维化检测。
1.2.4 尾静脉高压注射法导入表达质粒 pCDNA3.1-mGFAP-p-EGFP及对照质粒pCDNA3.1-mGFAP-p采用尾静脉高压注射法导入小鼠的肝组织,具体步骤为:质粒用磷酸盐缓冲液(PBS)溶解,浓度为50 μg/mL,注射体积为1.6 mL/20 g小鼠,注射在5 s内完成;正常组和模型组注射同样剂量的磷酸盐缓冲液PBS。每5天进行1次尾静脉注射,试验组注射GFAP启动子调控的EGFP表达载体pCDNA3.1-GFAP-p-EGFP,对照组注射阳性对照质粒pCDNA3.1-GFAP-p。注射4周后,取小鼠肝组织进行检测。
1.2.5 制备小鼠的肝组织切片 小鼠采用脱颈法处死,迅速剖取肝脏,将肝脏右叶从中部纵向切开,从切面处取1.0 cm×1.0 cm×0.2 cm两块组织,一块置于4%多聚甲醛溶液4 ℃固定,以备石蜡切片的制备;另一块放入组织冻存液中液氮冻存,以备冷冻切片的制备。试验操作过程确保每只小鼠的取样部位尽量相同。
1.2.6 小鼠的肝组织切片HE染色 染色前用二甲苯脱去切片中的石蜡,再经由高浓度到低浓度乙醇,最后入蒸馏水,即可开始染色。将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟,酸水及氨水中分色,各数秒钟,流水冲洗1 h后入蒸馏水片刻。入70%和90%乙醇中脱水各10 min。入乙醇伊红染色液染色2~3 min,染色后的切片经乙醇脱水,再经二甲苯使切片透明,透明处理过的切片加上中性树胶,盖上盖玻片封固,于光镜观察。
1.2.7 小鼠的肝组织切片Masson染色 小鼠肝组织石蜡切片按常规方法脱蜡,经Weigert铁苏木素染色8 min,流水冲洗,置于1%盐酸乙醇分化2 min,用流水冲洗数分钟,随后丽春红酸性品红染色8 min,蒸馏水稍洗,再经磷钼酸溶液处理5 min,此时勿洗,直接用苯胺蓝复染5 min,然后经1%冰醋酸处理1 min或自来水漂洗,最后经95%乙醇、无水乙醇脱水,二甲苯透明,用中性树胶封片,于光镜下观察。
1.2.8 纤维化程度统计分析 对照组和CCl4处理组小鼠肝脏石蜡切片进行Masson染色,肝纤维化程度表示为蓝色染色区域(胶原)占整个视野的百分比。所用的图像分析系统为:Motic Images Advanced3.2,对每张切片随机选择5个视野(光镜200倍)进行分析,测量蓝色区域占视野百分比。
1.2.9 免疫荧光检测 取小鼠冷冻肝组织,用冷冻切片机切成厚度为7 μm的切片,置5%的多聚甲醛溶液中固定10 min后;去固定液,摇床轻晃洗涤3次,每次3~5 min;用封闭液封闭60 min,去封闭液,加入DESMIN兔抗体、α-SMA兔抗体一抗4 ℃作用过夜;去除一抗,用洗涤液洗涤3~5次,每次3~5 min,去除洗涤液,加入1 mL稀释好的CY3荧光标记羊抗兔的二抗,作用60 min;用洗涤液洗涤3~5次,每次3~5 min。加入4′,6-二脒基-2-苯基吲哚(DAPI)染液1 mL作用5 min,去除DAPI染液,用洗涤液洗涤3~5次,每次3~5 min,荧光显微镜下观察,拍照。
1.3 统计学处理 结果采用SPSS16.0软件进行t检验分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 GFAP启动子调控EGFP在体外细胞系特异表达 为确定GFAP启动子特异调控EGFP在HSC的表达,作者通过瞬时转染pCDNA3.1-mGFAP-p-EGFP及对照质粒pCDNA3.1-mGFAP-p到LX-2和L-02细胞,通过荧光显微镜观察绿色荧光蛋白在细胞的表达,结果发现,转染阴性对照质粒pCDNA3.1-mGFAP-p的LX-2和L-02几乎没有绿色荧光。转染pCDNA3.1-mGFAP-p-EGFP的LX-2细胞比L-02细胞绿色荧光更强,见图1。

图1 EGFP在LX-2、L-02细胞表达
2.2 CCl4诱导肝纤维化小鼠模型检测
2.2.1 HE染色观察小鼠肝脏病理变化 小鼠肝组织石蜡切片HE染色结果显示:N组小鼠肝脏柔软、红润、被膜光滑;肝细胞排列规则成索状,在中央静脉周围呈放射状分布;肝血窦结构清晰,无异常改变;肝细胞呈多边形,胞浆均匀,细胞核形态正常。注射CCl4组小鼠肝脏体积有所增大,部分的肝表面有直径约1 mm的点状白斑。汇管区和部分间质内弥漫性淋巴细胞浸润,汇管区附近有明显的坏死灶,见图2。
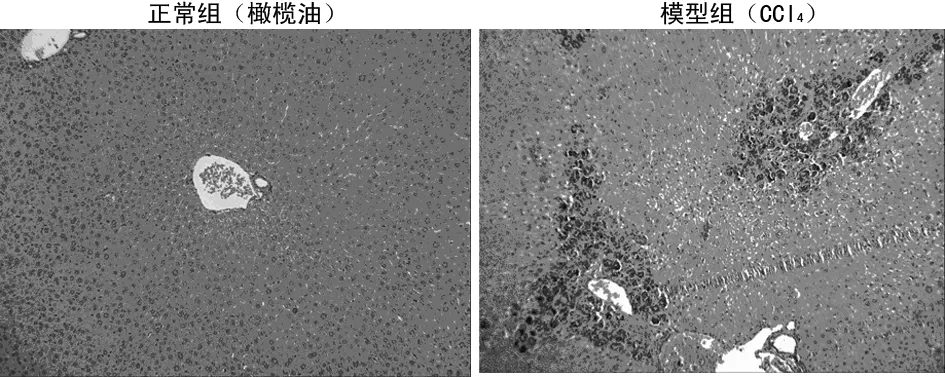
图2 肝组织HE染色(×40)
2.2.2 Masson染色显示肝组织纤维化病理性改变 Masson染色后的切片,胶原被染成蓝色,显微镜下观察,200倍下发现正常组小鼠的肝组织细胞排列整齐,肝小叶清晰可见,蓝色染色区域面积很少且主要集中在汇管区。CCl4处理组小鼠蓝色染色区域在汇管区及肝组织内部明显增多,分布杂乱,可见假小叶,见图3。

图3 肝组织Masson染色(×200)
2.2.3 纤维化程度统计分析 对照组和CCl4处理组小鼠肝脏石蜡切片平均纤维化区域分别为5.12%和43.5%(P<0.05)。结果显示,CCl4处理组Masson染色程度明显高于正常组小鼠,说明对照组与CCl4处理组小鼠肝脏纤维程度比较,差异有统计学意义(P<0.05)。
2.3 GFAP启动子介导EGFP在肝纤维化小鼠HSC的特异表达
2.3.1 EGFP在肝组织中的表达检测 荧光显微镜下观察发现,与注射pCDNA3.1-mGFAP-p对照组比较,注射pCDNA3.1-mGFAP-p-EGFP试验组的肝组织切片中分布明显的绿色荧光,说明尾静脉高压注射后将裸质粒转导入肝脏,并且证实真核表达质粒pCDNA3.1-mGFAP-p-EGFP在肝脏内表达,见图4。
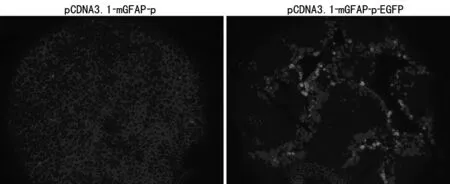
图4 肝组织的荧光表现(×100)
2.3.2 EGFP在HSC中特异表达 笔者用免疫荧光共定位试验对小鼠的冰冻切片进行EGFP和HSC共定位检测。静止HSC特异表达标志基因DESMIN以及活化HSC的特异表达标志基因α-SMA作为示踪蛋白用红色荧光指示。结果显示注射pCDNA3.1-mGFAP-p-EGFP质粒的试验组小鼠的EGFP绿色荧光分别与代表DESMIN和α-SMA的红色荧光相互重叠。结果说明由于GFAP启动子的特异性调控,通过尾静脉注射转染到肝脏的质粒,主要在HSC中表达,见图5。
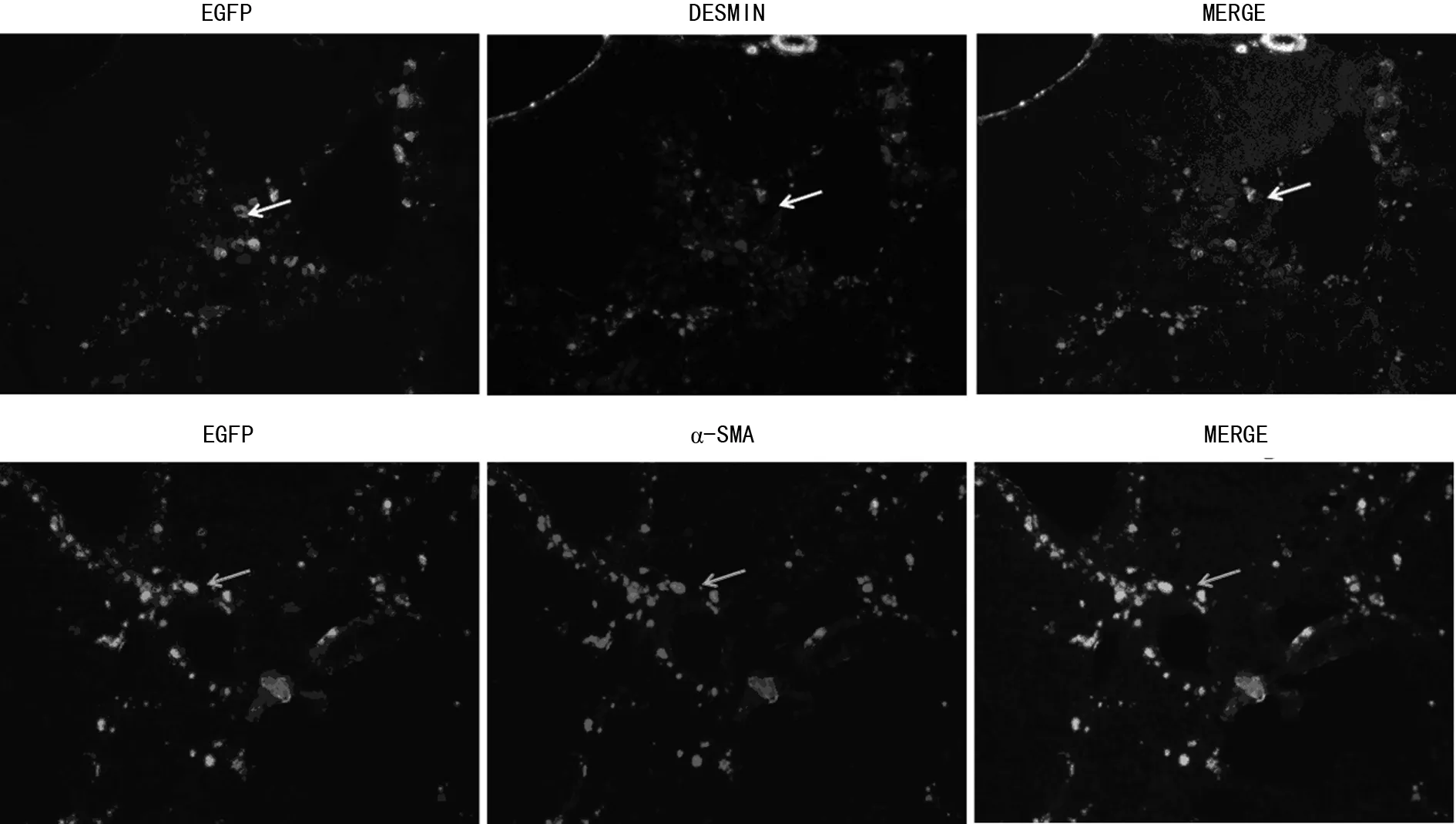
图5 EGFP与DESMIN和α-SMA的共定位
3 讨 论
慢性肝病大多数都有肝纤维化,其中25%~40%最终发展成肝硬化乃至肝癌。阻断肝纤维化成为慢性肝病治疗的一个关键问题。目前肝纤维化动物模型的建模方法包括化学药物刺激、免疫法以及胆管结扎等,CCl4诱导小鼠肝纤维化是经典动物模型[8]。本研究通过间隔腹腔注射CCl4诱导肝纤维化,通过HE与Masson染色检测炎性反应及胶原合成,确定肝纤维化模型是否建立成功。结果表明CCl4注射组的小鼠炎性反应程度及胶原合成显著高于正常组,说明本试验肝纤维化模型的建立是成功的。另外,HE染色也证明正常小鼠肝脏内部没有炎性反应、肝小叶排列正常,说明CCl4的溶解液(橄榄油)和质粒的缓冲液,腹腔注射及尾静脉高压注射等实验操作不影响纤维化的发生。
成纤维细胞是肝纤维化细胞外基质的主要来源细胞,HSC是肌成纤维细胞的主要来源细胞[9]。目前抗纤维化基因治疗有了初步发展,但基因治疗缺乏细胞选择性,可能会引起其他组织细胞的损害。为了减少不良反应,必须选择目的基因在肝脏HSC中特异表达的方法。目前有TIMP1、CSRP2、SM22alpha启动子能使基因在HSC中特异表达,但仍不够理想[10]。近来GFAP被认为是HSC特异表达的标志蛋白。因此,本研究采用尾静脉高压注射裸质粒的方法将pCDNA3.1-mGFAP-p-EGFP瞬时转染到肝纤维化小鼠肝脏中。这种转染方法是一种有效的、肝脏特异性的基因转移方法,通过瞬时注射大剂量的裸质粒将外源基因转染到动物的肝组织,裸质粒在肝细胞内瞬时表达,不会对肝脏产生长期干扰,已广泛用于外源基因的表达变化对肝脏疾病发生、发展影响的研究[11]。通过荧光显微镜检测EGFP绿色荧光验证转染效果,转染pCDNA3.1-mGFAP-p-EGFP质粒的小鼠肝脏绿色荧光强度显著高于转染pCDNA3.1-mGFAP-p对照质粒的小鼠,说明GFAP启动子能使EGFP在肝脏组织中高效表达。EGFP与星状细胞标志蛋白共定位实验结果显示,绿色荧光的EGFP与显示为红色荧光的DESMIN和α-SMA大部分重合在一起,说明EGFP主要在HSC中表达,进一步提示GFAP启动子能够调控外源基因可以在体内靶向HSC,因此,GFAP启动子介导体内靶向HSC治疗策略具有临床应用的潜力。
[1]Liu X,Xu J,Brenner DA,et al.Reversibility of liver fibrosis and inactivation of fibrogenic myofibroblasts[J].Curr Pathobiol Rep,2013,1(3):209-214.
[2]Tacke F,Weiskirchen R.Update on hepatic stellate cells:pathogenic role in liver fibrosis and novel isolation techniques[J].Expert Rev Gastroenterol Hepatol,2012,6(1):67-80.
[3]Su TH,Kao JH,Liu CJ.Molecular mechanism and treatment of viral hepatitis-related liver fibrosis[J].Int J Mol Sci,2014,15(6):10578-10604.
[4]Cheng K,Yang NN,Mahato RI.TGF-β1gene silencing for treating liver fibrosis[J].Mol Pharm,2009,6(3):772-779.
[5]Chen SW,Chen YX,Zhang XR,et al.Targeted inhibition of platelet-derived growth factor receptor-beta subunit in hepatic stellate cells ameliorates hepatic fibrosis in rats[J].Gene Therapy,2008,15(21):1424-1435.
[6]Puche JE,Lee YA,Jiao J,et al.A novel murine model to deplete hepatic stellate cells uncovers their role in amplifying liver damage in mice[J].Hepatology,2013,57(1):339-350.
[7]Yang NN,Mahato RI.GFAP promoter-driven RNA interference on TGF-β1to treat liver fibrosis[J].Pharm Res,2011,28(4):752-761.
[8]Weiler-Normann C,Herkel J,Lohse AW.Mouse models of liver fibrosis[J].Z Gastroenterol,2007,45(1):43-50.
[9]Fallowfield JA.Therapeutic targets in liver fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2011,300(5):709-715.
[10]Herrmann J,Arias M,Van De Leur E,et al.CSRP2,TIMP-1,and SM22alpha promoter fragments direct hepatic stellate cell-specific transgene expression in vitro,but not in vivo[J].Liver Int,2004,24(1):69-79.
[11]Xu W,Wang LW,Shi JZ,et al.Effects of RNA interference targeting transforming growth factor-beta 1 on immune hepatic fibrosis induced by Concanavalin A in mice[J].Hepatobiliary Pancreat Dis Int,2009,8(3):300-308.
The value of treatment to hepatic fibrosis with GFAP promoter directs EGFP targeting to hepatic stellate cell
FANJian-hua1,XUMan-ni2△
(1.DepartmentofGastroenterology,HuangpuDistractCenterHospital,Shanghai200002,China;2.DepartmentofPreventionMedicine,TongjiUniversity,Shanghai200092,China)
Objective To find the possibility that the glial fibrillary acidic protein (GFAP) promoters modulate the exogenous gene specific expression in HCS for hepatic fibrosis treatment.Methods Established a model of carbon tetrachloride-induced hepatic fibrosis in mice.pCDNA3.1-mGFAP-p-EGFP plasmid was constructed and injected into mice liver by hydrodynamics based transfection method.EGFP expression in the liver was observated under Fluorescence microscopy to evaluate the efficiency of GFAP promoter.The co-expressions of EGFP with DESMIN and α-SMA was detected by immunofluorescence.Results The expression of EGFP in liver driven by GFAP promoter was co-localized with HCS specific markers such as DESMIN and α-SMA.Illustrated that GFAP promoter could drive EGFP specific expression in HSCS but not in hepatocytes of liver fibrosis murine.Conclusion These observation demonstrate that GFAP promoter could in vivo regulate expression of target gene in HSC,offering a useful tool for gene therapy against hepatic fibrosis.
glial fibrillary acidic protein promoter; enhanced green fluorescent protein; hepatic stellate cells; hepatic fibrosis
范建华,女,主治医师,硕士,主要从事消化系统疾病基础及临床研究。
△通讯作者,E-mail:xmann@sohu.com。
10.3969/j.issn.1672-9455.2015.08.017
A
1672-9455(2015)08-1070-04
2014-11-15
2014-12-10)
